荧光免疫层析法检测全血2019-nCoV IgM和IgG抗体在新型冠状病毒肺炎诊断中的应用
陈泽衍,马 雯,张立俊,许玉成,申红卫,刘 娇,梁 琪,陈晓静,贾兴旺
(1.南方医科大学深圳医院检验科,广东深圳 518110;2.深圳市福田区疾病预防控制中心,广东深圳 518040; 3.深圳大学总医院检验科,广东深圳 518055)
自2019年12月至今,2019-nCov 已造成全国八万多人感染,三千多人死亡。2020年1月20日我国将新型冠状病毒感染的肺炎纳入法定乙类传染病,并采取甲类传染病的预防、控制措施[1]。COVID-19 潜伏期长、进展迅速、死亡率高,严重影响人民的身体健康,因此,建立早期、快速、简便、准确的诊断体系,及时隔离疑似病例,是切断这种烈性传染病传播最重要的手段。
机体感染2019-nCoV 后,免疫系统会针对该病毒发生免疫反应,产生特异性抗体。IgM 抗体是机体受感染后免疫系统最早产生的抗体,可作为早期感染的指标;IgG 抗体的产生通常晚于IgM,是既往感染的指标。特异性抗体IgM 和IgG 广泛应用于各种疾病的临床诊断,国家卫生健康委员会发布的《新型冠状病毒肺炎防控方案(第七版)》[2]已把新型冠状病毒抗体检测列为疑似病例确诊的病原学证据之一。本研究通过检测全血IgM 和IgG 抗体来评估荧光免疫层析法检测2019-nCoV IgM 和IgG 的应用价值,从而更好地指导临床对COVID-19 患者的分类管理。
1 材料与方法
1.1 研究对象 选取2019年1~2月期间首次2019-nCoV 核酸阳性而以后连续两次核酸检测均阴性的患者作为观察组,将本院同期发热门诊排除COVID-19 的其他发热患者作为对照组。观察组28例,男性15 例,女性13 例,年龄15~62 岁,平均年龄38.82±12.23 岁;对照组30 例,男性19 例,女性11 例,年龄7~82 岁,平均年龄36.43±17.74岁。两组患者上述资料对比无明显差异(P>0.05)。该回顾性研究经我院伦理委员会批准(伦理号:NYSZYYEC20200009),所有患者数据都是匿名的,故予以豁免患者知情同意。纳入标准:①符合《新型冠状病毒感染的肺炎诊疗方案 (试行第七版) 》[2]中的诊断标准;②均属于首次发病;③首次核酸检测阳性而第二次以后连续两次核酸检测均阴性者;④临床资料完整者。排除标准:①存在自身免疫性疾病患者;②有免疫缺陷疾病患者;③患有恶性肿瘤患者。
1.2 试剂与仪器 检测试剂用北京丹大生物技术有限公司生产的新型冠状病毒抗体测定试剂盒(荧光免疫层析法),用配套的干式荧光免疫分析仪(KHF01)检测2019-nCoV IgM 和IgG 水平。根据试剂盒说明书,所有阳性值以大于正常范围为判断标准。
1.3 方法 抽取患者EDTA 抗凝全血2~3ml,检测2019-nCoV IgM 和IgG 水平,比较两组患者全血2019-nCoV IgM 和IgG 检测值及阳性检出率,阳性检出率=阳性检出例数/研究组例数×100%。比较全血2019-nCoV IgM 和IgG 检测及联合检测诊断新型冠状病毒肺炎的灵敏度和特异度。
1.4 统计学分析 采用Excel 2013 建立数据库,采用SPSS 20.0 进行统计学分析,其中:抗体水平采用中位数和四分位间距描述,计数资料采用百分比描述;率的比较用χ2检验(Fisher 精确检验),对总体不符合正态分布或方差不齐的两组连续变量的比较采用Wilcoxon 秩和检验,检验水准α= 0.05。
2 结果
2.1 两组患者全血2019-nCoV IgM 和IgG 检测值比较 见表1。进行秩和检验分析观察组的抗体水平显著高于对照组,差异具有统计学意义。
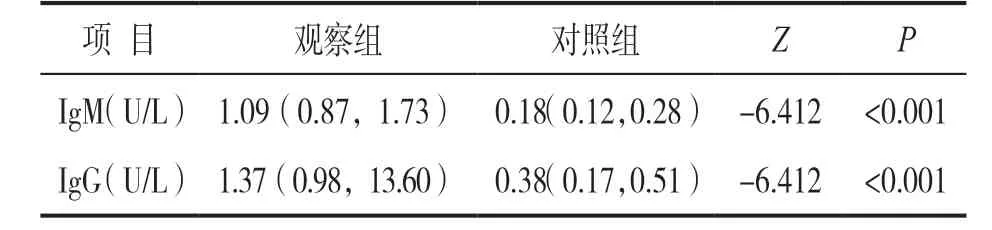
表1 观察组与对照组IgM 和IgG 抗体比较[M(P25~P75) ]
2.2 两组患者2019-nCoVIgM 和IgG 的阳性检出率比较 见表2。观察组IgM 和IgG 的阳性检出率分别为71.4%和75.0%,IgM 和IgG 联合检测阳性检出率为96.4%,高于IgM 或IgG 单项检测,对照组IgM 或IgG 的阳性检出率为0%。

类 别 观察组(n=28) 对照组(n=30)IgM+,IgG- 21.4 0 IgM+,IgG+ 50 0 IgM-,IgG+ 25 0 IgM-,IgG- 3.6 100
2.3 2019-nCoV IgM 和IgG 检测的灵敏度和特异度比较 2019-nCoV IgM 和IgG 检测的灵敏度分别为71.4%和75.0%,特异性均为100%,两者联合检测的灵敏度为96.4%。
3 讨论
荧光RT-PCR 是检测2019-nCoV 核酸最成熟、应用最广的实验室确诊方法,但此方法敏感度较低,且对实验条件、设施、人员要求高,检测时间长而且影响因素多,单纯使用咽拭子筛查有可能出现假阴性[3]。最新的研究显示,咽拭子在新型冠状病毒核酸检测中存在较高的漏检率[4],此外,样本的采集、运输、储存和核酸检测试剂盒质量等问题均可影响检测结果[5-9]。
有研究者针对98 例SARS 患者的研究发现一般在感染7 天后可以发现IgM 阳性,并在发病3 周后阳性最高,15 天左右出现IgG 阳性,60 天左右阳性最高,且持续时间较长[10]。ZHANG 等[11]连续监测15 例COVID-19 患者IgG 和IgM 的滴度变化,发现采样第5 天IgG 的阳性率(81%~100%)和IgM 的阳性率(50%~81%)都大幅增加。我们的研究结果显示,观察组2019-nCoV IgM 和IgG的抗体水平显著高于对照组,差异具有统计学意义(P<0.05)。2019-nCoV IgM 和IgG 的阳性检出率分别为71.4%(20/28)和75.0%(21/28),而联合检测阳性检出率高达96.4%(27/28),由此可见,2019-nCoV IgM 和IgG 抗体检测试剂具有较高的灵敏度, 2019-nCoV IgM 和IgG 抗体的检测有望弥补核酸检测漏检的风险。对照组中30 例全血标本2019-nCoV IgM 和IgG 抗体均为阴性,说明该试剂盒对COVID-19 的诊断具有较高的特异度,可以作为COVID-19 的筛查和诊断。
观察组中IgM 单阳性患者占21.4%(6/28),提示该部分患者初次感染载量较低的2019-nCoV 并处于感染早期,机体免疫应答产生少量的IgM 抗体而尚未产生IgG,应关注这部分患者病情的变化。IgM 和IgG 均阳性患者占50%(14/28),说明该观察组的大部分患者处于感染中期或恢复期,IgM 尚未减低至检测下限,持久性抗体IgG 已产生,机体已经对2019-nCoV 产生了一定的免疫能力;或核酸检测结果假阴性,患者处于感染活跃期。IgG 单阳患者占25%(7/28),这部分患者随着IgM 浓度的下降直至消失和IgG 浓度的升高,预示患者逐渐痊愈并获得对2019-nCoV 的免疫力,如恢复期IgG抗体仍持续升高,较急性期增加4 倍及以上时,应堤防复发感染的可能。IgM 和IgG 均阴性患者占3.6%(1/28),通过分析该患者的临床症状和流行病学史,虽然该患者连续两次核酸检测和抗体检测均阴性,但临床症状和影像学检查符合疑似病例诊断,且抗体水平较对照组的平均水平均偏高,患者可能处于2019-nCoV 感染“窗口期”,需进一步监测抗体滴度的变化。
2020年2月21日国家卫生健康委员会发布的《新型冠状病毒肺炎防控方案(第五版)》中附件4《新型冠状病毒肺炎实验室检测技术指南》[12],指出应用新型冠状病毒抗体检测可作为新型冠状病毒肺炎的辅助诊断;2020年3月3日国家卫生健康委员会发布的《新型冠状病毒肺炎防控方案(第七版)》在原有基础上增加了 “血清学检测”作为依据[2],把新型冠状病毒抗体检测列为疑似病例确诊的病原学证据之一,随着检验手段的不断提升,防控方案的不断更新,抗体检测在COVID-19 的诊断中起着重要的作用。本研究采用外周血样本进行2019-nCoV IgM 和IgG 抗体检测,样本采集和保存简单易行可控,避免多次采集鼻咽拭子标本所冒被传染的风险,检测方法不需要特别的操作人员,基层医院均可开展,实验条件要求低,操作简便快捷,15min 即可出结果。
综上所述,采用荧光免疫层析法检测2019-nCoV IgM 和IgG 诊断COVID-19 患者具有灵敏度高、特异度好的特点。该方法操作简单、适合中等批量样本筛查,是对核酸检测的良好补充。利用该方法监测患者抗体浓度变化可动态监测患者康复过程,本文的样本例数有限,2019-nCoV IgM 和IgG抗体的临床价值有待后续工作继续研究。

