藜麦糠黄酮的分离纯化及成分测定
范三红,郭定一,张锦华,李多,白宝清*
(1.山西大学 生命科学学院,太原 030006;2.特色植物资源研究与利用山西省重点实验室(山西大学),太原 030006)
藜麦,属藜科,原产于南美洲,种植历史悠久, 因为其营养价值丰富,深受当地居民的喜爱,并享有“粮食之母”的美誉[1]。 现今,中国成为藜麦的最大种植国之一,主要分布于山西、青海、西藏等地。黄酮类物质目前已广泛应用于食品和调味品等领域[2,3]。食品中黄酮类物质种类丰富,含量也较高[4,5]。食品中的黄酮类化合物具有良好的抗氧化、抗炎等生理活性[6,7],藜麦糠中黄酮含量较高,因而具有较大的研究价值[8]。
黄酮类物质的分离纯化方法有:薄层色谱法、吸附树脂层析法等, 其中应用较为广泛的是大孔吸附树脂层析法[9]。大孔吸附树脂外形呈球状,内部含有许多细小的孔隙,用于有机化合物的分离纯化,通过吸附性和分子筛原理而达到分离纯化的目的[10]。大孔树脂内部呈网状结构,孔径较大,吸附效果优良,大孔吸附树脂吸附技术最早用于废水处理、医药工业、化学工业、分析化学、临床检定和治疗等领域,近年来在我国已广泛用于中草药有效成分的提取、分离、纯化工作中[11]。
本实验利用大孔吸附树脂对从藜麦糠中提取的黄酮类化合物进行分离纯化,用高效液相色谱对纯化的藜麦糠黄酮类化合物进行分析。本实验为藜麦糠中有效成分的分离、纯化提供了实验支撑,为藜麦糠天然黄酮类化合物的研究奠定了基础。
1 材料与方法
1.1 材料与试剂
藜麦糠:山西省华青藜麦产品开发有限公司;大孔树脂(AB-8、D101、NKA-9、HPD750、HPD950、HPD450、X-5):北京索莱宝科技有限公司;芦丁标准品(AR≥98%):美国 Sigma公司;其他所用试剂均为分析纯。
1.2 仪器与设备
JP-040ST 型超声波清洗机 深圳市洁盟清洗设备有限公司;TG16A-WS 型高速离心机 武汉爱斯佩科学仪器有限公司;SP-2000UV 型紫外可见分光光度计 上海光谱仪器有限公司;1260型高效液相色谱仪 安捷伦科技有限公司。
1.3 实验方法
1.3.1 藜麦糠黄酮提取物的制备
精确称取藜麦糠粉末10.0 g,于超声温度50 ℃、料液比1∶30(g/mL)、乙醇体积分数60%的条件下超声提取20 min,重复提取滤渣,合并3次滤液。将黄酮类化合物提取液旋转蒸发得藜麦糠黄酮粗提浸膏,用无水乙醇充分浸泡6 h,真空抽滤除去糖类等极性杂质,二次旋转蒸发除醇,将浸膏用蒸馏水稀释成不同质量浓度待测液。
1.3.2 树脂的预处理
将7种大孔树脂分别放置于烧杯中,用95%乙醇溶液在室温下浸渍24 h,充分饱胀树脂。用蒸馏水缓慢洗涤树脂至无醇味。将树脂湿法装柱(Ф15 mm×400 mm),用5% HCl和5% NaOH溶液以3 BV/h速率淋洗,用蒸馏水洗至流出液pH为7后备用。
1.3.3 大孔吸附树脂的筛选
1.3.3.1 大孔树脂的静态吸附和静态解吸
分别称取经预处理的7种大孔树脂各5 g于具塞三角瓶中,加入50 mL 2.0 mg/mL藜麦糠黄酮类化合物提取液,于HT-100恒温振荡摇床(25 ℃,160 r/ min)中振荡吸附24 h后真空抽滤,测得平衡液中黄酮质量浓度[12]。用蒸馏水缓慢将大孔树脂表面的样品溶液冲去,于上述树脂中分别加入75% C2H5OH溶液50 mL振荡解吸24 h(25 ℃,160 r/min),测定吸附和解吸液中黄酮类化合物的质量浓度,并根据下式分别得出各项指标:
吸附量Q(mg/g)=(C0-C1)×V1/W。
(1)
吸附率A(%)=(C0-C1)/C0×100。
(2)
解吸量(mg/g)=C2×V2/W。
(3)
解吸率D(%)=(V2×C2)/(W×Q)×100。
(4)
回收率(%)=洗脱液中的黄酮含量/上柱黄酮量×100。
(5)
式中:C0为样液黄酮浓度(mg/mL);C1为吸附后滤液黄酮浓度(mg/mL);C2为解吸液黄酮浓度(mg/mL);V1为吸附液体积(mL);V2为解吸液体积(mL);W为干树脂量(g)。
1.3.3.2 大孔树脂的静态吸附解吸动力学[13]
按照1.3.3.1所描述的方法,于HT-100恒温振荡摇床(25 ℃,160 r/ min)中振荡,每间隔1 h吸取平衡液并测定其质量浓度,共测定8次,模拟得出树脂的静态吸附与解吸附动力学曲线。
1.3.4 大孔树脂纯化条件优化[14]
1.3.4.1 样液浓度对大孔树脂吸附效果的影响
配制0.5,1.0,1.5,2.0,2.5,3.0,3.5 mg/mL的藜麦糠黄酮类化合物粗提液,将5.0 g优选的大孔树脂湿法装柱。分别取各浓度藜麦糠黄酮粗提液的30 mL调节样液pH为6.0,振荡吸附(25 ℃,160 r/min,24 h),柱上洗脱(2 BV,乙醇溶液75%),并测定洗脱液的黄酮质量浓度,计算回收率。
1.3.4.2 上样量对大孔树脂吸附效果的影响
称取5.0 g优选的大孔树脂湿法装柱。取2.0 mg/mL pH为6.0的藜麦糠黄酮溶液进行上样,上样流速为3 mL/min,上样量分别为10,12,16,20,25,27,30,35,40,45 mL,振荡吸附后(25 ℃,160 r/min,24 h),水洗,再用2 BV 75%乙醇溶液解吸附,测定各组洗脱液中黄酮含量,计算得出回收率。
1.3.4.3 乙醇浓度对大孔树脂吸附效果的影响
称取5.0 g优选的大孔树脂湿法装柱。固定样液pH为6.0,藜麦糠黄酮溶液为2.0 mg/mL,上样量为30 mL,样品吸附完毕后进行水洗,分别用2 BV浓度为35%、45%、55%、65%、75%、85%、95%的乙醇溶液解吸。测定各组解吸液中黄酮含量,计算得出回收率。
1.3.4.4 样液pH对大孔树脂吸附效果的影响
称取5.0 g优选的大孔树脂湿法装柱。取2.0 mg/mL上样量为30 mL的藜麦糠黄酮溶液进行上样,上样前用1 mol/L的HCl和1 mol/L的NaOH将样液pH值分别调节为3.0,4.0,5.0,6.0,7.0,8.0,11.0,振荡吸附后(25 ℃,160 r/min,24 h),水洗,再用2 BV 75%乙醇溶液解吸附,得不同 pH值解吸液中黄酮的质量浓度,测定各组洗脱液中黄酮含量,计算得出回收率。
1.3.4.5 解吸液体积对大孔树脂吸附效果的影响
对优选的大孔树脂湿法装柱,装柱量为5.0 g。固定样液pH为6.0,藜麦糠黄酮溶液为2.0 mg/mL,再用75%的乙醇溶液以2 BV/h进行解吸附,然后用自动部分收集器分部收集解吸液,测得各收集管目标溶液的质量浓度,绘制出洗脱曲线。
1.3.5 藜麦糠黄酮分离纯化前后纯度的测定[15]
按照所得最优纯化条件对藜麦糠黄酮粗提物进行吸附、解吸,测定经纯化后的黄酮浓度,解吸液经旋转蒸发仪浓缩成膏状,真空干燥到恒重,准确称量其质量。通过下式得出藜麦糠黄酮的纯度:
Y=V×C×100/M。
(6)
式中:Y为纯化后黄酮的纯度(%);V为解吸液体积(mL);C为解吸液中黄酮浓度(mg/mL);M为干燥后黄酮的总质量(mg)。
1.3.6 高效液相色谱分析藜麦糠黄酮样品
准确称取经纯化、真空干燥的藜麦糠黄酮类化合物0.04 g,用色谱甲醇定容至50 mL容量瓶中备用[16]。采用安捷伦1260型高效液相色谱仪对制备的样品进行定性分析。
1.3.6.1 色谱条件
高效液相色谱法的工作条件:色谱柱Innoval C18色谱柱(4.6 mm×250 mm,5 μm);流动相A :100%甲醇,流动相B:1%乙酸;流速0.6 mL/min;检测波长360 nm,进样量10 μL;柱温40 ℃,梯度洗脱条件见表1。
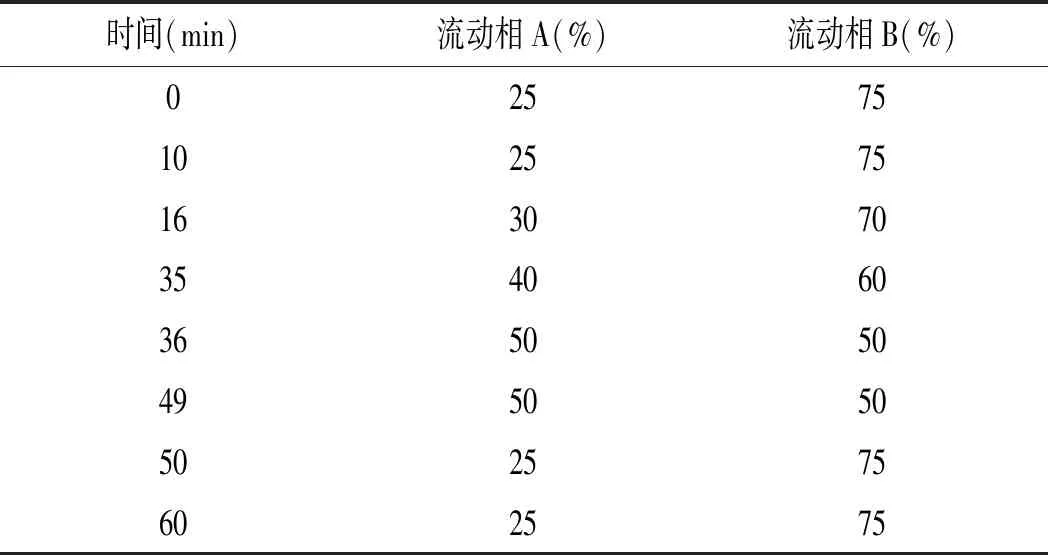
表1 HPLC流动相梯度洗脱时间表Table 1 HPLC mobile phase gradient elution schedule
1.3.6.2 混合标准样品的制备
以甲醇溶解标准样品得芦丁0.040 mg/mL、槲皮素0.024 mg/mL、槲皮苷0.0200 mg/mL、异槲皮苷0.016 mg/mL。
2 结果与分析
2.1 大孔吸附树脂的筛选
2.1.1 大孔树脂的静态吸附和静态解吸
由表2可知,所选7种大孔树脂对藜麦糠黄酮类化合物的吸附、解吸效果各不相同,由于7种树脂的表面结构、孔径大小、键合情况各异而导致其对藜麦糠黄酮化合物的吸附和解吸效果均有差异。其中,中极性HPD750吸附量高达2.032 mg/g,吸附率最高,达到79.20%,但其解吸率最低,只有31.49%,其解吸量为0.640 mg/g。而中极性HPD950吸附量达1.536 mg/g,吸附率达59.90%,HPD950的解吸效果明显强于其余树脂,其解吸率达86.41%,解吸量为1.327 mg/g,其余树脂的吸附和解吸效果均较差。综合树脂的吸附和解吸能力可得:HPD950树脂与藜麦糠黄酮极性最为相似,最适宜分离纯化藜麦糠黄酮。
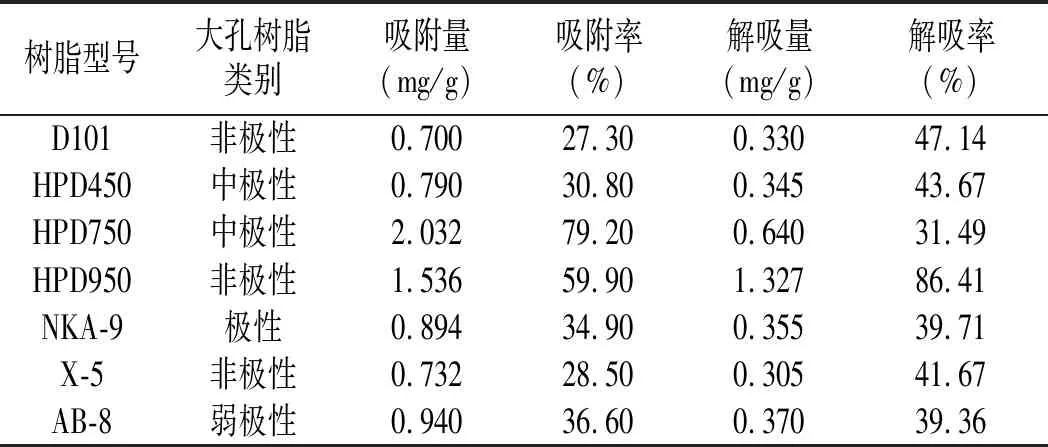
表2 大孔树脂的吸附和解吸性能Table 2 Absorption and desorption properties of macroporous resins
2.1.2 吸附树脂的静态吸附和解吸动力学曲线
在前3 h内各树脂吸附效果较为明显,且HPD750有较好的吸附效果,见图1。
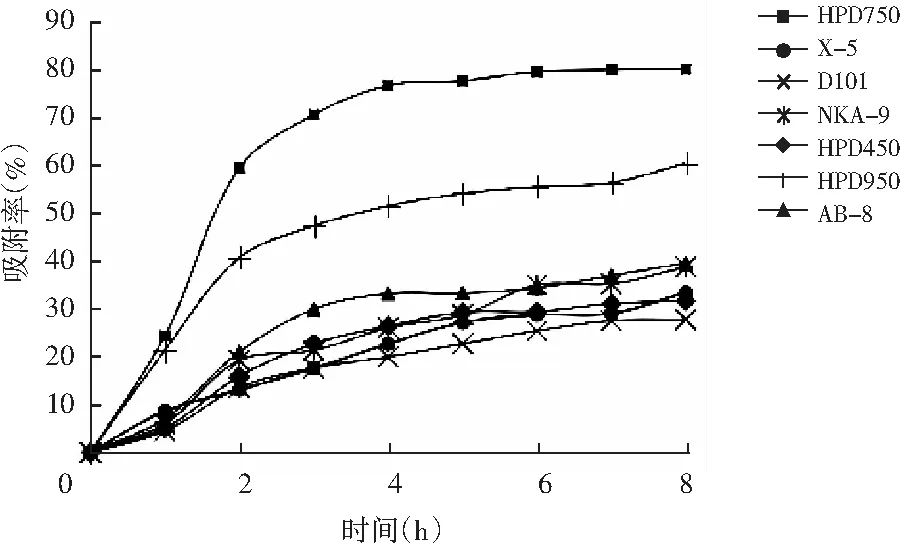
图1 不同类型树脂对藜麦糠黄酮静态吸附动力学曲线Fig.1 Dynamic curves of static adsorption of flavonoids from quinoa chaff by different types of resins
由图1可知,HPD750树脂吸附速率快,吸附量高达1.833 mg/g,吸附率达到76.30%,明显高于其他型树脂。而中极性HPD950吸附率仅次于HPD750,达到吸附饱和点时,吸附量为1.336 mg/g,吸附率为57.1%。除HPD750和HPD950外,其他树脂对藜麦糠黄酮化合物的吸附效果较差,达到吸附饱和点时的吸附率均低于50%。这可能是由于藜麦糠黄酮含有的羰基、缩醛式衍生物与中极性树脂分子间作用力较强或产生氢键,所以中极性的树脂对其吸附效果较好。
由图2可知,HPD950大孔树脂的解吸效果明显优于其他型大孔树脂;在0~2 h,HPD950解吸率斜率最大,在此段时间内,吸附在HPD950大孔树脂上的黄酮化合物能被洗脱液高效溶出;在2~3 h时,HPD950大孔树脂的解吸率虽有所上升,但其斜率明显低于前2 h。在洗脱时间达到4 h后,HPD950大孔树脂基本达到解吸平衡点,其解吸率达到最高。在对藜麦糠进行静态吸附动力学考察时,有较高吸附率的HPD750大孔树脂的解吸率却很低。在达到解吸平衡时,其解吸率低于50%,远低于HPD950型大孔树脂,解吸附效果较差。除HPD950和HPD750大孔树脂以外,各大孔树脂在2 h内快速解吸;在达到解吸平衡点后,各树脂的最高解吸率均小于50%,解吸效果较差。故由各树脂的吸附解吸动力学曲线以及各项吸附解吸指标,可确定HPD950型为最适合纯化藜麦糠黄酮类化合物的大孔树脂。

图2 不同类型树脂对藜麦糠黄酮静态解吸动力学曲线Fig.2 Dynamic curves of static desorption of flavonoids from quinoa chaff by different types of resins
2.2 HPD950型树脂对藜麦糠黄酮的条件优化
2.2.1 样液浓度的影响
由图3可知,在藜麦糠黄酮化合物浓度低于2.5 mg/mL时,回收率随样液浓度的增加呈上升趋势,在藜麦糠黄酮浓度达2.5 mg/mL时达到最高回收率59.80%,浓度大于2.5 mg/mL时其回收率略微减小,基本不受质量浓度改变的影响。可知在浓度为2.5 mg/mL时达到树脂的饱和吸附点,浓度过高不利于吸附且浪费样品,故HPD950树脂纯化黄酮类化合物最佳的上样浓度为2.5 mg/mL。
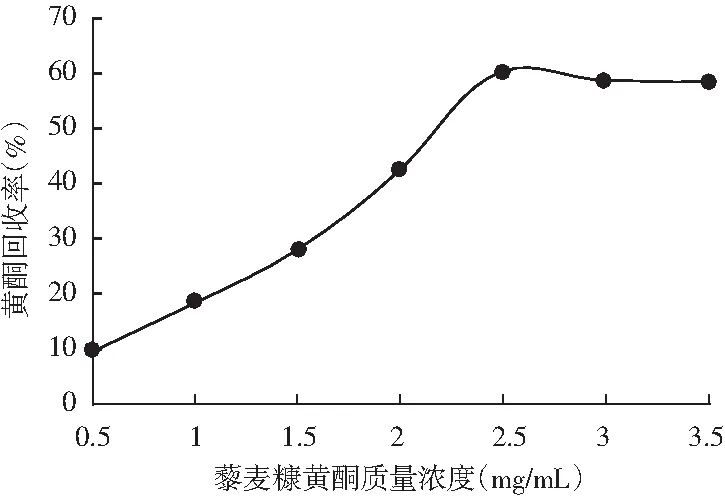
图3 不同质量浓度藜麦糠黄酮对HPD950大孔树脂分离纯化藜麦糠黄酮的影响Fig.3 Effects of different concentration of quinoa chaff flavonoids on the separation and purification of quinoa chaff flavonoids by HPD950 macroporous resin
2.2.2 上样量的影响
由图4可知,当上样体积过小时,柱内大孔树脂的最大吸附量大于样液中黄酮类化合物的量,造成吸附剂浪费,纯化效率低。当上样体积小于35 mL时,黄酮回收率随着上样体积的增加逐渐增大,当上样体积为35 mL时达最高回收率67.3%,此时大孔树脂对黄酮的吸附基本接近平衡。而当上样体积继续增加时,黄酮回收率略微下降,因为样品溶液中过量的黄酮类化合物在吸附柱上没有被树脂充分吸附,使样液流失,回收率降低。上样体积与吸附剂比例过低或过高均会使回收率降低。因此,选择35 mL为最佳上样体积。
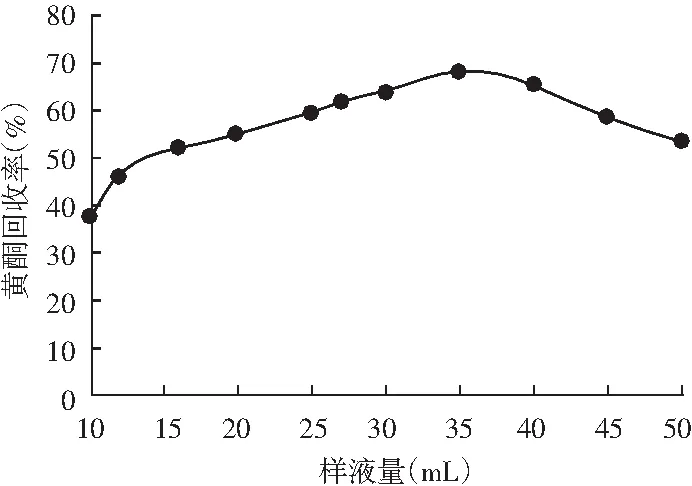
图4 样液量对HPD950大孔树脂分离纯化藜麦糠黄酮的影响Fig.4 Effects of sample solution volume on quinoa chaff flavonoids separated and purified by HPD950 macroporous resin
2.2.3 样液pH的影响
由图5可知,随着pH值的增大,黄酮回收率呈先增大后减小的趋势。上样液pH值对黄酮回收率的影响较为明显。当上样液pH值为6.0时,藜麦糠黄酮的回收率最大,达到53.15%。pH≤4和pH≥7时,黄酮回收率均低于50%。这是由于过酸或过碱条件下处理样品,不仅会破坏藜麦糠黄酮化合物的化学性质,而且会影响大孔树脂的结构,使大孔树脂对藜麦糠黄酮化合物的分离纯化效果变差。与碱性环境相比,弱酸环境下更有助于HPD950型大孔树脂对藜麦糠黄酮的分离纯化[17]。因此,上样液的最佳pH值为6.0。
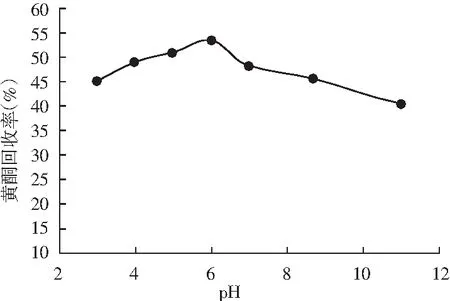
图5 上样液pH对HPD950大孔树脂分离纯化藜麦糠黄酮的影响Fig.5 Effects of sample solution pH on quinoa chaff flavonoids separated and purified by HPD950 macroporous resin
2.2.4 乙醇浓度的影响
由图6可知,乙醇浓度小于75%时,黄酮回收率随着乙醇浓度的上升而升高,乙醇浓度大于75%时,黄酮回收率逐渐降低。因为在低浓度的乙醇解吸液中,藜麦糠黄酮化合物的溶解性较差,解吸效果也差。当解吸液浓度为75%时,回收率达到最高值69.87%,当解吸液浓度在75%以上时,黄酮的溶解性变小[18],回收率变低,洗脱效果变差。最终确定最佳乙醇浓度为75%。
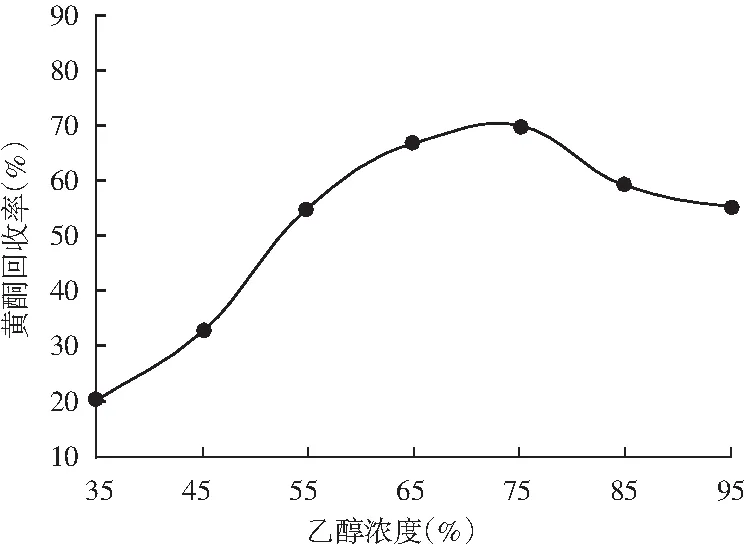
图6 乙醇浓度对大孔树脂解吸效果的影响Fig.6 Effects of ethanol concentration on desorption effect of macroporous resin
2.2.5 解吸液体积对大孔树脂解吸效果的影响
用浓度为75%的C2H5OH溶液对HPD950树脂解吸,并分步收集解吸液,共20管,每10 mL为一管,分别检测各管中黄酮浓度,绘制洗脱曲线,见图7。
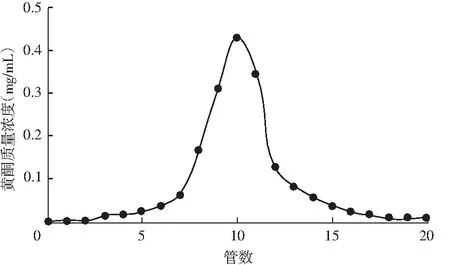
图7 HPD950大孔树脂洗脱藜麦糠黄酮曲线Fig.7 The elution curve of quinoa chaff flavonoids by HPD950 macroporous resin
由图7可知,管数小于7时,解吸液的黄酮浓度随着管数的增加缓慢增加。当收集到10管时,黄酮浓度最大,为0.427 mg/mL,此后,随着管数的增加,黄酮浓度反而降低,黄酮类化合物主要集中在7~13管。当管数为18管时,洗脱液内已基本检测不到黄酮类化合物,表明洗脱体积达到180 mL时吸附柱中黄酮基本解吸完毕。所以,最佳解吸液体积为180 mL。
2.3 藜麦糠黄酮分离纯化前后纯度的测定
藜麦糠黄酮经HPD950树脂充分地吸附和解吸后,测得回收率为77.4%,纯度由纯化前的13.0%上升到纯化后的68.0%。结果表明HPD950树脂对藜麦糠黄酮粗提液具有较好的分离纯化效果。
2.4 藜麦糠黄酮化合物定性分析
由图8中(B)可知,分离纯化的藜麦糠黄酮样品由9种成分组成,对照图8中(A)黄酮类化合物标准样品色谱图,藜麦糠黄酮化合物中槲皮素、槲皮苷、芦丁和异槲皮素4种成分得到确认。保留时间为27.908 min的色谱峰为芦丁;保留时间为29.223 min的色谱峰为异槲皮素,保留时间为34.553 min的色谱峰为槲皮苷,保留时间为41.669 min的色谱峰为槲皮素;色谱峰中芦丁、槲皮苷和异槲皮素含量接近。样品中其他保留时间的色谱峰还没有确认。黄酮样品的HPLC色谱图中色谱峰较多,其保留时间比较接近,通过洗脱条件的优化将其基本分开,其中有些组分没有完全基线分离,不排除有成分包含在已知峰中的可能。其他组分推测可能是芦丁的衍生甙类[19],单纯使用HPLC进行定性分析仍有一定的局限性,很难得知全部的黄酮化合物种类信息[20],更精确的化合物鉴定需要借助质谱、核磁共振等其他分析手段。
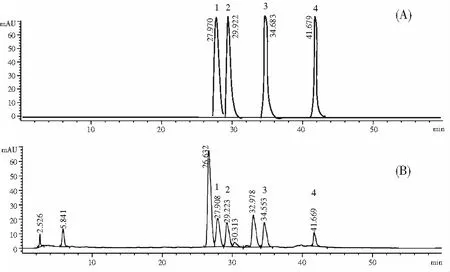
图8 黄酮类化合物标准样品(A)和纯化的藜麦糠黄酮化合物(B)的HPLC色谱图Fig.8 High performance liquid chromatograms of standard samples of flavonoids (A) and purified quinoa chaff flavonoids (B)
3 结论
在食品保鲜、抑菌、药物、化妆品领域黄酮类化合物应用广泛,为了更好地利用藜麦糠中的黄酮类化合物,本实验以藜麦糠黄酮粗提物为研究对象,通过比较 D101、HPD450、HPD750、HPD950、NKA-9、X-5、AB-8 7种大孔吸附树脂对藜麦糠黄酮的静态吸附和解吸附实验,筛选出最优树脂,结果表明,HPD950树脂的吸附和解吸性能均较好。利用HPD950大孔树脂对藜麦糠黄酮粗提液的分离纯化最佳工艺进行优化,以样液浓度、上样体积、上样液pH、乙醇浓度、解吸液体积为参考因素,确定其最佳分离纯化条件为:样液浓度0.5 mg/mL,上样体积35 mL,上样液pH 6.0,乙醇浓度75%,解吸液体积180 mL。在此条件下分离纯化后,藜麦糠中黄酮纯度由(13.0±0.30)%上升到(68.0±0.50)%,回收率为(77.4±0.27)%。对纯化后的藜麦糠黄酮类化合物进行高效液相色谱定性分析,样品中槲皮素、槲皮苷、异槲皮素、芦丁4种成分得到确认。本实验为藜麦糠天然黄酮类化合物的应用奠定了理论基础。

