ERP29通过mTOR信号通路对卵巢癌SKOV3细胞生物学行为的影响
王伟杰 刘恩令 魏靖文 李亚光 张炜悦
华北理工大学附属唐山工人医院妇产科 河北唐山 063000
ERP29(endoplasmic reticulum protein 29;内质网蛋白29)作为一种新型内质网蛋白,通过内质网应激反应、间质上皮转移等方式影响肿瘤细胞的生存、生长及转移[1],实验证明ERP29的异常表达参与胰腺癌等多种恶性肿瘤的发生发展[2],但ERP29对卵巢癌细胞生物学特性的影响鲜见报道。mTOR通路是人类恶性肿瘤中最常见的异常信号通路,通过激活蛋白质翻译及合成的关键因子影响肿瘤细胞的增殖、凋亡以及代谢,参与多种癌症的发生发展[3-4]。研究显示近60%的卵巢癌患者中mTOR信号通路被过度激活[5]。mTOR通路相关蛋白在卵巢恶性肿瘤中高表达并与化疗耐药相关[6-7], 表明mTOR通路是治疗卵巢癌的关键信号通路。本研究通过RNA干扰技术沉默EPR29基因,探讨干扰前后mTOR通路相关蛋白的表达差异,以及沉默ERP29基因对卵巢癌SKOV3细胞增殖、侵袭及凋亡的影响,探讨ERP29通过mTOR信号通路在卵巢癌发生、发展中的作用。
1 材料与方法
1.1材料 卵巢癌SKOV3细胞株购自于上海富衡生物科技有限公司,Lipfectamin2000购自Invitrogen公司,考马斯亮蓝试剂盒购于Solarbio公司,反转录试剂盒购于TAKARA公司,CCK-8试剂盒购于南京莱富赛生物科技有限公司,AnnexinV FITC/PI双染法细胞凋亡检测试剂盒购自于上海七海复泰生物科技有限公司,特异性siRNA-ERP29序列及其阴性对照序列购于上海吉玛公司,ERP29、AKT、pAKT、mTOR、pmTOR、4EBP1抗体购自于abcam公司,p4EBP1抗体购于北京博奥森生物技术有限公司,羊抗兔二抗、β-actin 抗体购于北京中杉金桥生物技术有限公司。
1.2实验方法
1.2.1siRNA-ERP29细胞转染SKOV3细胞 SKOV3细胞采用含10%胎牛血清,1%双抗(青链霉素混合液)的RMPI-1640培养液,置于37℃、5% CO2的温箱中进行培养。取生长密度大约90%SKOV3细胞,消化并计数,取6孔培养板,向每孔中加入1mL含5×105个/mL细胞悬液,实验设置3组:空白对照组、阴性对照组(NC siRNA)及实验组(siRNA-ERP29),37℃、5%CO2温箱内培养细胞生长至70%~80%融合进行转染,转染步骤按照Lipfectamin2000说明书严格操作。
1.2.2siRNA-ERP29细胞模型的构建 RT-qPCR检测各组细胞ERP29mRNA表达,空白组、对照组及实验组ERP29mRNA的相对表达量分别为1.075±0.079、1.014±0.033及0.444±0.022,实验组与空白组、对照组比较差异有统计学意义(P<0.05),提示siRNA-ERP29细胞模型构建成功。
1.2.3Western blot技术检测各组细胞AKT、pAKT、mTOR、pmTOR、4EBP1、p4EBP1蛋白表达情况 RIPA裂解液裂解各组SKOV3细胞并提取总蛋白,考马斯亮蓝法测定各细胞样本蛋白含量,根据蛋白定量结果,加入相应体积的总蛋白样品与5×SDS-PAGE上样缓冲液, 95℃变性10分钟。SDS-PAGE 进行电泳分离后,采用半干转的转膜方式转至 PVDF 膜上,室温、缓慢摇动状态下封闭1小时,加入一抗4℃孵育过夜,TBST 洗膜3次,每次 10分钟, 后加入二抗孵育1小时,PBST洗3次,每次 10分钟,曝光、洗片并用image J软件分析灰度值。
1.2.4CCK-8实验检测各组细胞增殖能力 将各组SKOV3细胞经胰蛋白酶消化后制成1~5×104个细胞/mL的细胞悬液。分别取100μL至96孔培养板,每种细胞接种3个孔作为复孔, 37℃培养过夜。分别在0、48小时后按1:10 体积比混合CCK-8和无血清必需基本培养基,在37℃、5%CO2培养箱中孵育1小时,酶标仪测定记录450nm波长吸光度(OD)值。
1.2.5划痕实验检测各组细胞侵袭能力 各组SKOV3细胞经胰蛋白酶消化后,取8×105个细胞分入35mm2培养皿中进行培养,记号笔于培养皿底部画线标记,用枪头垂直于记号笔标记划去盘中细胞,用PBS 冲洗去除划下的细胞,加入无血清培养液继续培养,在0、24小时分别拍照,记录划痕面积。
1.2.6流式细胞仪检测干扰后各组细胞凋亡情况 各组SKOV3细胞经胰蛋白酶消化,按照每孔30万的密度接种到6孔板中,每组细胞接种3个复孔,在37℃,5%CO2培养箱中培养过夜,取10万重悬的细胞,1000g离心5分钟,加入400μLAnnexin V-FITC结合液轻轻重悬细胞, 加入5μLAnnexin V-FITC,轻轻混匀,4℃避光孵育15分钟后加入10μLPI染色液,轻轻混匀,4℃避光孵育5分钟。进行流式细胞仪检测。

2 结果
2.1各组细胞AKT、pAKT、mTOR、pmTOR、4EBP1、p4EBP1蛋白表达情况 如表1、图1所示,3组SKOV3细胞AKT、pAKT、mTOR、pmTOR、4EBP1、p4EBP1蛋白表达比较,实验组 pAKT、pmTOR、p4EBP1蛋白表达较空白组及阴性对照组增加,差异有统计学意义(P<0.05),空白组及阴性对照组间差异无统计学意义(P>0.05)。而3组细胞AKT、mTOR、4EBP1蛋白的表达差异无统计学意义(P>0.05)。

表1 3组细胞AKT、pAKT、mTOR、pmTOR、4EBP1、p4EBP1蛋白相对表达比较

图1 各组细胞AKT、pAKT、mTOR、pmTOR、4EBP1、p4EBP1蛋白表达
2.2CCK-8实验检测干扰后各组细胞增殖能力 如表2所示,空白组、阴性对照组及实验组转染完成后0小时的OD值分别为(0.302±0.003)、(0.305±0.004)、(0.303±0.008),48h的OD值分别为(0.567±0.008)、(0.572±0.003)及(0.606±0.007),实验组较空白组及对照组相比增殖能力增强,差异有统计学意义(P<0.05)。

表2 3组细胞OD值
2.3划痕实验检测干扰后各组细胞侵袭能力 如图2、表3所示,空白组、阴性对照组及实验组划痕愈合率分别为(0.437±0.018)、(0.427±0.019)、(0.708±0.06),实验组较空白组及对照组相比侵袭能力增强,差异有统计学意义(P<0.05)。
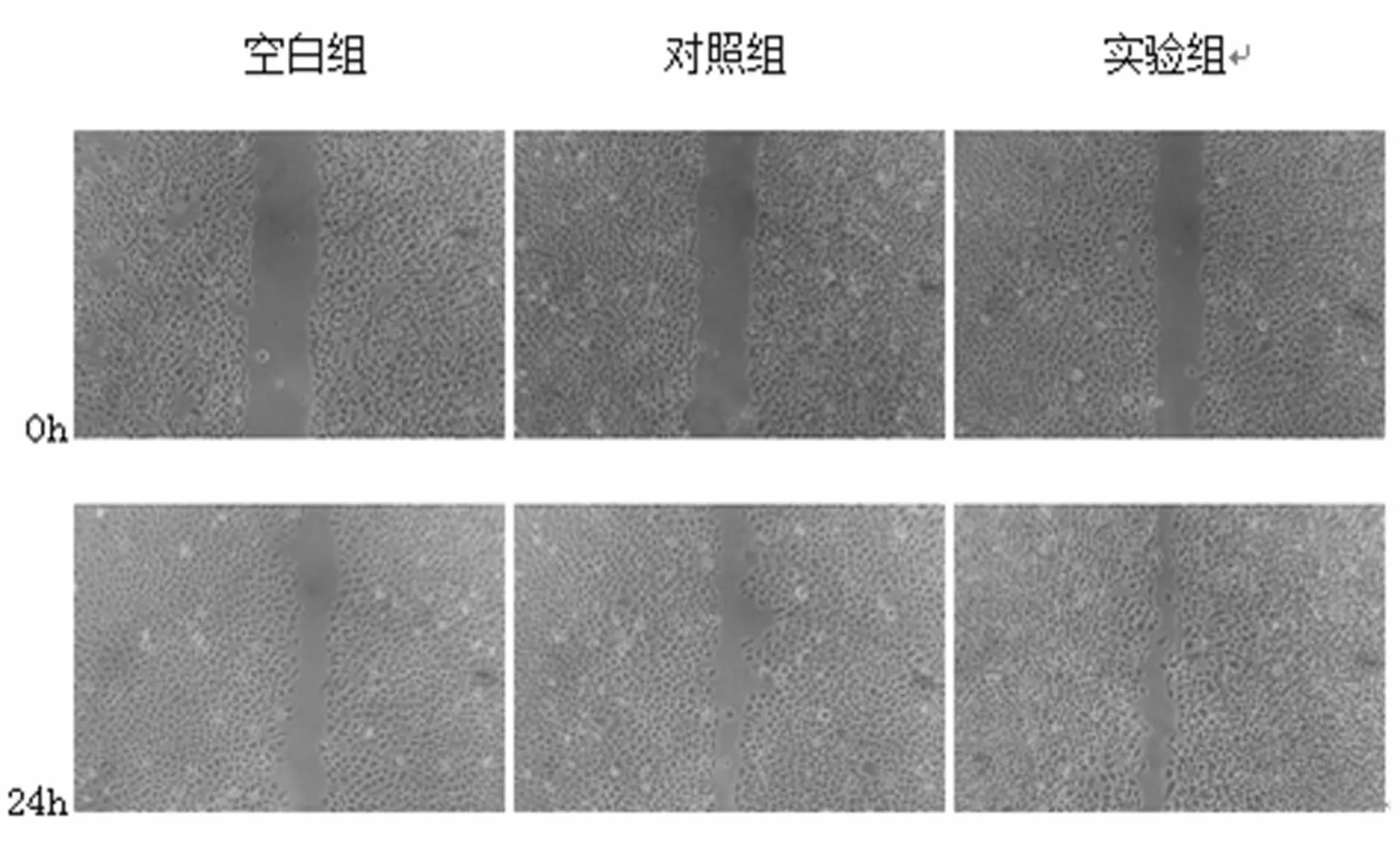
图2 划痕实验检测干扰后各组细胞侵袭能力
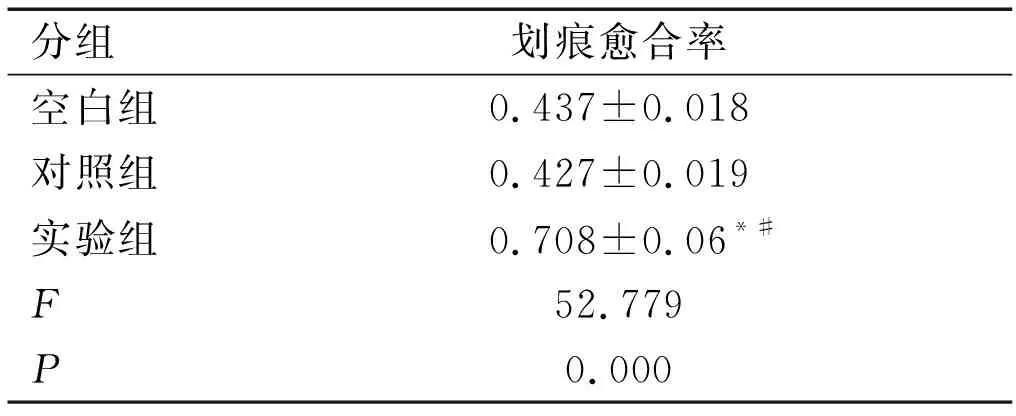
表3 3组细胞划痕愈合率
2.4流式细胞仪检测干扰后各组细胞凋亡情况 如图3、表4所示,空白组、阴性对照组及实验组早期凋亡率(%)分别为(1.83±0.305)、(1.87±0.493)、(1.20±0.100),空白组、阴性对照组及实验组晚期凋亡率(%)分别为(2.10±0.954)、(1.63±0.776)、(0.90±0.400),实验组较空白组及对照组相比凋亡率下降,但统计学无显著性差异(P>0.05)。
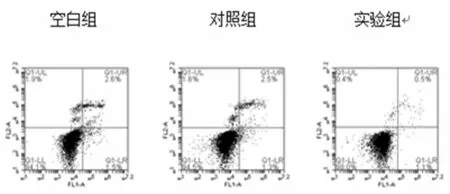
图3 干扰后各组细胞凋亡情况
表4 3组细胞早期及晚期凋亡率
3 讨论
内质网是细胞内重要的膜性系统,具有大量促进蛋白合成、分泌以及维持内质网功能稳定状态的分子伴侣蛋白,内质网稳态破坏会引起细胞DNA的损伤及氧化应激反应进而引起肿瘤的发生[8]。ERP29作为一种内质网分子伴侣蛋白由N端和C端域组成,N端结构域有助于ERP29的二聚化,C端结构域有助于底物结合和分泌[1]。大多学者认为ERP29作为抑癌基因与肿瘤的发展呈负相关[9],实验表明敲除肿瘤细胞ERP29基因可导致上皮生物标记E-钙粘蛋白显著减少、波形蛋白显著增加,表明ERP29通过参与上皮细胞-间充质转化过程影响肿瘤细胞的迁移和侵袭[10],有研究提示ERP29的表达与卵巢癌的化疗敏感性呈负相关[11]。但亦有实验表明ERP29在肺癌组织中高表达[12],表明ERP29在不同组织、不同细胞中发挥着不同作用。
mTOR通路是人类恶性肿瘤中最常见的异常信号通路,主要由磷脂酰肌醇3激酶(PI3K)、蛋白激酶B(AKT)、哺乳动物雷帕霉素靶蛋白(mTOR)等组成,其通过调节细胞的增殖、凋亡、自噬、侵袭及迁移等影响肿瘤的发生、发展[13]。PI3K被生长因子等激活后,使磷脂酰肌醇 4,5-二磷酸(PIP2) 磷酸化生成 PIP3,PIP3 与AKT和磷酸肌醇依赖性蛋白激酶(PDK1)结合,促使PDK1对AKT的活化形成pAKT,pAKT可直接磷酸化mTOR,也可以通过解除结节硬化复合物1(tsc1)对mTOR的抑制作用间接激活mTOR, 磷酸化的mTOR可进一步激活其下游因子核糖体S6激酶-1(S6K-1)和真核细胞翻译起始因子4E结合蛋白-1(4EBP-1),S6K-1结合于真核启动因子3(eIF3)并处于失活状态,4EBP-1与真核转录启动因子-4E(eIF)结合并抑制其活性,pmTOR磷酸化S6K-1及4EBP1,解除了对转录的抑制作用并促进翻译复合物的形成、增加蛋白质翻译并参与肿瘤生长、增殖及肿瘤血管的生成[14-15]。mTOR通路在卵巢癌的发生发展中起重要作用,mTOR通路相关蛋白在卵巢癌组织中高表达,并且与卵巢癌患者总生存率及无进展生存率呈负相关[16]。实验显示,mTOR通路抑制剂可显著改善晚期肿瘤患者的无进展生存时间[17],是临床治疗恶性肿瘤的关键靶点。
肿瘤组织中ERP29的表达水平与mTOR信号通路的激活因子呈负相关[9],表明ERP29作为一上游因子通过mTOR信号通路影响肿瘤进展。本研究采用RNA干扰技术沉默SKOV3卵巢癌细胞EPR29基因并检测细胞增殖、侵袭及凋亡能力的改变,Western blot技术检测各组细胞mTOR通路相关蛋白的表达情况。结果显示沉默EPR29可增强mTOR通路相关蛋白的磷酸化水平,并且沉默EPR29后卵巢癌细胞的增殖、侵袭能力增强,但对卵巢癌细胞凋亡能力无显著影响。提示ERP29可能作为一种抑癌因子在卵巢癌的发生、发展中发挥作用,其机制可能与抑制mTOR通路的激活有关。

