兰属植物EST-SSR标记开发及应用
孙叶 刘红 马辉 单东方 曹宏 包建忠 陈秀兰 赵国琦

摘要:本研究利用蘭属植物杂交种转录组测序数据开发EST-SSR标记,分析标记的多态性及兰属种质的遗传多样性,为兰属植物种质资源的创新和分类研究提供参考。结果表明,转录组测序分析获得113 780条Unigene,从中共识别到23 709个SSR位点,SSR位点出现频率为20.84%。从设计的200对引物中筛选出20对具有多态性,并且扩增条带大小与预期相符的EST-SSR标记引物,对48份兰属种质材料进行PCR扩增,平均多态位点数为3.0,共检测到81.00个等位基因,平均每对引物检测到4.05个等位基因。观测杂合度平均值为0.320 8,期望杂合度平均值为0.507 0;Shannons信息指数的变化范围为0.233 8~1.472 4,平均值为0.932 1,多态信息含量为0.110 3~0.662 2。对4个参试兰属植物种群进行遗传多样性分析,春兰和大花蕙兰的F1杂交种群与大花蕙兰种群亲缘关系较近,与春兰种群的亲缘关系较远。聚类分析结果表明,遗传相似系数为0.72时,48份种质聚成7类,春兰和大花蕙兰的F1代杂交种群大多聚入第I类,春兰种群聚入第V类,第II类、第III类、第IV类、第VII类均为大花蕙兰种群。
关键词:兰属植物;EST-SSR标记;遗传多样性;亲缘关系
中图分类号:S682文献标识码:A文章编号:1000-4440(2020)03-0681-08
Development and application of EST-SSR marker in Cymbidium
SUN Ye1,2,LIU Hong2,MA Hui2,SHAN Dong-fang2,CAO Hong2,BAO Jian-zhong2,CHEN Xiu-lan2,ZHAO Guo-qi1
(1.College of Animal Science & Technology, Yangzhou University, Yangzhou 225009, China;2.Institute of Agricultural Sciences of the Lixiahe District in Jiangsu Province, Yangzhou 225007, China)
Abstract: Expressed sequence tag-simple sequence repeat (EST-SSR) markers were developed based on transcriptome sequencing, the polymorphism of markers and the genetic diversity of Cymbidium germplasms were analyzed in order to provide reference for the innovation and classification of resources. The results showed that 113 780 unigenes were obtained from transcriptome sequencing, a total of 23 709 SSR loci were detected in the unigene with the frequency of 20.84%. In addition, 20 pairs of EST-SSR primers with polymorphism were selected from 200 primers, and the size of amplified bands was in accordance with the expectation. Moreover, 48 Cymbidium germplasms were amplified by PCR, and the average number of polymorphic loci was 3.0. A total of 81.00 alleles were observed, with an average of 4.05 alleles per locus. The mean values of observed heterozygosity and expected heterozygosity were 0.320 8 and 0.507 0, respectively. Shannon′s information index ranged from 0.233 8 to 1.472 4, and the average value was 0.932 1. The polymorphic information content(PIC) ranged from 0.110 3 to 0.662 2. The F1 population of Cymbidium georingii and Cymbidium hybridum was close to the population of C. hybridum, and far away the population of C.georingii. Cluster analysis results indicated that 48 germplasms were grouped into seven groups at the genetic similarity coefficient of 0.72, the F1 population of C.georingii and C. hybridum was grouped into class I, the population of C.georingii was grouped into class V, and class II, class III, class IV and class VII were the population of C. hybridum.
Key words:Cymbidium;expressed sequence tag-simple sequence repeat (EST-SSR) marker;genetic diversity;genetic relationship
兰属植物主要分于中国、日本、韩国、马来群岛、印度西北部、澳大利亚北部和东部等国家和地区,具有很高的观赏价值和经济开发价值。兰属约有48个原生种,中国有29个,主要分为地生类、附生类和腐生类。春兰(Cymbidium goeringii)和大花蕙兰(Cymbidium hybridum)都是兰属中重要的种,相关园艺品种十分丰富,市场化开发程度高。1989年有学者利用中国兰属植物独占春(Cymbidium eburneum)的变种象牙白作母本,碧玉兰(Cymbidium lowianum)作父本,育成了大花蕙兰的第一个品种象牙碧玉兰[1],后来又利用原产于印度、缅甸、泰国和中国西南部等国家及地区的许多大花附生原种为亲本,杂交获得了大量兰属新品种。随着产业的发展,国内兰花人工育种的重要方向之一是通过春兰与大花蕙兰的种间杂交,改善大花蕙兰品种无香味、叶型散乱并且在中国南方地区不易开花以及春兰花色单一等缺陷,选育出兼具二者优点的新种质。目前,春兰和大花蕙兰杂交育种产业在中国才刚起步,种质资源的创新利用及分子标记辅助育种具有十分重要的研究价值。
目前,兰属植物的基因组信息还比较匮乏,简单重复序列(SSR)标记的开发是丰富兰属植物遗传信息的重要手段,兰科植物的SSR标记引物在属内、种内都有很好的适应性和通用性[2-3]。早期的兰属植物研究主要通过基因组富集文库开发SSR标记引物,Xia等[4]开发了9对墨兰SSR标记引物,并证明其在兰科植物中有广泛的适应性;Moe等[5]开发了14对春兰SSR标记引物,研究了包含春兰、墨兰、大花蕙兰3个种96份种质的遗传多样性;Hyun等[6]利用SSR标记研究了朝鲜、韩国、中国和日本的春兰种群遗传多样性及亲缘关系。上述SSR标记的开发和应用促进了兰属植物分类鉴定、遗传进化等分子生物学研究。随着测序技术的发展和测序成本的下降,利用转录组测序数据开发的EST-SSR标记在作物研究上被广泛应用[7-10],兰属植物EST-SSR标记的开发利用方面也取得了一定进展。李小白等[11-12]利用建兰转录组测序数据开发了62对genic-SSR标记引物,金凤等[13]采用其中的52对genic-SSR标记引物分析了兰属植物5个种的43个品种,发现品种遗传背景与地理环境存在一定联系。Huang等[14]利用蝴蝶兰属在NCBI公开的表达序列标签(EST)数据,开发了13对EST-SSR标记引物,对6个种的103个兰属植物品种进行遗传分析,其中聚类分析结果很好地反映出参试品种种间、种内遗传背景的差异。Liu等[15]利用13对EST-SSR标记引物对129个春兰品种进行遗传分析,发现EST-SSR标记在品种分类和种质鉴定方面实用性较强,43个梅瓣品种中存在CY2-J等位基因,为春兰梅瓣品种相关功能基因的研究提供了参考。张亚楠等[16]发现,寒兰转录组测序数据开发的15对EST-SSR标记引物在15个不同地区的寒兰中表现出多态性,可用于寒兰的遗传研究。说明,EST-SSR标记在兰属植物品种分类、种质鉴定及标记的功能分析等方面有很高的应用价值和发展潜力。
春兰和大花蕙兰杂交育种周期长,优良种质的早期筛选能减少工作量,有效提高育种效率。本研究拟利用春兰和大花蕙兰杂交种黄金梅的转录组测序数据开发EST-SSR标记,以期为春兰和大花蕙兰种质资源遗传多样性和亲缘关系分析评估,杂种优势群体的划分,杂交种的真实性检测,园艺性状遗传规律分析以及杂种性状预测等研究提供参考。
1材料与方法
1.1转录组数据来源
转录组测序样本是保存于江苏里下河地区农业科学研究所兰花种质资源圃中的兰属杂交种黄金梅,黄金梅是从母本春兰大宋梅与父本大花蕙兰黄金虎杂交F1代中选出的新品系,取其花蕾期淡黄绿色花萼和始花期紫红色花萼,提取RNA后委托上海为青生物科技有限公司进行转录组测序,获得113 780条Unigene。
1.2植物材料
参试的48份种质材料(表1)取自江苏里下河地区农业科学研究所花卉课题组兰花种质资源圃,包括14份(序号1~14)春兰大宋梅与大花蕙兰黄金虎杂交F1代种群(CH)、11份(序号15~25)大花蕙兰种群(DH)、10份(序号27~36)春兰新春梅与大花蕙兰红霞杂交F1代种群(XH)、13份(序号26、序号37~48)春兰种群(CL)。
CH:春兰大宋梅与大花蕙兰黄金虎杂交F1代种群;XH:春兰新春梅与大花蕙兰红霞杂交F1代种群;DH:大花蕙兰种群;CL:春兰种群。
1.3DNA提取
选取叶长10 cm以上当年新生叶片,采用改良的十六烷基三甲基溴化铵(CTAB)法提取基因组DNA,提取液使用前加入2%的β-巯基乙醇。利用1%琼脂糖凝胶电泳和紫外分光光度计检测DNA纯度及质量浓度,稀释至25 ng/μl,-20 ℃下保存备用。
1.4EST-SSR位点筛选和引物设计
利用MISA工具對Unigene进行SSR位点搜索分析,SSR筛选标准为:单核苷酸重复次数至少为10次,二核苷酸重复次数至少为6次,三核苷酸、四核苷酸、五核苷酸、六核苷酸重复次数至少为5次。利用Primer 3.0引物设计软件为含有SSR位点的Unigene设计引物,设计原则为:引物序列长度18~24 bp,预计扩增产物大小100~600 bp,G+C含量40%~70%,退火温度55~57 ℃,上、下游引物的退火温度值相差不大于2 ℃,获得引物后比对Unigene,引物两端不允许错配。随机选取200对EST-SSR标记引物,由上海捷瑞生物工程有限公司合成。
1.5引物筛选
将编号为CH-2、CH-10、DH-8、DH-9、XH-1、XH-10、CL-3、CL-10的8份种质中提取的DNA等量混合,进行引物筛选。PCR反应体系为12.00 μl,其中25.0 ng/μl DNA 2.00 μl,10×PCR buffer 1.20 μl,25.0 mmol/L Mg2+ 1.50 μl,10 μmol/L引物Primer-F和Primer-R各1.00 μl,0.5 U/μl aq DNA聚合酶1.00 μl,2.5 mmol/L dNTPs 0.75 μl,剩余用双蒸水补足。试验所用药品、试剂均购自生工生物工程(上海)股份有限公司。PCR扩增程序为:95 ℃预变性2.0 min,35个循环(94 ℃变性30 s,51 ℃退火30 s,72 ℃延伸45 s),72 ℃延伸10 min,退火温度由EST-SSR标记引物决定。扩增产物采用8%变性聚丙烯酰胺凝胶电泳分离,120 V电压下电泳90 min,银染显色,在可见光灯箱中进行观察、拍照和读带。
1.6PCR扩增和数据分析
依据筛选出的引物,对48份材料进行PCR扩增,统计目的扩增条带,根据分子量大小依次记载,缺失数据记载为99,计算多态位点数及多态率。用POP-GENE32软件分析扩增位点和种群的等位基因数、有效等位基因数、观测杂合度、期望杂合度、Shannons信息指数、基因分化系数、基因流、Neis基因多样度、Neis遗传距离、Neis遗传一致度。利用PIC Calc 0.6软件计算各引物的多态性信息含量(PIC)。将基因型数据转为(0,1)数据模式,使用NTSYSpc 2.10软件以非加权组平均法(UPGMA)对48份种质进行聚类分析。
2结果与分析
2.1兰属杂交种黄金梅转录组中SSR位点的数量与分布
黄金梅转录组113 780条Unigene中共识别到23 709个SSR位点,分布在18 548条Unigene中,SSR的发生频率(含有SSR的Unigene数目与总Unigene数目的比值)为16.30%,SSR位点出现频率(检出的SSR数目与总Unigene数目的比值)达20.84%。包含1个以上SSR位点的Unigene有3 968条,含有复合型SSR位点的Unigene有2 310条。
转录组鉴定出6种重复类型的EST-SSR(表2),从单核苷酸到六核苷酸均存在,其中单核苷酸、双核苷酸、三核苷酸重复数量较多,分别占总SSR的59.69%、27.56%和11.79%;四核苷酸、五核苷酸、六核苷酸重复数量较少,分别占总SSR的0.71%、0.13%和0.12%,单核苷酸重复到六核苷酸重复的EST-SSR数量呈递减趋势。
2.2EST-SSR标记引物的筛选
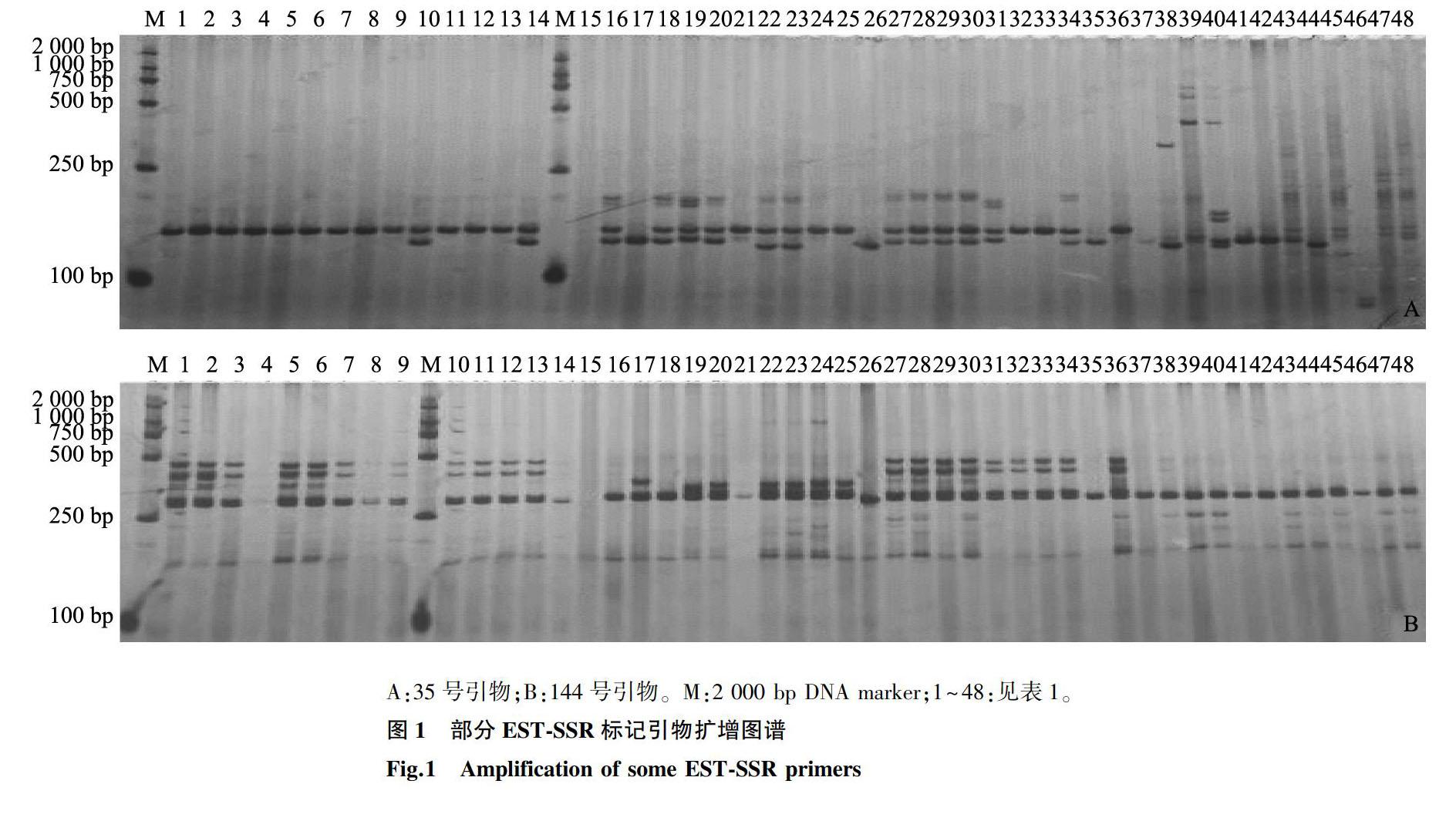
以编号为CH-2、CH-10、DH-8、DH-9、XH-1、XH-10、CL-3、CL-10 8份材料基因组DNA为模板,对随机筛选出的200对EST-SSR标记引物进行PCR扩增,扩增标记清晰度较好的引物有115对,扩增效率为57.5%。利用粗筛引物对48份兰属种质材料进行PCR扩增,其中104对引物扩增出了PCR产物,可分为3类,第一类为扩增产物与预期长度相符合的特异性标记(图1A);第二类为非特异性标记(图1B),其中某些非特异性标记能清楚地对参试种质进行划分;第三类为无多态性的特异性标记。根据扩增结果选出20对具有多态性,条带清晰,重复性较好,并且所得扩增条带大小与预期相符的引物。
2.3EST-SSR标记的多态性和遗传多样性分析
统计筛选出的20对EST-SSR标记引物在48份兰属种质中的特异性扩增条带,结果(表3)显示,扩增条带大小为149~341 bp。20对引物在48份材料中共检测到63个位点,其中多态性位点60个,位点多态率(PPL)平均值为94.58%。20对EST-SSR标记引物共检测到81.00个等位基因,平均每对引物检测到4.05个等位基因,平均有效等位基因数为2.178 9。多态性信息含量为0.110 3~0.662 2,平均值为0.453 6,其中9个位点表现为高度多态性(PIC≥0.500 0),10個位点表现为中度多态性(0.250 0 2.4不同种群遗传多样性分析 对4个参试种群进行遗传多样性指数分析,结果(表4)显示,4个种群观测杂合度平均值为0.327 3,期望杂合度平均值为0.433 7,期望杂合度均大于观测杂合度,说明各种群内均存在一定程度的近交。DH种群的等位基因数为3.35,Neis基因多样度为0.509 5,Shannons信息指数为0.913 5,期望杂合度为0.533 8,PIC为0.483 7,均高于其他3个种群,而CH种群的各项指标值均最低。表明,DH种群遗传多样性最高,而CH种群遗传多样性最低。 = CH、XH、DH、CL见表1注。 2.5种群间的Neis遗传距离和Neis遗传一致度 利用EST-SSR标记分析4个种群两两之间的Neis遗传距离(GD)和Neis遗传一致度(GI),结果(表5)表明,种群间的Neis遗传距离为0.114 9~0.301 2,Neis遗传一致度为0.739 9~0.891 5,4个种群的遗传相似度较高,遗传分化较小。CH种群与XH种群的Neis遗传距离最小,亲缘关系最近。CH种群、XH种群与CL种群的Neis遗传距离较大,亲缘关较远,CH种群、XH种群与DH种群的Neis遗传距离较小,亲缘关较近。基于Neis遗传一致度的4个种群聚类图(图2),春兰与大花蕙兰的杂交F1种群与大花蕙兰种群亲缘关系较近,与春兰种群的亲缘关系较远。 2.648份种质的聚类分析 利用NTSYSpc 2.10分析软件计算48份参试种质间的杰卡德相似系数,并制作UPGMA聚类图。图3显示,本研究开发的EST-SSR标记能区分参试的48个兰属种质,在遗传相似系数为0.72时,48个种质聚成7类,除CH-3、XH-9外,CH和XH种群的其他22份材料聚为第Ⅰ类,第Ⅱ类、第Ⅲ类、第Ⅳ类、第Ⅶ类均为大花蕙兰种群,第Ⅴ类除XH-9外均为春兰种群。 在遗传相似系数为0.78时,第Ⅰ类又分为3大亚类,一个亚类主要为CH种群,另外两个亚类为XH种群。 CH-1至DH-1见表1。 3讨论 3.1兰属植物EST-SSR标记开发 本研究中,春兰和大花蕙兰杂交种的转录组测序数据共识别出23 709个SSR位点,位点出现频率为20.84%,其中单核苷酸重复占59.69%,双核苷酸重复占27.56%,三核苷酸重复占11.79%,四核苷酸重复占0.71%,五核苷酸重复占0.13%,六核苷酸重复占0.12%,单核苷酸、双核苷酸、三核苷酸重复数量较多。李小白等[11]利用建兰铁骨素花器官测序的转录组数据,SSR位点出现频率为17.54%,各SSR类型中单核苷酸重复占比最高(55.40%),单核苷酸、双核苷酸、三核苷酸重复占比97.84%;张亚楠等[16]利用寒兰根、茎、叶、花4部分组织总RNA测序的转录组数据,共识别出9 837个SSR位点,位点出现频率为14.32%,各SSR类型中双核苷酸重复占比最高(55.22%),单核苷酸、双核苷酸、三核苷酸重复占比95.08%。 3.2EST-SSR标记多态性分析 本研究通过转录组数据设计200对EST-SSR标记引物,115对具有可扩增性,其中20对引物的扩增产物有多态性且与预期大小相符。引物扩增出非特异性标记的原因,朱根发等[17]、谢佩吾等[18]认为,一方面可能是EST序列有内含子,另一方面可能是基因组DNA含有内含子,扩增出具有内含子长度的多态片段,同时还可能与部分大花蕙兰为非整倍体或多倍体有关。筛选功能标记是EST-SSR标记引物开发的重要目的之一,有些非特异性标记引物扩增出的特征谱带能高效区分亲本群体和杂交群体,本研究开发的EST-SSR标记对杂种后代的鉴定及分子评价作用仍需进一步探索。 本研究中20对EST-SSR标记引物的PIC平均值为0.453 6。李小白等[12]利用建兰的39对多态性引物,在12个建兰品种中进行扩增验证,PIC平均值为0.348 0。Li等[19]利用开发的55对genic-SSR引物,在兰属植物9个种的63个品种中扩增的标记有多态性,PIC平均值为0.407 0。金凤等[13]利用52对genic-SSR引物分析兰属植物5个种的43个品种,PIC平均值为0.415 0。陈程[3]利用开发的4对蝴蝶兰属EST-SSR标记引物扩增64个兰属植物品种,PIC平均值为0.398 0。这些开发的兰属植物EST-SSR标记均表现为中度多态性。 3.3兰属各种群遗传多态性分析及亲缘关系分析 对4个参试种群进行遗传多样性分析,相对春兰品种,大花蕙兰品种的遗传多样性较高,这与前人研究结果[5,20-21]一致。遗传距离和遗传一致度研究結果表明,4个种群的遗传相似度较高,遗传分化较小,这可能与种群间的近交及基因传递有一定关系。CH和XH种群均为大花蕙兰和春兰的杂交后代,遗传背景较为一致,因此遗传距离最近,且遗传距离与父本大花蕙兰较近,与母本春兰较远,这与朱根发[20]和鲁迪[21]研究结果一致。 聚类分析[22-23]结果表明,遗传相似系数为0.72时,总体上春兰种群聚为一类,春兰和大花蕙兰的杂交种群聚为一类,大花蕙兰种群分别聚为几类,这与大花蕙兰遗传多样性较高的遗传背景一致。XH-9种质聚入春兰种群,该种质园艺性状是否与其母本春兰新春梅更接近,能否实现育种者选育出兰属小型色花新品种的育种目标,仍需进一步研究。本研究开发的EST-SSR标记能区分参试的48份兰属种质,聚类分析结果反映了参试种质的遗传背景,开发的EST-SSR标记引物具有实用性,可以扩大应用范围。 参考文献: [1]朱根发,王碧青, 陈明莉,等.大花蕙兰与兰属植物种间杂交研究[J].植物学通报, 2005,22(4):445-448. [2]索娜娜. 基于铁皮石斛EST-SSR标记开发的兰科植物遗传多样性分析[D].杭州:杭州师范大学,2012. [3]陈程. 蝴蝶兰属EST-SSR标记开发及其在兰属上的转移性[D].合肥:安徽农业大学,2012. [4]XIA K, YE X, ZHANG M. Isolation and characterization of nine microsatellite markers for Cymbidium sinense[J]. Hortscience, 2008, 43(6): 1925-1926. [5]MOE K T, ZHAO W, SONG H S, et al. Development of SSR markers to study diversity in the genus Cymbidium[J]. Biochemical Systematics and Ecology, 2010, 38(4): 585-594. [6]HYUN Y S, KIM J, CHUNG K W. Development of polymorphic microsatellite markers for Cymbidium goeringii (Orchidaceae)[J]. American Journal of Botany, 2012, 99(5):193-198. [7]ISABEL L P, PARK J R, LEE G S, et al. Development of EST-SSR markers and analysis of genetic relationship its resources in hexaploid oats[J]. Journal of Crop Science and Biotechnology, 2019, 22(3): 243-251. [8]韩凤,刘春雷,罗川,等. 基于EST-SSR标记的茅苍术种质资源遗传多样性分析[J].中国野生植物资源,2019, 38(4):30-34. [9]杜晓华,杨雅萍,朱小佩,等. 三色堇转录组SSR分析及分子标记开发[J].园艺学报,2019,46(4):797-806. [10]楊旭,杨志玲,谭美,等. 厚朴转录组特征分析及EST-SSR标记的开发[J].核农学报, 2019,33(7):1318-1329. [11]李小白,向林,罗洁,等.建兰转录本的微卫星序列和单核苷酸多态性信息分析[J].浙江大学学报(农业与生命科学版), 2014,40(4):463-472. [12]李小白,金凤,金亮,等.利用建兰转录数据开发genic-SSR标记[J].农业生物技术学报,2014,22(8):1046-1056. [13]金凤,李小白,金亮,等. Genic-SSR对中国兰的遗传背景分析[J].植物遗传资源学报,2016, 17(1):183-188. [14]HUANG Y, LI F, CHEN K. Analysis of diversity and relationships among Chinese orchid cultivars using EST-SSR markers[J]. Biochemical Systematics and Ecology, 2010, 38(1): 93-102. [15]LIU X, HUANG Y, LI F, et al. Genetic diversity of 129 spring orchid (Cymbidium goeringii) cultivars and its relationship to horticultural types as assessed by EST-SSR markers[J]. Scientia Horticulturae, 2014, 174: 178-184. [16]张亚楠,杨柏云,熊冬金,等.寒兰转录组SSR信息分析及其分子标记开发[J].南昌大学学报(理科版), 2017,41(3):249-254. [17]朱根发,吕复兵,王碧青,等. 大花蕙兰品种的染色体数目分析[J].园艺学报, 2006, 33(2):417-421. [18]谢佩吾,李早文,伍爱萍,等. 17个杂交兰及3个大花蕙兰品种的染色体研究[J].广东农业科学, 2015,42(8):26-28. [19]LI X, JIN F, JIN L, et al. Development of Cymbidium ensifoliumgenic-SSR markers and their utility in genetic diversity and population structure analysis in cymbidiums[J]. BMC Genetics, 2014, 15(1): 124. [20]朱根发. 墨兰和大花蕙兰遗传多样性及其杂种后代的分子评价[D].广州:华南农业大学,2006. [21]鲁迪.春剑和大花蕙兰种间杂交种子无菌萌发及杂交后代的RAPD分析[D].成都:四川农业大学,2010. [22]杨玉霞,陈雪飞,张美,等.基干主成分及聚类分析的虎杖产量与品质的综合评价[J].江苏农业科学,2018,46(2):96-99. [23]彭靖茹,李朝昌,檀业维,等. 基于SSR分子标记的广西德保县和隆林县野生古茶树聚类分析[J].南方农业学报,2019,50(1):1-7. (责任编辑:王妮)

