木贼的质量标准提升研究
赖正权 艾伟鹏 胡震 窦耀星 蔡雨峰 刘伟 吴莹 张慈婷 谢晓琳 廖慧君
中圖分类号 R282 文献标志码 A 文章编号 1001-0408(2020)09-1080-06
DOI 10.6039/j.issn.1001-0408.2020.09.11
摘 要 目的:为完善木贼药材的质量标准提供参考。方法:以来自不同产地的10批木贼药材为样品,采用薄层色谱(TLC)法对样品中的山柰酚-3-O-β-D-槐糖苷进行定性鉴别;参照2015年版《中国药典》附录的相关方法,测定样品中重金属、黄曲霉毒素、杂质、水分、总灰分、酸不溶性灰分、水溶性浸出物和醇溶性浸出物的含量;采用高效液相色谱(HPLC)法测定样品中山柰酚-3-O-β-D-槐糖苷含量,并建立木贼水溶性成分的HPLC指纹图谱。结果:TLC鉴别结果显示,在供试品色谱中,与山柰酚-3-O-β-D-槐糖苷对照品色谱相应位置上显相同颜色的荧光斑点,且空白对照无干扰。10批样品中杂质含量为0.19%~2.32%,水分含量为10.12%~11.87%,总灰分含量为6.67%~10.11%,酸不溶性灰分含量为1.34%~2.12%,水溶性浸出物含量为9.17%~13.99%,醇溶性浸出物含量为7.49%~13.68%;初步拟定杂质含量不得超过3.00%、总灰分含量不得超过10.00%、酸不溶性灰分含量不得超过2.50%、水溶性浸出物含量不得少于9.00%、醇溶性浸出物含量不得少于5.00%的标准。9批样品中检测出了砷(含量为0.064~0.225 mg/kg),6批样品中检测出了镉(含量为0.106~0.132 mg/kg),所有样品中均检测出了铅(含量为0.221~1.896 mg/kg),但所有样品中均未检测到汞和黄曲霉毒素。HPLC方法学考察结果均符合《中国药典》相关要求;10批样品中山柰酚-3-O-β-D-槐糖苷含量为627.12~5 384.53 mg/kg,10批样品的HPLC指纹图谱相似度均大于0.900。结论:本研究新建了木贼中山柰酚-3-O-β-D-槐糖苷的定性、定量分析方法;对木贼中重金属、黄曲霉毒素、杂质等项目进行了检测,并对杂质、灰分和浸出物进行了限度拟定。所建方法简便、准确、重复性好,可用于木贼的质量控制。
关键词 木贼;山柰酚-3-O-β-D-槐糖苷;薄层色谱法;高效液相色谱法;指纹图谱;质量标准
Study on Improvement of Quality Standard of Equisetum hyemale
LAI Zhengquan1,AI Weipeng1,HU Zhen2,DOU Yaoxing3,CAI Yufeng1,LIU Wei1,WU Ying1,ZHANG Citing1,XIE Xiaolin1,LIAO Huijun4(1.Dept. of Pharmacy, Shenzhen University General Hospital, Guangdong Shenzhen 518055, China;2.School of Chinese Medicine, the Chinese University of Hong Kong, Hong Kong, China;3.Mathematical Engineering Academy of Chinese Medicine, Guangzhou University of TCM, Guangzhou 510006, China;4.Dept. of Pharmacy, Union Shenzhen Hospital, Huazhong University of Science and Technology/the Sixth Affiliated Hospital of Shenzhen University, Guangdong Shenzhen 518052, China)
ABSTRACT OBJECTIVE: To provide reference for improving the quality standard of Equisetum hyemale. METHODS: Totally 10 batches of E. hyemale from different sites were collected as samples. TLC method was used to qualitatively identify kaempferol- 3-O-β-sophoroside. The contents of heavy metal, aflatoxin, impurity, moisture, total ash, acid-insoluble ash, water-soluble extract and ethanol-soluble extract were determined according to supplementary provisions of Chinese Pharmacopoeia (2015 edition). HPLC method was used to determine the content of kaempferol-3-O-β-sophoroside in sample. HPLC fingerprint of water-soluble extract from E. hyemale was also established. RESULTS: TLC identification showed that in the chromatogram of the test sample, fluorescent spots with the same color were displayed on the corresponding positions of the chromatogram of substance control of kaempferol-3-O-β-sophoroside, and without interference from blank control. Among 10 batches of samples, the contents of impurities were 0.19%-2.32%; the water contents were 10.12%-11.87%; the total ash contents were 6.67%-10.11%; the acid-insoluble ash contents were 1.34%-2.12%; the water-soluble extract contents were 9.17%-13.99%; the ethanol-soluble extract contents were 7.49%-13.68%, respectively. It is preliminarily proposed that the impurity content shall not exceed 3.00%; the total ash content shall not exceed 10.00%; the acid-insoluble ash content shall not exceed 2.50%; the water-soluble extract content shall not be less than 9.00%; the ethanol-soluble extract content shall not be less than 5.00%. Arsenic (0.064-0.225 mg/kg) was detected in 9 batches of samples; cadmium (0.106-0.132 mg/kg) was detected in 6 batches of samples; lead (0.221- 1.896 mg/kg) was detected in all samples, but no mercury or aflatoxin was detected. The results of HPLC method met the relevant requirements of Chinese Pharmacopoeia. The content of kaempferol-3-O-β-D-sophoroside in 10 batches of samples was 627.12-5 384.53 mg/kg, and the similarity of HPLC fingerprints of 10 batches of samples was more than 0.900. CONCLUSIONS: A new qualitative and quantitative analysis method for kaempferol-3-O-β-D-sophoroside was established; the heavy metals, aflatoxins, impurities and other items in E. hyemale were detected; the limits of impurity, ash and extract were determined. The established method is simple, accurate and reproducible, and can be used for quality control of E. hyemale.
KEYWORDS Equisetum hyemale; Kaempferol-3-O-β-sophoroside; TLC; HPLC; Fingerprint; Quality standard
木贼为木贼科植物木贼(Equisetum hyemale L.)的干燥地上部分,性平,味甘、苦,归肺、肝经,具有疏散风热、明目退翳的功效,用于风热目赤、迎风流泪、目生云翳等[1]。木贼含有多种活性成分,包括黄酮类、酚酸类、生物碱类、挥发油类、脂类等化合物[2-4]。黄酮类成分是木贼的主要成分,具有降血脂、降血压、保肝、抗心肌缺血和抗肿瘤等药理作用[5-8],而其中的山柰酚-3-O-β-D-槐糖苷对人肺癌细胞系A549、人乳腺癌细胞系MCF-7、人肝癌细胞系PLC以及人子宫颈癌细胞系HeLa具有显著的抗肿瘤作用[9-10],为其代表性黄酮类活性成分之一。
2015年版《中国药典》(一部)[1]以及文献报道[11-14]的有关木贼薄层鉴别和含量测定的指标成分大多为黄酮苷元成分山柰素,但山柰素主要是样品经酸水解后所得,由于影响酸水解程度的不可控因素较多(如酸浓度、水解温度、水解时间等),故可能影响检测结果的重复性和准确性;同时,山柰素也是瓦松、红花、罗布麻叶、垂盆草、金钱草等多种药材的指标成分,专属性较差。此外,木贼标准中也缺乏符合中药整体性和模糊性特点的指纹图谱研究[15-16]。为优化和提升木贼的质量标准,全面控制木贼药材质量,确保其临床用药的安全性和有效性,本研究选择具有抗肿瘤作用的山柰酚-3-O-β-D-槐糖苷为薄层鉴别和含量测定的指标成分,该指标成分属于木贼原生黄酮苷,样品不需经酸水解处理便可测定,更有利于结果的准确性和重复性。同时,鉴于木贼药材以水煎剂入药为主,且主要成分为黄酮苷水溶性成分,故本研究拟建立其水溶性成分的指纹图谱,并进一步测定该药材中重金属、黄曲霉毒素、杂质、水分、灰分以及浸出物的含量,以期为其质量控制标准的提高提供参考。
1.1 仪器
HPTLC薄层色谱系统(瑞士CAMAG公司);1100 Series型高效液相色谱系统(美国Agilent公司);SL40型台式离心机、iCAP-TQ型电感耦合等离子体质谱仪(美国Thermo Fisher Scientific 公司);CP225D型十万分子一电子分析天平、BSA124S-CW型万分之一电子分析天平(德国Sartorius公司);R210型旋转蒸发仪(瑞士Buchi公司);ED型烘箱(德国Binder公司);SB5200型超声波清洗机(美国Branson公司);PMC-130S型水浴锅(马来西亚Pensonic公司);SRJX型马弗炉(上海金沪电热仪器联营厂);硅胶GF254预制板、Milli-Q型超纯水机(美国Merck公司)。
1.2 药品与试剂
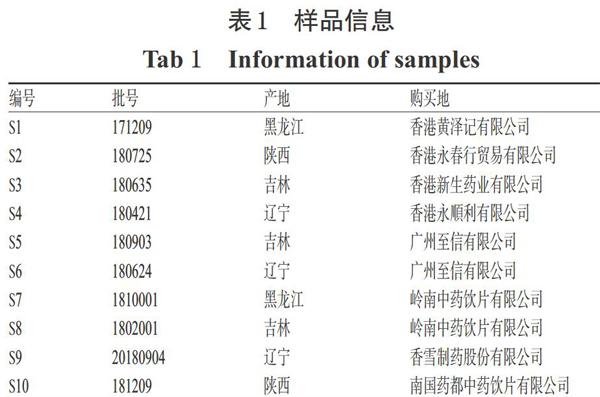
10批木贼药材分别购自中国香港和内地市场,经香港中文大学中医学院宗玉英研究员鉴定为木贼科植物木贼(E. hyemale L.)的干燥地上部分,样本保存于香港中文大学中医学院;山柰酚-3-O-β-D-槐糖苷对照品(上海交通大学,批号:20120307,纯度:≥98%);乙腈为色谱纯,其余试剂均为分析纯。样品信息详见表1。
2 方法与结果
2.1 山柰酚-3-O-β-D-槐糖苷的薄层色谱鉴别
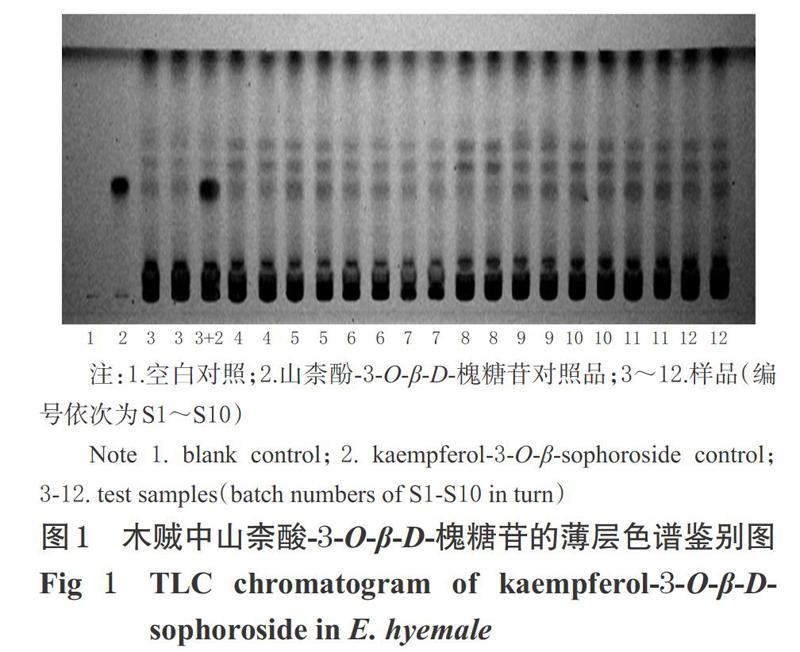
取木贼粉末1.0 g,置于50 mL離心管中,加70%乙醇20 mL,超声(功率:270 W,频率:40 kHz,下同)1 h,滤过,减压蒸干滤液,残渣加70%乙醇2 mL溶解,作为供试品溶液;另取山柰酚-3-O-β-D-槐糖苷对照品适量,加70%乙醇制成质量浓度为2 mg/mL的对照品溶液;以70%乙醇作为空白对照溶液。照2015年版《中国药典》(四部)通则0502法[17]进行试验:吸取空白对照溶液、对照品溶液、供试品溶液各1 μL,分别点于同一硅胶GF254预制板上,以供试品溶液加对照品溶液作为加样回收,以正丁醇-乙酸-水(14 ∶ 1 ∶ 0.5,V/V/V)为展开剂,上行展开,展距为4 cm。取出,晾干,置紫外光灯(波长254 nm)下检视。结果,供试品色谱中,在与对照品色谱相应位置上显相同颜色的荧光斑点,且空白对照无干扰,结果见图1。
2.2 杂质、水分、灰分和浸出物的含量测定
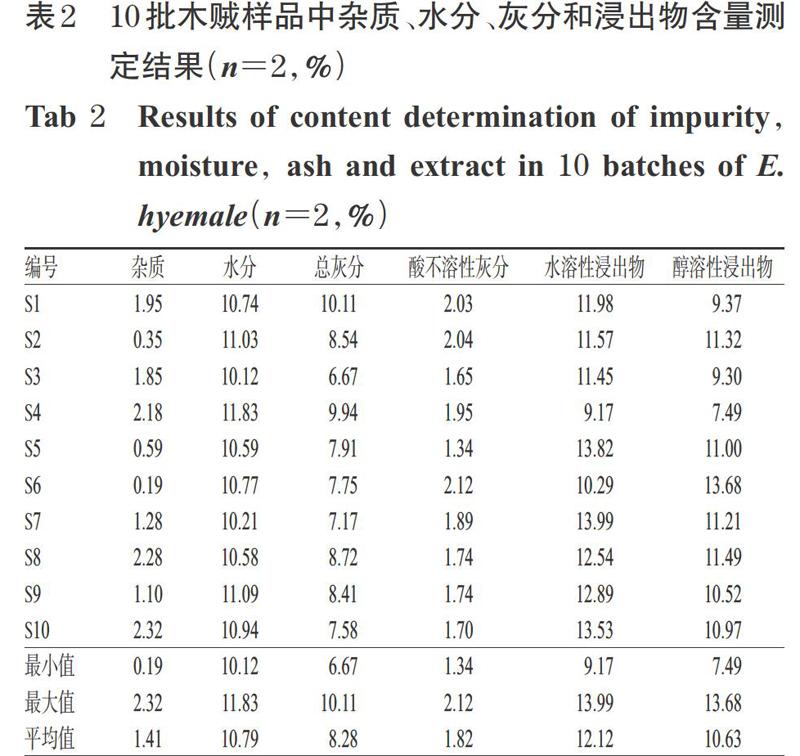
杂质、水分、总灰分、酸不溶性灰分和浸出物的测定分别参照2015年版《中国药典》(四部)通则2301杂质检查法、0832水分测定第二法、2302灰分测定法、2201浸出物测定冷浸法(分别以水和70%乙醇为溶剂)[17]进行,每批样品平行测定2次,取平均值。结果显示,各批次木贼样品中杂质、水分、总灰分、酸不溶性灰分和浸出物含量皆有差异。杂质含量为0.19%~2.32%,平均含量为1.41%;水分含量为10.12%~11.83%,平均含量为10.79%;总灰分含量为6.67%~10.11%,平均含量为8.28%;酸不溶性灰分含量为1.34%~2.12%,平均含量为1.82%;水溶性浸出物含量为9.17%~13.99%,平均含量为12.12%;醇溶性浸出物含量为7.49%~13.68%,平均含量为10.63%。其中,水分和醇溶性浸出物含量均符合2015年版《中国药典》(一部)木贼标准[1];杂质、总灰分、酸不溶性灰分和水溶性浸出物是本研究新增的测定项,采用Excel软件进行单样本t检验分析后,根据计算出的98%置信区间,最终确定木贼中杂质含量不得超过3.00%、总灰分含量不得超过10.00%、酸不溶性灰分含量不得超过2.50%、水溶性浸出物含量不得少于9.00%、醇溶性浸出物含量不得少于5.00%。10批木贼样品中杂质、水分、灰分和浸出物含量测定结果详见表2。
2.3 重金属、黄曲霉毒素的含量测定
重金属、黄曲霉毒素测定分别参照2015年版《中国药典》(四部)通则2321中电感耦合等离子质谱法和通则2351中第一法[17]进行,每批样品平行测定2次,取平均值。结果10批次木贼样品中均未检出重金属汞;砷、镉、铅虽有检出,但含量均未超出《药用植物及制剂进出口绿色行业标准》标准(砷≤2.0 mg/kg、镉≤0.3 mg/kg、汞≤0.2 mg/kg、铅≤5.0 mg/kg)[18]。同时,10批木贼样品中也均未检出黄曲霉毒素,也符合《药用植物及制剂进出口绿色行业标准》标准(黄曲霉毒素B1≤5 μg/kg)[18]。10批木贼样品中重金属、黄曲霉毒素含量测定结果见表3。
2.4 山柰酚-3-O-β-D-槐糖苷的含量测定
2.4.1 供试品溶液的制备 取木贼粉末约0.2 g,精密称定,加水10 mL,超声处理30 min,以5 000 ×g离心5 min,滤过;残渣加水10 mL,超声处理30 min,以5 000×g离心5 min,滤过;合并滤液,置于25 mL量瓶中,加水定容,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.4.2 对照溶液的制备 取山柰酚-3-O-β-D-槐糖苷对照品适量,精密称定,加乙醇溶解并制成质量浓度为200 μg/mL的山柰酚-3-O-β-D-槐糖苷对照品溶液。以甲醇为空白对照溶液。
2.4.3 色谱条件与系统适用性试验 色谱柱:Inertsil C18(250 mm×4.6 mm,5 μm);流动相:0.1%三氟乙酸(A)-乙腈(B)(V/V),线性梯度洗脱(0~40 min,10%B→30%B);检测波长:265 nm;流速:1.0 mL/min;柱温:23~25 ℃;进样量:10 μL。分别取供试品溶液、山柰酚-3-O-β-D-槐糖苷对照品溶液和空白对照溶液,按上述色谱条件进样测定,记录色谱图。结果,理论板数以山柰酚-3-O-β-D-槐糖苷计大于6 000,待测成分与相邻峰达到基线分离,分离度均大于1.5,色谱图见图2。
2.4.4 线性关系考察 精密量取“2.4.2”项下对照品溶液0.05、0.25、1、2.5、5、10 mL,分别置于不同10 mL量瓶中,用乙醇定容至刻度,摇匀,分别按“2.4.3”项下色谱条件进样测定,记录色谱图。以山柰酚-3-O-β-D-槐糖苷质量浓度(x)为横坐标、峰面积(y)为纵坐标进行线性回归,得到回归方程为y=8.556x+3.210(R2=0.999 5)。结果表明,山柰酚-3-O-β-D-槐糖苷质量浓度在1~200 μg/mL范围内线性关系良好。
2.4.5 精密度试验 取山柰酚-3-O-β-D-槐糖苷对照品溶液(20 μg/mL),按“2.4.3”项下色谱条件连续进样6次,记录峰面积。结果,山柰酚-3-O-β-D-槐糖苷峰面积的RSD为0.59%(n=6),表明仪器精密度良好。
2.4.6 稳定性试验 取木贼样品粉末(编号:S1)约0.2 g,精密称定,按“2.4.1”项下方法制备供试品溶液后,分别在室温下放置0、4、8、12、24 h时,按“2.4.3”项下色谱条件进样测定,记录峰面积。结果,山柰酚-3-O-β-D-槐糖苷峰面积的RSD为0.98%(n=5),表明样品溶液在室温下放置24 h内稳定。
2.4.7 重复性试验 取木贼样品粉末(编号:S1)6份,每份约0.2 g,精密称定,按“2.4.1”项下方法制备供试品溶液,然后按“2.4.3”项下色谱条件进样测定,记录峰面积并按回归方程计算山柰酚-3-O-β-D-槐糖苷的含量。结果,山柰酚-3-O-β-D-槐糖苷的平均含量为2 260.11 mg/kg,RSD为1.64%(n=6),表明本方法的重复性良好。
2.4.8 加样回收率试验 取已知含量的木贼样品粉末(编号:S1)6份,每份约0.1 g,精密称定,每份中精密加入与样品中含量等量的山柰酚-3-O-β-D-槐糖苷对照品,按“2.4.1”项下方法制备供试品溶液,然后按“2.4.3”项下色谱条件进样测定,记录峰面积并计算其回收率。结果,山柰酚-3-O-β-D-槐糖苷的平均回收率为104.18%,RSD为2.74%(n=6),表明方法准确度良好,详见表4。
2.4.9 样品含量测定 取不同批次的木贼样品粉末各约0.2 g,精密称定,分别按“2.4.1”项下条件制备供试品溶液,然后按“2.4.3”项下色谱方法进样测定,记录峰面积并根据回归方程计算山柰酚-3-O-β-D-槐糖苷的含量。每批样品平行测定2次,取平均值。结果,各批样品(S1~S10)中山柰酚-3-O-β-D-槐糖苷的含量分别为 2 260.32、1 965.76、677.46、1 887.83、1 729.07、5 384.53、627.12、942.75、4 773.06、2 093.17 mg/kg;最高含量 (5 384.53 mg/kg)与最低含量(657.12 mg/kg)间相差了8.19倍,可见不同批次样品中山柰酚-3-O-β-D-槐糖苷含量差异较大。
2.5 木贼水溶性成分指纹图谱的研究
2.5.1 精密度试验 取木贼样品粉末(编号:S1)约0.2 g,精密称定,按“2.4.1”项下方法制备供试品溶液,然后按“2.4.3”项下色谱条件连续进样6次,记录峰面积。以山柰酚-3-O-β-D-槐糖苷为参照峰,计算得各共有峰相对保留时间和相对峰面积的RSD均小于3%(n=6),表明方法精密度较好。
2.5.2 稳定性试验 取木贼样品粉末(编号:S1)约0.2 g,精密称定,按“2.4.1”项下方法制备供试品溶液后,于室温下放置0、4、8、12、24 h时,分别按“2.4.3”项下色谱条件进样测定,记录峰面积。以山柰酚-3-O-β-D-槐糖苷为参照峰,计算得各共有峰相对保留时间和相对峰面积的RSD均小于3%(n=5),表明样品在室温条件下放置24 h内稳定。
2.5.3 重复性试验 取木贼样品粉末(编号:S1)6份,每份约0.2 g,精密称定,按“2.4.1”项下的方法制备供试品溶液,然后按“2.4.3”项下色谱条件进样测定。以山柰酚-3-O-β-D-槐糖苷为参照峰,计算得各共有峰相对保留时间和相对峰面积的RSD均小于3%(n=6),表明方法重复性良好。
2.5.4 木贼水溶性成分指纹图谱的建立及分析 分别取10批木贼样品粉末,各约0.2 g,精密称定,分别按“2.4.1”项下方法制备供试品溶液,然后按“2.4.3”項下色谱条件进样测定,记录色谱图。将得到的色谱数据导入《中药色谱指纹图谱相似度评价系统软件》(2012A版)中,以编号为S2的样品图谱为参照指纹图谱,设置时间窗宽度为0.2 min,采用多点校正法进行色谱峰匹配,并采用中位数法生成对照指纹图谱(R)。结果,共标出4个共有峰,经与对照品图谱比对(见图1B),确认了4号峰为山柰酚-3-O-β-D-槐糖苷。以生成的对照指纹图谱为参照进行整体相似度评价,发现10批样品的相似度均大于0.900,表明其与对照指纹图谱均具有较好的一致性。但是各样品色谱峰的面积和数量有一定差异,表明来自不同产地的木贼样品存在一定的质量差异。10批木贼样品的HPLC叠加指纹图谱和对照指纹图谱见图3,相似度评价结果见表5。
3 讨论
3.1 TLC鉴别条件的选择
前期笔者分别考察了不同展开剂[乙酸乙酯-丙酮-甲酸-水(8 ∶ 1 ∶ 0.5 ∶ 0.5,V/V/V/V)、 正丁醇-乙酸-水(14 ∶ 1 ∶ 0.5,V/V/V)和乙酸乙酯-甲酸-水(8 ∶ 2 ∶ 0.2,V/V/V)]、不同观察方法(紫外光254 nm、紫外光366 nm、白光)、不同展距(4、5、6 cm)对TLC鉴别结果的影响。结果显示,以正丁醇-乙酸-水(14 ∶ 1 ∶ 0.5,V/V/V)为展开剂、展距为4 cm、在紫外光254 nm条件下观察时,主要斑点的分离度良好,且斑点清晰。2015年版《中国药典》(一部)和文献报道的木贼TLC鉴别均以山柰素为指标成分,且需加热酸水解、乙酸乙酯萃取前处理,然后以甲醇溶解制备供试品溶液,再喷以5%三氯化铝乙醇溶液进行显色[12,14]。而本研究以山柰酚-3-O-β-D-槐糖苷为指标成分对木贼进行TLC鉴别,采用的是70%乙醇超声提取、乙醇溶解制备供试品溶液、在紫外光(波长为254 nm)下检视,方法更简便,重复性更好,同时减少了强酸、喷雾接触,更益于检测员的化学防护。
3.2 浸出物含量测定条件的考察
在前期研究中,笔者考察了冷浸法和热浸法测定浸出物含量的差异,结果两种方法测得的浸出物含量差异无统计学意义(P>0.05),因此在本研究选择更为简便的冷浸法进行浸出物的含量测定。接着,笔者又进一步考察了以不同体积分数(50%、70%、95%)乙醇为溶剂时对醇溶性浸出物提取效果的影响,结果以70%乙醇作为溶剂时测得的醇溶性浸出物含量最高,因此在本研究中选择70%乙醇作为醇溶性浸出物的提取溶剂。
3.4 供试品溶液制备条件的考察
在前期研究中,笔者以待测物的相对含量为指标,分别对供试品溶液制备的不同提取方法(浸提、超声、加热回流)、不同提取时间(0.5、1、1.5 h)、不同提取次数(1、2、3次)和不同提取溶剂倍数(25、50、100)进行了考察,最终选择了50倍水超声提取2次、每次0.5 h为木贼供试品的制备方法(此条件下待测物的相对含量较高)。
3.5 HPLC色谱条件的考察
笔者前期对0.4%磷酸-乙腈和0.1%三氟乙酸-乙腈两种洗脱系统进行了比较,发现以后者为洗脱体系时所得色谱图的分离度和峰形较好,故选择其作为本研究的洗脱系统。笔者还对比了Inertsil C18(250 mm×4.6 mm,5 μm)、YMC Pack ODS(250 mm×4.6 mm,5 μm)、Agilent Zorbax SB-C18(250 mm×4.6 mm,5 μm)等3种不同色谱柱的色谱分离效果,结果发现Inertsil C18柱的柱效较好。此外,通过全波长扫描发现,265 nm为山柰酚-3-O-β-D-槐糖苷的最大吸收波长,且在该波长下所得图谱的信息丰富、分离度好,因此选择265 nm作为本研究的检测波长。
综上所述,本研究建立了以山柰酚-3-O-β-D-槐糖苷为指标成分的TLC鉴别和HPLC含量测定方法,新增了木贼水溶性成分的HPLC指纹图谱鉴别方法,同时新拟定了杂质、灰分、水溶性浸出物的检测限度。所建立的方法操作简单、准确、重复性好,可用于木贼的质量控制。但本研究尚未成功鉴定出木贼水溶性成分HPLC指纹图谱中各共有峰所代表的化学成分,在后期研究中还需结合液质联用和核磁等手段对各主要成分进行鉴定。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:63.
[ 2 ] 张承忠,赵磊,李冲,等.木贼化学成分研究[J].中草药,2002,33(11):978-979.
[ 3 ] 李淑惠,李德坤,靳丹虹,等.木贼科植物研究概况Ⅰ:化学成分研究[J].中草药,2000,31(7):12-14.
[ 4 ] 李德坤,李静.木贼挥发油成分的研究[J].中草药,2001,32(6):499-500.
[ 5 ] 董蕊,孙昌霞.木贼醇提物不同萃取部位总酚酸、黄酮含量测定及抗氧化活性研究[J].食品工业科技,2018,39(8):56-60、66.
[ 6 ] 甄艳军,侯建明.木贼对大鼠高脂血症及主动脉内膜早期粥样硬化病变的影响[J].中国老年学杂志,2004,24 (7) :643-645.
[ 7 ] 孙昌霞.木贼总黄酮的提取及对APAP致小鼠肝损伤保护作用的初步研究[D].长春:吉林农业大学,2018.
[ 8 ] 潘旭,张昌浩.木贼化学成分和药理作用研究近况[J].吉林医药学院学报,2018,39(3):216-218.
[ 9 ] 李方丽.白花蛇舌草化学成分及其体外抗肿瘤活性研究[D].济南:山东中医药大学,2016.
[10] 张春梅.木贼乙酸乙酯提取物抗肿瘤活性成分研究[D].延边:延边大学,2012.
[11] 张宪,赵惠萍,张小茜,等.木贼质量标准的研究[J].中国中医药信息杂志,2005,12(5):48-50.
[12] 郦红岩,汤小伟,周坚祥,等.HPLC法测定木贼中槲皮素和山柰素的含量[J].齐鲁药事,2012,31(7):400-401.
[13] 李军山,陈钟,张肖建,等.木贼配方颗粒质量标准研究[J].西部中医药,2017,30(3):25-27.
[14] 许鑫,苏瑞,金敏婷,等.木贼中3种成分的HPLC-DAD- MS分析[J].中国执业药师,2011,8(8):30-33.
[15] 杨捷,朱泠音,徐翠珊,等.麦枣怡神颗粒的指纹图谱研究[J].中国药房,2019,30(17):2374-2378.
[16] 張淼,陈龙,朱华,等.石仙桃药材 HPLC 指纹图谱的建立及聚类分析[J].中国药房,2019,30(13):1792-1795.
[17] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:57-58、104、202、204-206、224-225.
[18] 对外贸易经济合作部.中华人民共和国外经贸行业标准:药用植物及制剂进出口绿色行业标准[J].中药研究与信息,2001,3(8):9-10.
(收稿日期:2019-11-23 修回日期:2020-02-23)
(编辑:林 静)

