MR多参数成像定量参数值评估外周带前列腺癌侵袭性
姚 楠,龙晚生
(江门市中心医院 中山大学附属江门医院放射科,广东 江门 529030)
前列腺癌在欧美国家男性恶性肿瘤中发病率居第1位,致死率居第2位[1],在我国也已成为发病率最高的男性泌尿系统恶性肿瘤[2],其侵袭性是影响治疗与预后的决定性因素。前列腺癌病理学Gleason评分是判断其侵袭性最主要的独立预测因素[3]。2014年国际泌尿病理学会(international society of urological pathology, ISUP) 提出根据前列腺癌组织中含有Gleason分级4级的腺管成分的比例对Gleason评分为7分的前列腺癌组织进行区分。一项研究[4]追踪20 845例接受前列腺全切术的前列腺癌患者及4个多中心联合研究的16 176例经穿刺证实前列腺癌患者的无生化复发生存年限,发现生存年限与术后病理结果呈明显负相关,尤其ISUP<3级及ISUP≥3级患者术后无生化复发差距较大。因此,区分ISUP<3级和ISUP≥3级前列腺癌,对临床选择治疗方案及预后评估至关重要,且前列腺癌ISUP分级可提高细针穿刺活检病理与根治性前列腺切除术术后病理之间的一致性[5]。多参数MRI(multi-parameter MRI, mp-MRI)是目前诊断前列腺疾病的最佳影像学方法,可全面评估前列腺成分,从解剖及分子学角度评价前列腺疾病的细胞及脉管成分[6]。mp-MRI诊断前列腺癌主要依靠视觉分析法[7-9]或通过使用模型[10-12]。本研究探讨mp-MRI定量参数值对判断前列腺癌侵袭性的价值。
1 资料与方法
1.1 一般资料 2017年8月—2019年3月中山大学附属江门医院对417例初诊外周带前列腺癌患者进行mp-MR检查,最终纳入研究41例,年龄54~78岁,平均(63.3±8.2)岁,共获得69份前列腺癌病理标本。纳入标准:①临床疑诊前列腺癌,前列腺特异抗原(prostate specific antigen, PSA)>4 μg/ml,或直肠指检疑诊前列腺结节;② 检查前未经任何相关治疗;③穿刺前接受统一标准的前列腺mp-MRI;④检查后2周内接受超声引导下12针经直肠穿刺前列腺活检。排除标准:①临床、病理或影像学资料不完整,或病理与影像学难以定位病灶;②病理证实为良性病变,或病灶位于中央腺体区。本研究经院伦理委员会审查批准,患者均签署知情同意书。
1.2 仪器与方法 以Philips 3.0T Ingenia MR仪行前列腺常规MR、DWI、T2-mapping及PWI序列检查。射频发射线圈为体部线圈,接收线圈为腹部32通道相控阵线圈。扫描前嘱患者保持膀胱适当充盈,行仰卧位扫描,使定位线位于耻骨联合。PWI:先扫描5°、15°双翻转角T1-mapping,再行常规动态增强MRI(dynamic contrast enhanced MRI, DCE-MRI),于第4个时相末以高压注射器经手背静脉团注对比剂Gd-DTPA,流率为3 ml/s,剂量0.1 mmol/kg体质量,再以相同流率跟注20 ml生理盐水冲管。每个扫描周期3.4 s,共80个周期。动态增强轴位FFI-T1W序列扫描参数:TR 4.0 ms,TE 2.0 ms,翻转角8°;高b值轴位DWI(b值=0、1 500 s/mm2) TR 5 146 ms, TE 96 ms,翻转角度90°;T2-mapping扫描参数:TR 2 000 ms,TE 11、21、32、43、54、64、75、86、96 ms。
1.3 病理诊断 由泌尿外科医师标记超声引导下经直肠12针穿刺前列腺活检标本及根治性前列腺切除术术后标本并送检。对送检标本经常规取材、固定、包埋、切片后行HE染色。由2名具有高级职称的病理医师讨论后确定诊断。
1.4 图像分析 将mp-MRI图像导入Intellispace Portal后处理工作站进行处理。DCE-MRI后处理:选取人群平均动脉输入函数;采用Tofts药代动力学模型作为灌注模型,计算灌注参数值,以转移常数(transfer constant,Ktrans)描述对比剂经血浆向血管外细胞外间隙弥散的能力,单位为min-1;以洗脱系数(washout coefficient, Kep)描述对比剂经血管外细胞外间隙流向血浆的能力,单位为min-1;以EES体积分数(EES volume fraction, Ve)描述血管外细胞外间隙的比例;血管间隙体积分数(vascular space volume fraction, Vp)为微血管所占比例。根据DWI图像拟合数据生成ADC图,以多回波单指数衰减拟合测量T2值。放置ROI:将PI-RADS V2推荐的MR分区图内的外周带区域与12针穿刺活检区域进行一一对应,剔除空间定位不明确病灶;选取病灶最大层面,用轮廓ROI法进行标记,尽量避开前列腺外结构及前列腺内钙化及出血。
1.5 统计学分析 采用SPSS 22.0统计分析软件。ISUP<3级组与ISUP≥3级组间前列腺癌mp-MRI参数值以±s表示,组间比较采用t检验。运用ROC曲线评估ISUP<3级与ISUP≥3级的独立预测因子及联合指标的诊断效能。P<0.05为差异有统计学意义。
2 结果
69份前列腺癌组织中,61份经超声引导下经直肠穿刺活检获得,8份经前列腺全切术后获得,其中ISUP分级评分1级9份、2级18份、3级15份、4级17份、5级10份。见表1。
表1 组间mp-MRI参数值比较(±s)

表1 组间mp-MRI参数值比较(±s)
组别T2(ms)ADC(mm2/s)Ktrans(×10-3/min)Kep(×10-3/min)VeVpISUP<3级组(n=27)67.69±8.130.63±0.1188.55±32.54513.56±262.72232.34±193.049.69±7.19ISUP≥3级组(n=42)63.90±6.910.50±0.09110.95±32.99573.37±176.52178.02±81.649.14±5.56t值2.0705.360-2.770-1.1301.6200.360P值0.076<0.0010.0130.3600.2350.763
69份前列腺癌组织mp-MRI多参数图均表现为外周带结节或肿块,T2WI呈低信号,DWI图呈高信号,相应ADC图呈低信号;DCE显示病变早期强化,强化曲线分为2型,其中47份强化曲线为Ⅰ型(快进快退),22份为Ⅱ型(快进慢退)。见图1。
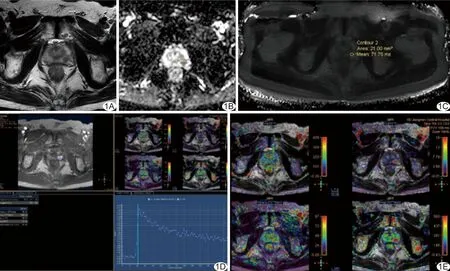
图1 患者男,65岁,左侧外周带前列腺癌,PSA=6.36 μg/ml,ISUP 4级 A.T2WI显示病灶位于左侧外周带; B.ADC图呈明显低信号; C.T2-mapping图呈明显低信号; D.DCE图显示强化曲线为Ⅰ型; E.渗透微彩图显示病灶Ktrans、Kep、Ve、Vp值均不同程度升高(图中红色代表高灌注、紫色代表低灌注)
前列腺癌ISUP<3级组ADC值明显高于ISUP≥3级组(P<0.05),Ktrans值明显低于ISUP≥3级组(P<0.05)。
联合应用定量参数ADC值和Ktrans值判断ISUP<3级和ISUP≥3级前列腺癌的敏感度和准确率较单独指标有所提高。见表2、图2。
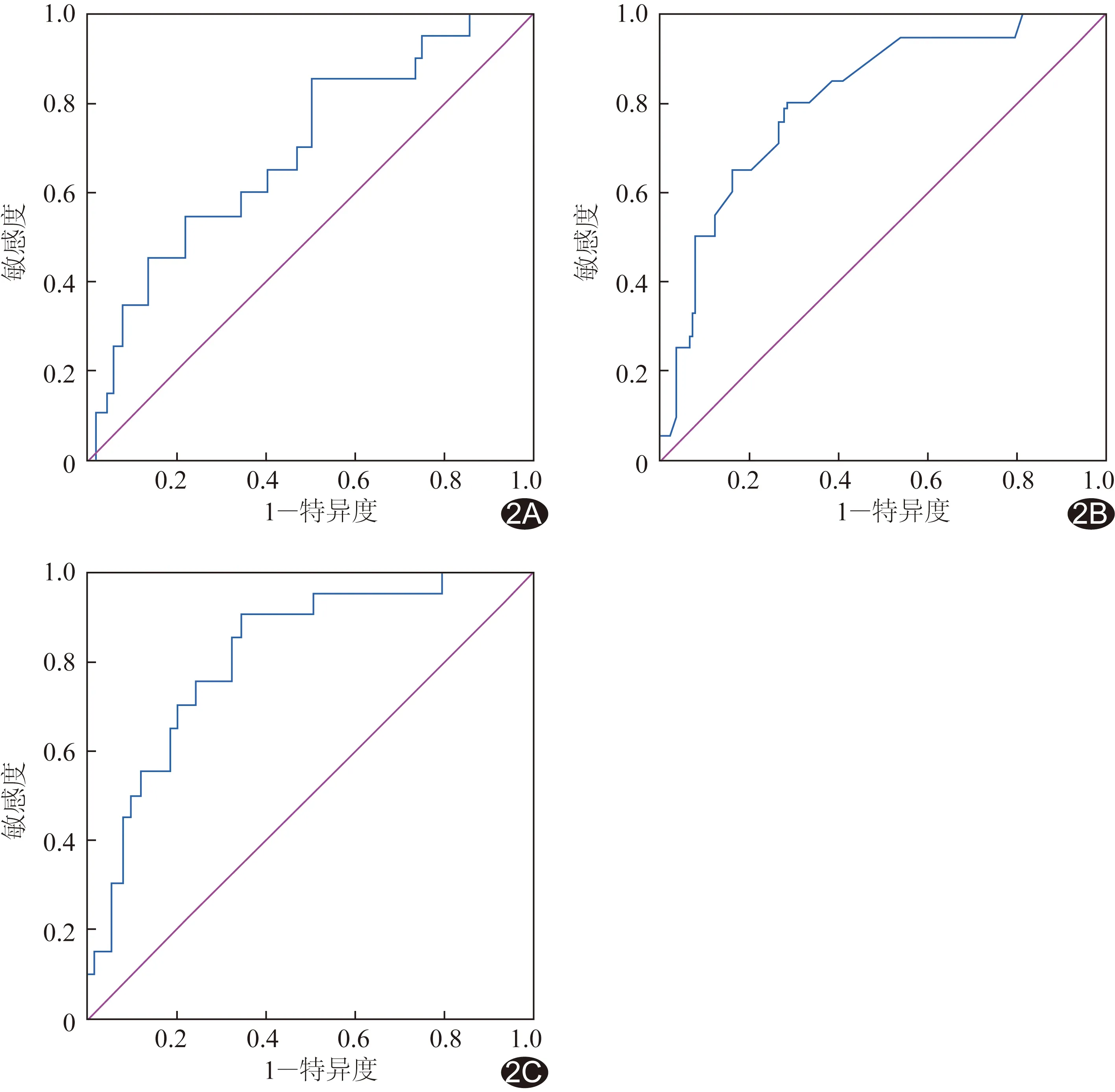
图2 Ktrans(A)、ADC(B)及其联合(C)判断ISUP<3级与ISUP≥3级外周带前列腺癌的ROC曲线

表2 运用ROC评估ADC、Ktrans及联合指标的诊断效能
3 讨论
根据美国国立综合癌症网络(national comprehensive cancer network, NCCN)临床实践指南前列腺癌篇,对初诊前列腺癌患者进行风险分层的主要依据包括前列腺癌T分期、Gleason评分/ISUP分级、PSA、前列腺特异抗原密度(prostate specific antigen density, PSAD)及穿刺阳性针数,其中Gleason评分/ISUP分级是决定治疗方法及预后的最主要的独立预测因素[13]。近年来主要尝试利用mp-MRI对前列腺癌进行影像学评估,相关研究[14-16]结果表明mp-MRI对检出临床重要型前列腺癌具有重要意义。
前列腺癌mp-MRI表现为T2WI低信号,DWI呈高信号,动态增强呈早期强化,以上为PI-RADS V2推荐的MRI诊断前列腺癌标准。在前列腺功能MR图像中,前列腺癌因弥散受限而DWI呈明显高信号,且弥散受限程度随b值增大呈明显增高趋势,PI-RADS推荐采用b>1 400 s/mm2评价前列腺弥散受限程度,目的在于减轻小b值灌注效应对前列腺DWI高信号造成的干扰[17]。ADC图能定量水分子弥散受限程度,并反映在ADC值上。本研究发现ISUP<3级与ISUP≥3级组间ADC值差异具有统计学意义,ISUP≥3级组前列腺癌ADC值更低;与之对应的病理学改变为ISUP分级较高的前列腺癌组织内部细胞组织异型性更高,低分化肿瘤细胞更多,细胞密集度更大,更缺乏正常腺管腺腔成分。VERMA等[18]发现ADC值与外周带前列腺癌Gleason评分呈负相关(r=-0.39),与移行带前列腺癌之间无明显相关。VARGAS等[19]分析51例前列腺癌,发现较低的ADC值与较高的Gleason评分显著相关(P=0.017)。
前列腺癌为富血供肿瘤。正常前列腺由膀胱下动脉供血。免疫组织化学显示前列腺癌微血管密度、血管内皮生长因子、TSP-1及p53等血管生成因子表达均明显增高[20],提示其内存在大量新生血管。本研究中DCE-MRI采用全新的Tofts药代动力学模型作为灌注模型,可计算得出组织内血流灌注及微环境改变。本研究ISUP≥3级组mp-MRI参数值中的Ktrans值明显高于ISUP<3级组。Ktrans值高表示恶性程度高的前列腺癌组织内的血流从血浆流入血管外细胞外间隙,或从血管外细胞外间隙流入血浆的速度更快,即肿瘤恶性程度越高,其内不完整新生毛细血管越多,血液在两个细胞外间隙内的交换速度越快,与SANZ-REQUENA等[21]的结果相符。
以前列腺mp-MRI定量参数ADC值和Ktrans值相结合作为联合指标,其判断前列腺癌ISUP<3级和ISUP≥3级的诊断效能较单个指标有所提高,提示mp-MRI具有较高诊断效能,而联合多参数成像仍然是提高诊断效能的有效手段。
本研究的局限性:仅获得69份前列腺癌组织,其中ISUP<3级组较少;病理结果大多来自穿刺样本,有待改进。
综上所述,mp-MRI定量参数值ADC值与Ktrans能用于鉴别ISUP<3级和ISUP≥3级前列腺癌,且二者联合诊断价值更高。

