抗性淀粉改善肠道功能及糖脂代谢的研究进展
李 颖,张 欣,杨佳杰,马向阳,侯俊财,李艾黎*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
抗性淀粉(resistant starch,RS)也称功能性膳食纤维,具有一定的潜在益生作用和多种生理功能,是一种“药食两用”的食品资源[1-2]。依据淀粉的来源和降解程度不同,RS可分成5 类:RS1、RS2、RS3、RS4、RS5[3]。越来越多的研究证明,肠道微生态平衡与宿主肠道健康密切相关,RS基于对有益菌的增殖作用受到了人们的广泛关注。RS可以通过调节肠道菌群组成及其代谢产物含量,维护肠道的正常生理功能、增强机体的抗氧化能力和减轻肠道炎症反应[4-6]。近几十年来,不仅结直肠癌等肠道疾病给临床医学带来严峻考验,II型糖尿病(type 2 diabetes mellitus,T2DM)的患病率在全球范围内也急剧上升,且已蔓延至青少年和儿童,严重威胁人类健康。除了药物治疗外,将具有低血糖指数的RS纳入日常饮食中被认为是预防和治疗T2DM的潜在替代药物。RS可以修复胰腺损伤、调控脂肪酸的摄入和氧化过程、提高肝糖原合成能力,进而改善血脂异常,稳定血糖水平,对防治心血管疾病、T2DM和脂肪肝等多种代谢疾病具有重要意义[3,7-8]。本文综述了RS调节宿主肠道健康和改善糖脂代谢紊乱方面的最新研究进展,为加深对RS的功能性认识提供参考。
1 RS对宿主肠道菌群及其代谢产物的影响
肠道内数以万亿计的微生物组成了一个复杂的肠道微生态群落。在肠道中寄居着种类繁多且数量庞大的微生物,它们参与宿主的代谢过程,影响宿主的消化、吸收以及免疫功能,在保障宿主健康和维持宿主正常生理功能等方面发挥着重要的作用[9]。肠道菌群紊乱会打破肠道与宿主之间的相对稳定状态,诱发多种疾病。研究发现,膳食是改善肠道菌群紊乱的关键因素,其中,RS的摄入能促进保护肠道屏障的双歧杆菌等有益菌增加,抑制诱导肠道内产内毒素的革兰氏阴性菌增殖,从而降低肠道通透性,减少致病机率[10-11]。此外,RS经肠道菌群作用形成的短链脂肪酸(short-chain fatty acids,SCFAs)是G蛋白偶联受体(G protein-coupled receptors,GPCRs)GPR43和GPR41的生理配体,作为不可或缺的调节因子在宿主的肝脏组织、胰腺组织、脂肪组织和肠道中都有所表达[12]。因此,RS可以通过改善肠道菌群的组成,调节宿主糖脂代谢、肠道屏障功能、免疫应答以及炎症状态等(图1)。
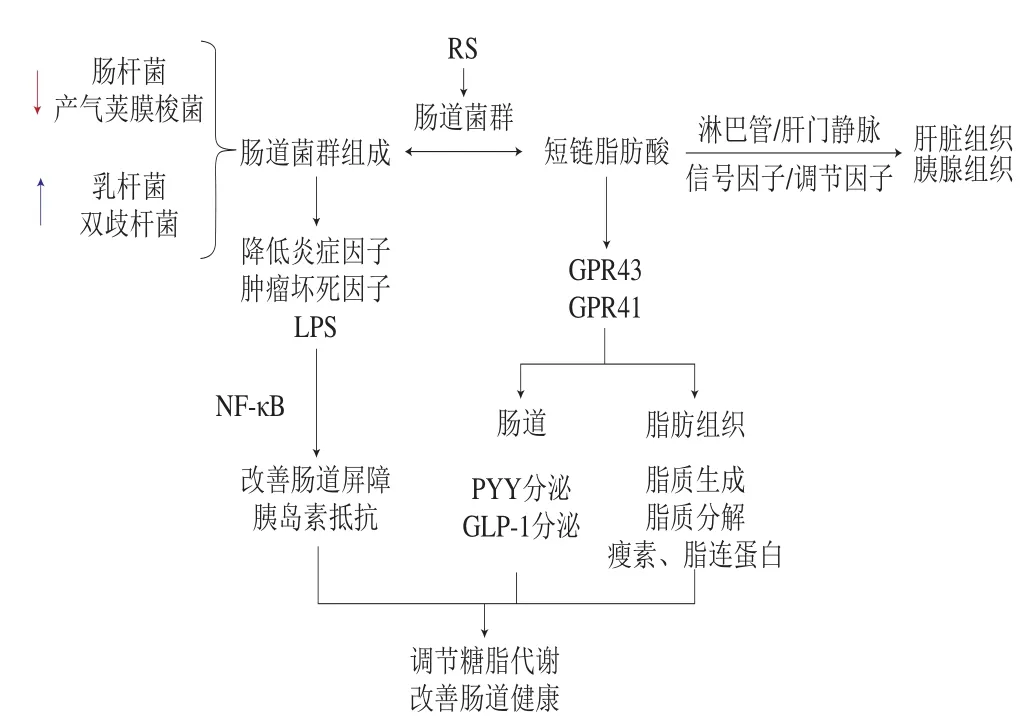
图1 RS通过肠道菌群调节宿主健康[13-15]Fig. 1 Resistant starch regulates host health through intestinal flora[13-15]
1.1 RS对肠道菌群的影响
肠道中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的数量与各种代谢综合征(肥胖、糖尿病)的发病率密切相关,部分研究结果表明,厚壁菌门与拟杆菌门的比值在肥胖人群中高于瘦弱人群[16-17]。目前,大量动物和临床实验证明RS的摄入能够改变肠道厚壁菌门与拟杆菌门的比值,进而改善糖脂代谢紊乱。Kieffer等[18]比较快速消化淀粉和直链玉米淀粉(HAMRS2)饲料对糖尿病小鼠肠道菌群的影响,结果显示,HAMRS2饲料组能显著升高拟杆菌门、放线菌门(Actinomycetes)的丰度,降低厚壁菌门、变形菌门(Proteobacteria)的丰度,并且降低厚壁菌门与拟杆菌门在小鼠体内的比值。Barczynska等[19]研究发现玉米RS能够减少肥胖儿童粪便中厚壁菌门数量,尤其是梭状芽孢杆菌(Clostridium),同时增加拟杆菌门和放线菌门的数量。
此外,RS在调节肠道菌群多样性方面也发挥重要的作用。廖振林等[20]发现香蕉RS能够调节小鼠的肠道菌群结构,促进反刍动物体内优势菌——罗斯氏菌(Roseburia)数量的明显增加,此菌在瘤胃中主要产生丁酸,具有改善黏膜修复和降低炎症反应等重要作用,并且相比于高脂饲料组,降低了肠道菌群的多样性指数。摄入莲子RS能显著降低具有致病潜力的与结直肠癌相关的紫单胞菌科(Purpuraceae);与小儿麸质性肠病相关的螺杆菌属(Helicobacter)、梭菌属(Clostridium)的数量,增加产SCFAs的菌丁酸弧菌属(Butyrivibrio)、口腔杆菌属(Stomatobaculum)的数量,并且相比于普通饲料组,降低了肠道菌群多样性[21]。与以上结论不同的是,邬应龙等[22]发现RS4型RS可以调节高脂饲料组小鼠的肠道菌群组成,同时升高菌群多样性指数。一般来说,多样性指数与肠道微生态稳定呈正相关。但优势种群如多形拟杆菌的高度适应性和高度变异性能够在肠道微生态种群多样性相对较低的情况下,维持其长期稳定性[23]。研究表明,部分杆菌、弧菌如志贺氏菌(Shigella)和霍乱弧菌(Vibrio cholerae)等菌群对酸性环境耐受性差,由于RS的摄入增加SCFAs的含量,通过降低肠道pH值,减弱或抑制这类细菌的生长和繁殖甚至死亡,因此推测pH值降低是菌群多样性降低的原因[24]。然而,RS对菌群多样性的调节作用存在争议,有待作进一步的证实。
研究表明不同食物来源的RS均能促进肠道益生菌的生长,通过调节菌群数量和分布,改善肠道菌群平衡。如玉米、荞麦、薏苡仁、香蕉中的RS均能抑制肠杆菌(Enterobacter)、肠球菌(Enterococcus)、产气荚膜梭菌(Clostridium perfringens)等有害菌的生长,其是双歧杆菌(Bifidobacterium)和乳酸杆菌(Lactobacillus)等有益菌的增殖因子,并且RS浓度越大,抑制和增殖的效果越明显。Metzler-Zebeli等[25]研究发现RS2能够增加猪结肠中乳酸杆菌和双歧杆菌的数量,同时抑制有害菌大肠杆菌(Escherichia coli)的生长,调节肠道稳态和发挥免疫调节作用。薏苡仁RS可以改善小鼠肠道菌群结构,降低肠道内还原细菌(Sulphate-reducing bacteria)、紫单胞菌科、理研菌科(Rikenellaceac)、梭菌科(Clostridiaceae)致病性或潜在致病性的菌群的数量;增加丁酸弧菌属、拟杆菌科(Bacteroideae)等有益肠道健康菌群的数量,对维持肠道健康和预防肠道疾病发生发挥重要作用[26]。
1.2 RS调节肠道代谢产物
肠道菌群严重失调(双歧杆菌数量下降,大肠杆菌、梭菌大量繁殖)时,结肠中可能产生大量的蛋白质发酵产物包括支链脂肪酸(branched chain fatty acid,BCFA)以及潜在的有毒物质,如氨、胺、亚硝基化合物、酚类和吲哚等。已有研究证明,RS可以改善腔内环境,有效抑制一些有害蛋白质降解产物的生成。He Xiangyu等[27]研究发现玉米RS可显著增加小鼠肠道内有益菌的数量,减少毒性物质如氨和硫化物的生成,从而调节肠道微生态发挥健康效应。Souza-da-Silva等[28]发现日粮中添加变性木薯淀粉可以降低小鼠体内单胺氧化酶活性和色氨酸水平,促进下丘脑5-羟色胺(5-hydroxytryptamine,5-HT)水平升高,5-HT作为胃肠道运动的重要神经递质,可以促进肠道蠕动,调节动物采食量[29]。Zhou Liping等[30]通过对猪结肠的消化液和黏膜样品进行化学和基因表达分析,发现生土豆淀粉日粮可以显著降低猪结肠中氨、酪胺、BCFA、苯酚、吲哚和粪臭素的浓度,上调黏膜黏液素基因MUC4、MUC12的表达,表明长期摄入RS饲料可以降低蛋白在体内降解产生的有害腐败物浓度,增加结肠黏液素的分泌,改善猪的肠道健康。
大量动物和人体实验研究表明:RS摄入后在结肠作为微生物底物被选择性的分解和发酵,可以产生大量以乙酸、丙酸、丁酸为主的SCFAs[31-33]。丁酸主要由丁酸弧菌属发酵,被肠上皮细胞吸收利用;乙酸、丙酸分别主要由双歧杆菌属和拟杆菌属发酵产生,通过肠道吸收进入肝静脉系统,促进肝糖异生,为肝脏代谢提供所需能量[34]。SCFAs能为机体提供能量、帮助优势菌在肠道中建立优势地位以及作为信号分子调节糖脂代谢,还能够通过降低肠道pH值,抑制腐生菌的生长繁殖和致癌物质的产生,起到调节肠道功能的作用[35]。
1.3 RS改善肠道健康
大量研究已经证实,不良的饮食习惯、不合理的膳食结构、膳食纤维摄入过少等因素是导致肠道微生态紊乱诱发结肠炎症和癌变的重要原因。然而,RS的摄入对改善肠道功能、抑制结肠癌的发病率起重要的调节作用。以下就RS通过肠道菌群对降低肠道通透性、增强肠道免疫功能和抑制结肠上皮细胞癌变方面的作用机制进行介绍。
1.3.1 RS维护肠道免疫屏障
不合理的膳食结构会导致有害菌数量增多,细胞裂解产生的LPS含量增加,肠道黏膜紧密连接蛋白(zonula occludens 1,ZO-1)的表达水平降低,导致肠道通透性增加,内毒素被大量吸收入血,通过Toll样受体4激活NF-κB,促进肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6等促炎因子的释放,降低肠道免疫力[36]。已有研究表明,长期以高脂饲料喂养的小鼠,肠道通透性增强,炎症反应加剧[37]。RS则可以通过调节肠道微生物群的平衡增强免疫功能,保护机体免受肠道炎症疾病的侵袭。
Bassaganya-Riera等[38]报道,RS3可降低患病小鼠炎症因子的表达,减轻回肠和结肠的炎症病变,其可能的机制为:基于RS对益生菌的增殖作用,抑制了CD4+T细胞干扰素-γ的产生,激活PPAPγ的表达和促进小鼠脾脏IL-10、IL-4等抗炎因子的分泌,阻遏细胞因子信号通路介导的肠道炎症反应[39-40]。Yoshida等[41]通过建立人体肠道酵解模型,发现RS不仅可以促进免疫系统发育,增强宿主免疫力的拟杆菌属的丰度,同时增加结肠中SCFAs的含量,尤其增加丁酸盐含量。丁酸盐可以通过弱化组蛋白脱乙酰基酶抑制NF-κB信号通路,减弱机体LPS应答机制、抑制IKB的磷酸化从而抑制炎症反应。
Zhou Liping等[30]研究发现土豆淀粉可以增加肠道中有益菌的数量,上调猪结肠黏液层中MUC2、MUC4、MUC12基因的表达,通过增加结肠黏液素的分泌来维护其化学屏障,其可能的机制为:益生菌(如乳酸菌)可以通过MAPK途径增加肠道上皮细胞黏蛋白的分泌,抑制肠道病原性大肠杆菌和沙门氏菌等附着,进而可对病原体的侵入起抑制作用[42]。相比于益生元和其他膳食,RS可以更大幅度地促进丁酸盐生成[43]。丁酸盐不仅能够能发挥抗炎症作用,还可以调节ZO-1的表达,其表达上调或活性增强会促进肠黏膜发挥其重要的防御屏障功能,降低了致病菌和内毒侵入肠道,在血液中大量繁殖诱发肠源性感染的风险[44]。
1.3.2 RS抑制结肠上皮细胞癌变
目前已有多项研究报道显示RS与结(直)肠癌(colorectal cancer,CRC)的发病率密切相关,随着对RS在改善肠道功能方面研究的不断深入,发现RS可通过调节肠道中微生物群组成和SCFAs浓度,在宿主肠道黏膜上皮细胞增殖、分化和凋亡等过程中起着重要的调控作用,从而对结肠疾病具有明显的预防与缓解作用[45-46]。
SCFAs可以显著抑制结直肠癌的早期标志物变性隐窝病灶(aberrant crypt foci,ACF)的发生,并且通过内质网应激介导的线粒体凋亡途径抑制肿瘤细胞中抗凋亡蛋白(B-cell lymphoma-2,Bcl-2)的表达,同时对促凋亡蛋白Bax的表达起到上调作用[47]。Le-Leu等[48]通过在小鼠饲料中添加高直链玉米淀粉(RS2),发现小鼠粪便中SCFAs和丁酸盐水平与结肠隐窝远端急性凋亡应答呈正相关。并且RS与乳酸双歧杆菌等益生菌的共生作用可以显著升高结肠癌患者对DNA损伤的凋亡应答。Purwani等[49]以人结肠癌细胞HCT-116为模型,研究由丁酸梭菌发酵西米淀粉(RS3)所得产物的上清培养液对癌细胞增殖和凋亡的影响。发现RS3培养液中丁酸盐含量升高,抑制癌细胞增殖,上调Bax/Bcl-2比值至3.5 倍以上,增加受损细胞凋亡进而避免受损细胞发生癌变,在癌症发病的早期具有抑制作用。CRC的侵袭和转移是临床医学上的主要问题,因此还需要深入研究RS对C-Myc、Ras等癌变基因的影响和作用机制,并且加大对样本量的分析,为CRC早期癌前病变的诊断和治疗提供科学依据。
RS也能通过降低丙二醛浓度,增强谷胱甘肽(glutathione,GSH)浓度、超氧化物歧化酶(superoxide dismutase,SOD)活力和相关氧化酶的活力等对癌变起到一定的预防作用。Prado-Silva等[50]发现RS2可降低二甲基肼诱导的大鼠结肠癌细胞ACF的数目,增加GSH浓度和SOD活力,提高机体抗氧化能力和抑制氧化应激水平,对降低结肠癌的发病率其重要作用。此外,动物实验结果表明,饮食中蛋白质摄入量的增加会加重结肠DNA损伤,使结肠黏膜屏障变薄,RS可以通过减轻食用高蛋白饮食引起的结肠DNA损伤,抑制和延缓肠道肿瘤的发生[27]。Le-Leu等[48]发现RS可以增加饲喂聚丙烯小鼠肠道中包括丁酸盐在内的SCFAs浓度,降低潜在毒性蛋白发酵产物的含量,具有预防肠道肿瘤的发生和改善摄入难消化蛋白对肿瘤增强作用的双重效果。
2 RS改善机体糖脂代谢紊乱
2.1 RS对餐后血糖、胰岛素水平的影响
超重和肥胖已成为一种全球性的“流行病”,随着胰岛素抵抗相关疾病的增加,患T2DM和心血管疾病的风险逐渐加剧。第一阶段胰岛素分泌的缺失被认为是T2DM病发的主要原因[51-52]。因此,恢复和改善第一阶段胰岛素分泌是治疗T2DM的一个重要手段。稳态模型(homeostasis model assessment,HOMA)(HOMA-%B、HOMA-%S、HOMA-IR)是在临床医学上衡量胰岛β细胞功能、胰岛素敏感性与抵抗水平的有效指标。胰岛素分泌能力与体内血糖水平具有直接关系(图2)。
图2 血糖调节示意图[53-54]Fig. 2 Schematic diagram of blood glucose regulation[53-54]
RS作为一种新的膳食成分,可以减缓啮齿动物和人类的消化速度,升高糖尿病患者的HOMA-%S,对空腹血糖、空腹胰岛素、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、HOMA-%B、HOMA-IR均具有降低作用[55-56]。本课题组的前期研究也表明RS样品中的RS含量与血糖指数呈负相关[57]。Wang Yong等[58]对428 名体质量指数大于25 的受试者的病例研究进行了荟萃分析,证实了在饮食中摄入RS可以明显改善超重或肥胖人群的空腹血糖、空腹胰岛素、胰岛素抵抗和敏感性,对糖尿病的护理和预防具有临床意义。
Peterson等[59]发现RS可以降低前期糖尿病患者HbA1c、HOMA-IR指标水平,但对降低空腹血糖水平,改善糖代谢没有显著影响。其结果的多样性可能是由于受试者的饮食组成、RS的剂量和类型、患者的性别和病理状态等方面存在差异。因此,有必要针对肥胖和糖尿病患者进行精心设计的长期研究。RS发挥调解作用的相关机制可能是增加SCFA,尤其是丙酸盐和醋酸盐含量,提高胰岛素敏感性;促进具有胰岛增敏作用的来源于脂肪细胞的脂联素分泌;通过改变肠道微生物群,提升机体抗氧化能力和减轻肠道炎症反应,降低胰岛素抵抗。Harazaki等[60]实验证明RS2能降低脂肪组织中CD11c被称为补体受体4的表达,CD11c作为菌脂多糖受体,诱导巨噬细胞渗入脂肪组织,促进致炎因子IL-1β、IL-6、TNF-α的释放,导致机体发生胰岛素抵抗从而影响餐后血糖水平和胰岛素分泌[61]。
2.2 RS对肝脏脂质代谢相关指标的影响
RS不仅能够改善糖代谢,还可以在一定程度上改善肥胖者体内脂质构成,降低总胆固醇(total cholesterol,TC)、甘油三酯(total glyceride,TG)、低密度脂蛋白(low density lipoprotein cholesterol,LDL-C)的含量,达到降血脂和减少肝脏炎症风险的重要作用[62-64]。Lee等[12]通过用改性甘薯淀粉干预肥胖小鼠10 周后,血清中TG、TC、LDL-C含量降低,修复小鼠肝脏损伤。Meenu等[2]在小鼠实验中也研究发现,RS可以通过静脉运输增加胆汁酸的体外排出量,降低血清和肝脏中的胆固醇水平;促进发酵产物丙酸酯的生成,抑制肝脏中胆固醇的合成,对改善脂代谢紊乱发挥重要作用。然而与动物实验不同,RS对血脂的改善作用在临床医学上还存在争议。Johnston等[65]研究发现,RS对糖尿病患者体内脂肪含量没有显著影响,并不能改善肝脏代谢相关指标。这种差异可能是由动物与人体的胃肠道菌群组成、受RS的敏感性程度及其实验操作方法不同产生。
RS经肠道菌群作用形成的SCFAs可以介导GLP-1和PYY等胃肠肽类激素,GLP-1和PYY可以减慢胃排空,提升饱腹感,从而减少食物摄入量来避免食源性肥胖。Zhou等[66]发现饲喂RS的小鼠血清中GLP-1和PYY水平均升高,并且显著降低小鼠体脂积累,表明RS对防治机体肥胖起重要作用。此外,SCFA与FFAR2结合后,刺激肝脏和脂肪组织中的腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的活性,进而激活下游关键转录因子过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPAR)α等的表达,改善脂质代谢紊乱。虽然RS对降低血脂和改善脂肪堆积的机制已被许多实验所证实,但仍存在相当大的模糊性,还需加大对糖脂代谢相关参数和潜在机制的研究,为深入评估临床疗效提供参考。
3 RS对机体糖脂代谢的分子机制研究
RS及其功能因子对改善机体糖脂代谢紊乱的研究已成为目前国际代谢性疾病研究领域的重点方向,其中RS对葡萄糖和脂质代谢过程中肝脏和胰腺组织的酶活性及其基因表达的调节作用尤其引人关注(图3)。Wang Qi等[67]通过对胰腺组织的数字基因表达谱技术和基因本体分析,发现莲子RS可引起T2DM小鼠511 个基因的表达存在差异,其中有277 个基因上调,234 个基因下调。Shang Wenting等[68]对大鼠分别灌喂新鲜菜籽油和添加RS的煎炸油,通过肝脏转录组学分析,发现RS可引起384 个基因的表达存在差异,表明在含氧化油饮食中添加RS可作为在分子水平上调节脂类物质合成的有效途径;PI3K-蛋白激酶B(protein kinase B,Akt)信号通路、胰岛素信号通路、FoxO信号通路、胰腺分泌通路、MAPK信号通路是参与RS调节糖脂代谢的主要通路。本文将阐述RS与宿主糖脂代谢互作的分子机制,从而为精准膳食干预、糖尿病等代谢疾病的诊断和治疗提供参考。
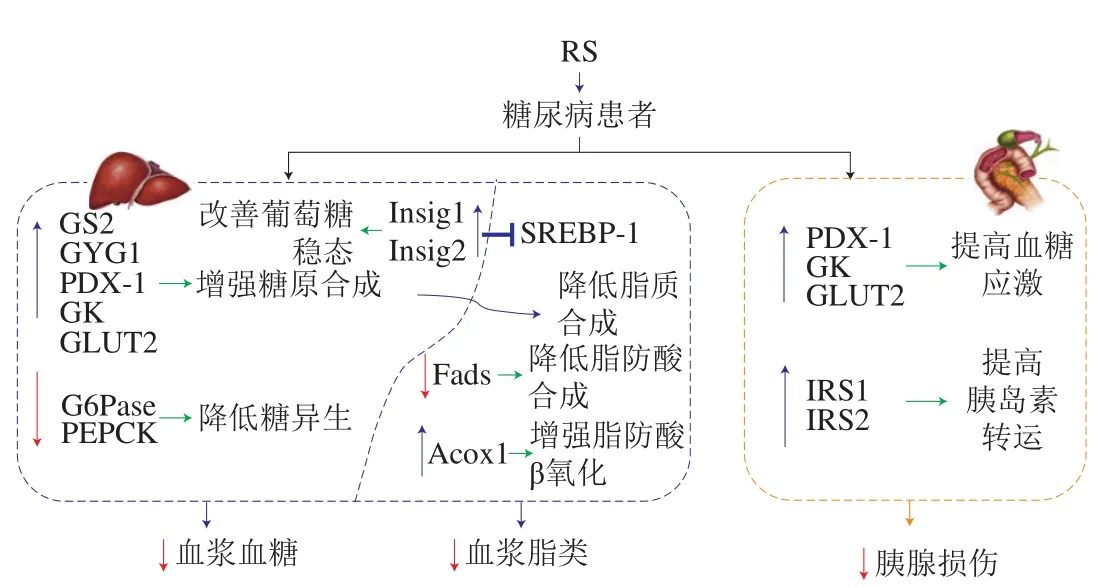
图3 RS对机体糖脂代谢的分子调控机制[2]Fig. 3 Molecular regulation mechanism of resistant starch on glucose and lipid metabolism[2]
3.1 RS对糖代谢的分子机制研究
3.1.1 磷脂酰肌醇-3激酶/蛋白激酶B信号途径
PI3K-Akt信号途径是胰岛素信号转导的主要途径,通过调节其下游FoxO、GSK-3等底物受体,调节糖异生和糖原合成相关酶的表达来降低葡萄糖含量,增强骨骼肌组织和脂肪组织对葡萄糖的摄取,维持体内葡萄糖稳态,并且避免过剩的葡萄糖转变为脂质沉积[69]。IRS1、IRS2是胰岛素信号转导通路中尤为重要的两个胰岛素受体底物,在肝脏中大量表达。研究发现:与对照组相比,敲除肝脏中的IRS1和IRS2基因组的小鼠,显著增加患高血糖、高胰岛素血症、高血脂和胰岛素抵抗的患病机率[70]。Wang Qi等[67]通过对大鼠肝脏的基因表达组学和代谢组学分析发现,莲子RS可显著上调由高脂饲料和链脲佐菌素诱导的T2DM大鼠胰腺组织中IRS1/2的表达水平,表明RS可调节胰岛素水平和治疗胰腺损伤,进而恢复血糖平衡。
叉头状转录因子(forkhead box transcription factor-1,FoxO1)是胰岛素PI3K/Akt信号通路的下游关键信号分子。在禁食条件下,通过Akt磷酸化抑制糖异生相关基因的表达,如PEPCK和G6Pase,在肝脏胰岛素抵抗中发挥重要的调节作用[71]。胰岛素与肝脏糖异生作用密切相关,当体内胰岛素水平低时,FoxO1处于激活状态,糖脂代谢基因表达异常,从而加重机体糖脂代谢紊乱。Sato等[72]研究证明,敲除小鼠体内FoxO1基因可避免因饮食诱导引起的胰岛素抵抗现象和抑制糖尿病相关症状。高直链玉米淀粉可显著下调糖尿病大鼠肝脏中PEPCK和G6Pase 的表达,从而维持糖尿病大鼠葡萄糖稳态,改善糖代谢紊乱[66]。
3.1.2 胰腺十二指肠同源异型盒因子-1
PDX-1是胰腺β细胞胰岛素基因的转录调控因子,GLUT2和GK的表达,对促进胰岛素分泌和维持葡萄糖水平稳定发挥重要作用[73]。Hashemi等[74]研究发现,RS2可以提高胰岛素抵抗大鼠的葡萄糖耐受性,部分激活GK和GLUT2在细胞膜上的表达,促进肝脏葡萄糖流入,增加肝糖原浓度。GK作为糖原合成中的第一限速酶,促进糖酵解,提高肝脏对葡萄糖摄取,增加肝糖原浓度;GLUT2是肝细胞和胰岛β细胞中最主要的葡萄糖转运体,主要负责上皮细胞膜侧的葡萄糖转运[75],GLUT2表达异常会降低胰岛β细胞对葡萄糖的敏感性,并降低肝脏对葡萄糖的摄取,引起肝脏胰岛素抵抗[76]。Sun Hui等[77]通过对糖尿病大鼠饲喂RS2型RS28d,结果发现RS28d显著增加PDX-1、GK和GLUT2的表达水平,下调PEPCK和G6Pase的表达,表明高RS日粮能通过抑制肝脏糖异生和促进糖原合成,维持体内血糖稳态。此外,RS的摄入会导致下丘脑食欲调节中心的神经元活动发生变化,使小鼠出现饱腹感,减少食物的摄入量,从而降低肥胖和相关疾病的发生率[78]。
由此可见,RS通过PI3K/Akt信号途径调节IRS1、IRS2、FoxO1等关键受体和信号分子及其下游重要的糖代谢(摄取、合成、异生、转运)相关酶的基因表达,调控糖尿病动物体内血糖应激和胰岛素转运,降低血糖水平和改善胰岛素分泌,有效地缓解糖代谢紊乱(图4)。
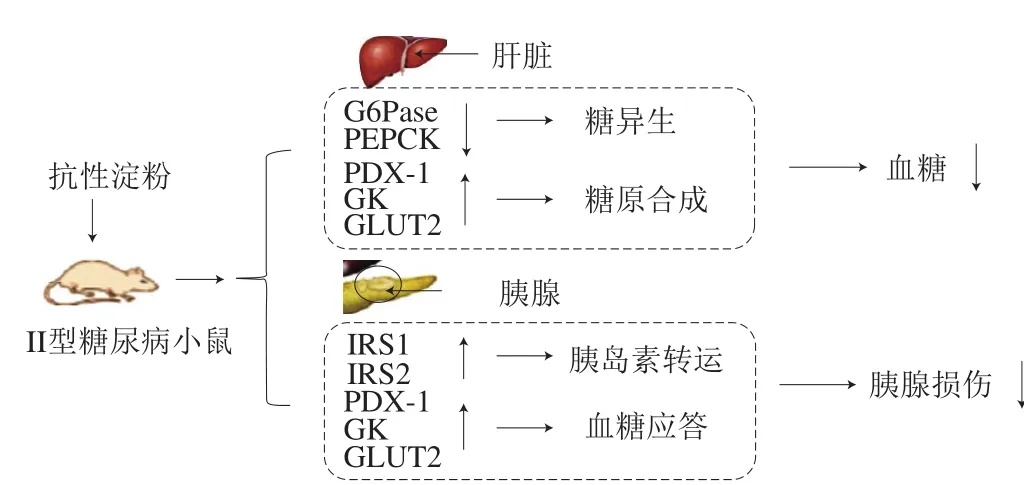
图4 RS对动物糖代谢的分子调控机制[77]Fig. 4 Molecular regulation mechanism of resistant starch on glucose metabolism in animals[77]
3.2 RS对脂代谢的分子机制研究
3.2.1 固醇调节元件结合蛋白信号转导途径
SREBPs是一种反式作用因子,有3 种亚型:SREBP1-a、SREBP1-c和SREBP-2,能够调节脂肪酸和胆固醇合成[79]。目前,研究最多的亚型是SREBP1-c,占动物体内SREBP-1的90%,是合成脂肪相关基因转录的决定因子[80]。SREBP-1对脂肪酸的调控主要是通过脂肪酸合成酶(fatty acid synthetase,FAS)、硬脂酰辅酶A去饱和酶(acyl coA desaturase 1,SCD1)和乙酰辅酶A羧化酶(acetyl coenzyme A carboxylase,ACC)等的表达,对脂肪在机体内的合成、沉积,脂质代谢发挥有效的调控作用。此外,SREBP-2调控胆固醇合成限速酶、3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutarylcoenzyme A reductase,HMG-CoAR)的表达,维持胆固醇稳态[81]。Zhou Zhongkai等[82]研究发现,高RS日粮能通过促进Insig1和Insig2的表达,抑制肝脏中SREBP-1c的表达水平,改善血脂异常和脂质沉积,表明胰岛素参与脂肪合成。罗凯云[83]报道,在肥胖小鼠高脂饲料中添加RS,可激活AMPK信号通路,下调肝脏中SREBP-1c、FAS、ACC表达水平,证实了RS的抗肥胖作用。Choi等[84]用糙米干预高脂仓鼠8 周,可以显著下调仓鼠肝脏中FAS、HMG-CoAR、SREBP-1的表达,由此表明高RS能够有效降低血脂,预防脂肪肝的形成。
3.2.2 过氧化物酶体增殖物激活受体信号转导途径
PPARs是脂肪细胞基因表达和胰岛素细胞间信号转导的主要调控因子,PPARα是调节线粒体内和过氧化物酶体内的脂肪酸氧化的主要亚型[85]。PPARα通过调节肉碱棕榈基转移酶-1(carnitine palmitoyltransferase-1,CPT-1)和ACOX的表达参与脂肪酸β氧化,降低人类和啮齿动物血清中TG浓度[84]。此外,PPARα能促进在胆固醇转化成胆汁酸途径中起重要作用的限速酶,胆固醇7α羟化酶(cholesterol 7α hydroxylase,CYP7A1)的表达,加速肝脏中胆固醇的分解代谢,增加粪便中胆固醇的排泄[86]。Si Xu等[87]对RS改善小鼠脂质代谢紊乱的分子机制发现,RS可诱导禁食诱导脂肪因子和AMPK表达,促进PPARs表达,从而加速脂肪酸β氧化,参与脂质调节。Matsumoto等[88]通过对肝脏的基因表达组学和代谢组学分析,发现糙米(RS2)可以激活AMPK信号通路,增加T2DM小鼠CYP7A1、PPARα的表达水平,有效降低血清中TG和胆固醇浓度。
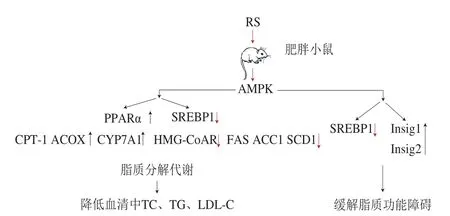
图5 RS对动物脂质代谢的分子调控机制[68]Fig. 5 Molecular regulation mechanism of resistant starch on lipid metabolism in animals[68]

表1 RS通过调节糖脂质代谢的表达对宿主健康的影响Table 1 Resistant starch affects host health by regulating the expression of glycolipid metabolites
如图5所示,RS通过Insulin、AMPK信号通路调节PPARα和SREBPs等关键信号转导途径及其下游脂质代谢相关酶的基因表达,抑制肥胖小鼠肝脏脂肪酸及胆固醇合成、增加粪便中胆汁酸的排量等,降低血脂含量和脂质沉积。目前,利用表达谱基因芯片技术,对各种组织和细胞中的基因表达进行定量分析,已成为探索某种疾病分子机制的重要思路。RS可以调节糖脂代谢途径中肝脏和胰腺组织相关基因的表达,有效预防和治疗糖尿病、高血脂等相关代谢疾病(表1)。
4 结 语
综上所述,RS作为低热量、高纤维含量的功能性食品成分,对保障机体健康有着重要的影响。RS与肠道菌群的组成有着紧密的联系,基于益生菌和SCFAs对增强肠道屏障功能、调节细胞免疫,进而缓解和改善某些结肠炎等疾病症状的大量研究,使得探索RS提高宿主肠道健康成为可能。同时,随着RS对机体糖脂代谢研究的不断深入,发现RS可以通过调节糖原合成、减少糖异生、调控脂质合成和分解代谢等途径降低血糖和血脂,从而缓解糖脂代谢紊乱。目前,已知结肠发酵、SCFAs的产生和某些基因表达水平的调控被认为是RS发挥生理作用的有效方式,但RS对参与宿主代谢以及相互作用的机制尚未明确,还需要更多深入的研究。在不久的将来,RS将在益生菌培养、功能食品开发、代谢性疾病防治等方面产生积极的推动作用。

