乳铁蛋白对三唑酮诱导骨髓间充质干细胞损伤的修复作用
谢银丹,赵添玉,许 岩,任皓威,安晶晶,刘 宁*
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150000)
三唑酮是一种广谱抗真菌农药,化学名称为1-(4-氯苯氧基)-3,3-二甲基-1-(1H-1,2,4-三唑-l-基)-α-丁酮,它被广泛应用于多种作物的病害防治[1-3]。但是该农药可能在农作物[4]、土壤[5]和水体[6]中残留,给生物安全与人类健康带来负面的影响[7]。三唑酮可以通过职业性接触、日常接触和食物经呼吸系统、皮肤和消化道到达人体内。研究发现,三唑酮具有神经毒性[8]、胚胎发育毒性[9]和内分泌毒性[10],并具有致癌和致畸[11-12]作用。Al-Sarar等[13]用中国仓鼠卵巢细胞系体外实验证明三唑酮的细胞毒性具有时间依赖性;刘少颖[14]所做急性毒性实验结果显示,三唑酮对斑马鱼胚胎的半致死浓度为12.2 μg/mL,表明三唑酮对斑马鱼胚胎具低毒性。孙瑞娟等[15]进行的人肝细胞实验结果表明,当三唑酮质量浓度高于20.998 μg/mL时会显著抑制细胞的增殖,随着质量浓度的增大毒性逐渐增大。目前有关三唑酮的研究大多着重于水生生物,对哺乳动物的研究较少,三唑酮对SD大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)影响的研究鲜见报道。BMSCs作为成骨细胞和脂肪细胞共同的前体细胞,对于维系二者之间的均衡起着至关重要的作用,在维持正常的骨代谢均衡方面也具有十分重要的意义。乳铁蛋白(lactoferrin,Lf)是一种由上皮细胞分泌产生分子质量约为80 kDa的铁结合糖蛋白,普遍存在于哺乳动物的乳汁中,其理化性质独特,具有抑菌、抗病毒、抗氧化、免疫调节、调节铁离子的吸收等诸多生物学功能。已有研究证明乳铁蛋白具有促进成骨细胞增殖的作用[16-19],本课题组前期的研究发现Lf及其消化产物都能促进BMSCs向成骨分化[20]。BMSCs是骨重建中新骨形成的主要来源[21],在三唑酮作用下,BMSCs发生损伤,Lf修复损伤后的BMSCs活性及增殖能力成为关注的热点之一。
本实验利用三唑酮作用于骨髓间充质干细胞建立BMSCs损伤模型,研究Lf对三唑酮损伤BMSCs 的修复作用,以期为今后三唑酮残留对BMSCs定向分化的影响研究提供量化参考,也为Lf的深度开发和调控个体生长发育提供新的理论参考。
1 材料与方法
1.1 动物、材料与试剂
骨髓间充质干细胞(提取自2 周龄雄性SD大鼠)北京维通利华实验动物技术有限公司。
三唑酮 中国农业科学院农产品加工所;乳铁蛋白新西兰Westland Milk Products公司;DMEM-H培养基、胎牛血清、磷酸盐缓冲液(phosphate buffered saline,PBS) 美国Gibco公司;CCK-8细胞增殖-毒性检测试剂盒 北京兰杰柯科技有限公司;大鼠碱性磷酸酶(alkaline phosphatase,ALP)酶联免疫吸附测定试剂盒、大鼠骨钙素(osteocalcin,OCN)酶联免疫吸附测定试剂盒 上海江莱生物科技有限公司;茜素红染液、油红O染液 广州赛业生物科技有限公司;总RNA提取试剂盒 北京天根生化科技有限公司;反转录试剂盒、反转录实时荧光定量聚合酶链式反应(reverse transcription quantitative real-time polymerase chain reaction,RT-qPCR)试剂盒 北京宝日医生物技术有限公司;其余试剂均为分析纯。
1.2 仪器与设备
HF-90 CO2细胞培养箱 美国力康公司;HVD-1320超净工作台 北京东联哈尔仪器制造有限公司;JEM-1200EX电子显微镜 日本日立公司;Sorvall Legeng Micro 17R高速冷冻离心机 美国Thermo Scientific公司;Model 680酶标仪 美国Bio-Rad公司;Step One PlusTM荧光定量PCR仪 美国Life Technologies公司;DK-98-1型电热恒温水浴锅 天津泰斯特仪器有限公司。
1.3 方法
1.3.1 细胞培养
SD大鼠骨髓间充质干细胞的提取培养参考宫宇等[22]的细胞培养方法。
1.3.2 BMSCs损伤模型的建立
取对数生长期的BMSCs悬液接种于96 孔培养板中,每孔100 µL,细胞接种密度为6×103个/孔,贴壁培养24 h。弃培养液,每孔加入100 µL含有三唑酮的完全培养液,三唑酮的质量浓度分别为0.01、0.1、1、5、10、20 µg/mL,培养时间分别为1、3、5、7 d。设调零组(完全培养液)、对照组(BMSCs+完全培养液)、实验组(BMSCs+含三唑酮的完全培养液)。弃去培养液,每孔加入含10% CCK-8的培养液100 µL,培养箱中孵育1 h,用酶标仪在450 nm波长处测定其OD值,细胞的增殖活性以细胞存活率表示,按下式计算。

1.3.3 Lf对BMSCs增殖的影响
采用CCK-8法测定细胞存活率[23-24]。取对数生长期的BMSCs悬液接种于96 孔培养板中,每孔100 µL,BMSCs贴壁生长24 h后,加入100 μL含有Lf的完全培养液,Lf的质量浓度分别为10、20、50、100、150、200 μg/mL,培养时间为1、3、5、7 d。设调零组(完全培养液)、对照组(BMSCs+完全培养液)、实验组(BMSCs+含Lf的完全培养液)。弃去培养液,每孔加入含10% CCK-8的培养液100 µL,培养箱中孵育1 h,用酶标仪在450 nm波长处测定其OD值,按1.3.2节公式计算细胞存活率。
1.3.4 Lf对损伤BMSCs存活率的影响
取对数生长期的BMSCs悬液接种于96 孔培养板中,每孔100 µL,BMSCs贴壁生长24 h后,加入100 μL含有20 μg/mL三唑酮的完全培养液,损伤培养3 d。弃去培养液,加入100 μL含有100 μg/mL Lf的完全培养液,作用时间分别为3、5、7 d。实验设置调零组(完全培养液)、空白对照组(BMSCs+完全培养液)、三唑酮损伤组(BMSCs+20 μg/mL三唑酮)、Lf修复组(BMSCs+20 μg/mL三唑酮+100 μg/mL Lf)。弃去培养液,每孔加入含10% CCK-8的培养液100 µL,培养箱中孵育1 h,用酶标仪在450 nm波长处测定其OD值,按1.3.2节公式计算细胞存活率。
1.3.5 损伤BMSCs成骨分化过程中ALP质量浓度的检测
取对数生长期的P3代融合度为80%的BMSCs接种于6 孔板中,每孔2 mL细胞悬液,细胞接种密度为4×104个/mL,放置于5% CO2、37 ℃培养箱内培养。细胞融合度达到90%以上时,加入2 mL含药成骨诱导培养液继续培养,每3 d换一次含药诱导液。实验设置空白对照组、三唑酮组(20 μg/mL三唑酮)、Lf组(100 μg/mL Lf)、Lf修复组(20 μg/mL三唑酮+100 μg/mL Lf)。成骨诱导分化时间共21 d,第7、14、21天检测ALP质量浓度。按照大鼠ALP测定试剂盒说明书步骤进行ALP质量浓度的测定。
1.3.6 损伤BMSCs成骨分化过程中OCN质量浓度的检测
实验方法同1.3.5节,按照大鼠过程中骨钙素测定试剂盒说明书步骤进行OCN质量浓度的测定。
1.3.7 成骨分化矿化结节染色及观察
取对数生长期的P3代融合度为80%的BMSCs接种于6 孔板中,每孔2 mL细胞悬液,细胞接种密度为4×104个/mL,放置于5% CO2、37 ℃培养箱内培养。细胞长满后,加入2 mL含药成骨诱导培养液继续培养,每3 d换一次含药诱导液。实验设置空白对照组、三唑酮组(20 μg/mL三唑酮)、Lf组(100 μg/mL Lf)、Lf修复组(20 μg/mL三唑酮+100 μg/mL Lf)。成骨诱导分化时间共21 d,诱导分化结束后用茜素红进行染色,显微镜下观察。
1.3.8 成脂分化油红O染色及观察
取对数生长期的P3代融合度为80%的BMSCs接种于6 孔板中,每孔2 mL细胞悬液,细胞接种密度为4×104个/mL,置于5% CO2、37 ℃培养箱内培养。细胞融合度达到90%以上时,加入2 mL含药成脂诱导培养基A液培养3 d,吸去6 孔板中的A液,加入2 mL含药成脂诱导培养基B液,24 h后,吸去B液,换回A液进行诱导,A液和B液交替作用4 次后,用B液维持培养5 d,B液维持培养期间,每隔2 d换一次新鲜B液。实验设置空白对照组、三唑酮组(20 μg/mL三唑酮)、Lf组(100 μg/mL Lf)、Lf修复组(20 μg/mL三唑酮+100 μg/mL Lf)。成脂诱导分化时间共21 d,诱导分化结束后用油红O进行染色,显微镜下观察。
1.3.9 RT-qPCR分析成骨、成脂基因表达变化
取对数生长期的P3代融合度为80%的BMSCs接种于6 孔板中,每孔2 mL细胞悬液,细胞接种密度为4×104个/mL,放置于5% CO2、37 ℃培养箱内培养。实验设置空白对照组、三唑酮组(20 μg/mL三唑酮)、Lf组(100 μg/mL Lf)、Lf修复组(20 μg/mL三唑酮+100 μg/mL Lf)。细胞融合度达到90%以上时进行诱导分化。
成骨分化诱导:BMSCs培养于6 孔板中,完全培养基调整细胞融合度达到90%以上,加入2 mL含药成骨诱导培养液继续培养,每3 d换一次含药诱导液。
成脂分化诱导:BMSCs培养于6 孔板中,完全培养基调整细胞融合度达到90%以上,加入2 mL含药成脂诱导培养基A液培养3 d,吸走6 孔板中的A液,加入2 mL含药成脂诱导培养基B液,24 h后,吸走B液,换回A液进行诱导,A液和B液交替作用4 次后,用B液维持5 d,B液维持培养期间,每隔2 d换一次新鲜B液。
收集细胞至无RNA酶的离心管中,按照RNAprep Pure培养细胞/细菌总RNA提取试剂盒说明书的方法去除基因组DNA,提取总RNA,然后按照反转录试剂盒说明书的方法合成cDNA,最后进行RT-qPCR,反应条件:预变性95 ℃、30 s;变性95 ℃、5 s,延伸60 ℃、30 s,40 个循环;熔解曲线条件(95 ℃、15 s;60 ℃、60 s;95 ℃、15 s)。成骨分化及成脂分化基因引物序列分别见表1、2。

表1 RT-qPCR成骨分化方向基因引物Table 1 Primer sequences for osteogeneic differentiation genes used in RT-qPCR
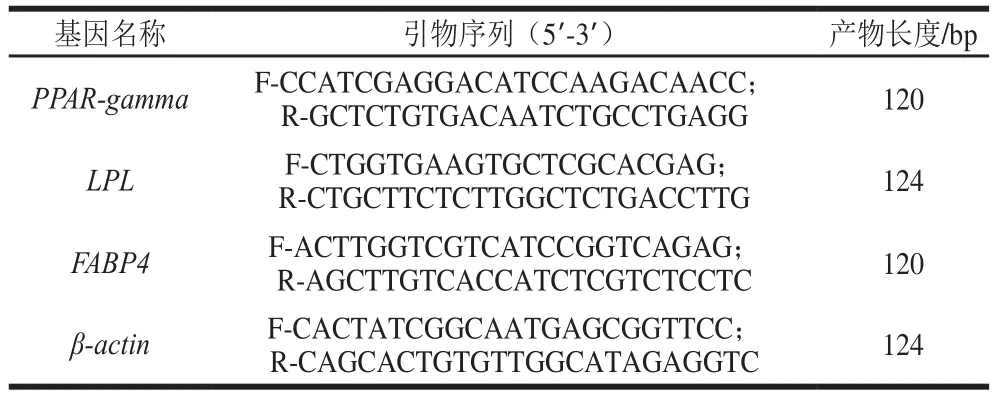
表2 RT-qPCR成脂分化方向基因引物Table 2 Primer sequences for adipogenic differentiation primers used in RT-qPCR
1.4 数据统计与分析
所有实验均重复3 次,结果以平均值±标准差表示。采用Excel 2007和Origin 85软件作图。采用SPSS 22软件对数据进行统计分析,以单因素方差分析和Duncan’s法比较数据间差异的显著性,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 三唑酮对BMSCs存活率的影响
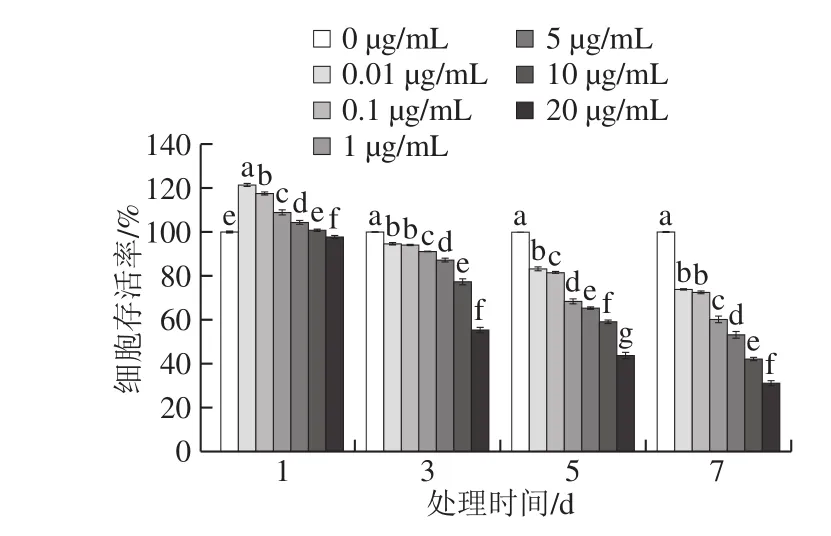
图1 三唑酮对BMSCs存活率的影响Fig. 1 Effect of triadimefon on the survival rate of BMSCs
由图1可知,与对照组(0 µg/mL)比较,采用不同质量浓度(0.01、0.1、1、5、10、20 µg/mL)的三唑酮处理1 d时,20 µg/mL三唑酮能对BMSCs造成损伤,其余较低质量浓度三唑酮会不同程度促进BMSCs增殖;当处理时间延长至3、5、7 d时,不同质量浓度的三唑酮均能对BMSCs造成显著损伤,且三唑酮对BMSCs的损伤作用在所选范围内呈现质量浓度-效应关系和时间-效应关系。根据三唑酮造成的细胞存活率的半数致死量,以及考虑到损伤时间的长短,本研究选取20 µg/mL的三唑酮处理3 d作为构建BMSCs损伤模型的条件,此条件下的细胞存活率为55.41%。
2.2 Lf对BMSCs增殖的影响
由图2可知,与对照组(0 µg/mL)比较,采用不同质量浓度的Lf处理BMSCs 1、3、5、7 d,均能不同程度地提高BMSCs的存活率。随着作用时间的延长,Lf对BMSCs的增殖作用显著增加,5 d时作用效果最明显;这说明Lf在10~200 µg/mL范围内对BMSCs无毒性作用且能促进其增殖,其中100 µg/mL的Lf作用最显著。
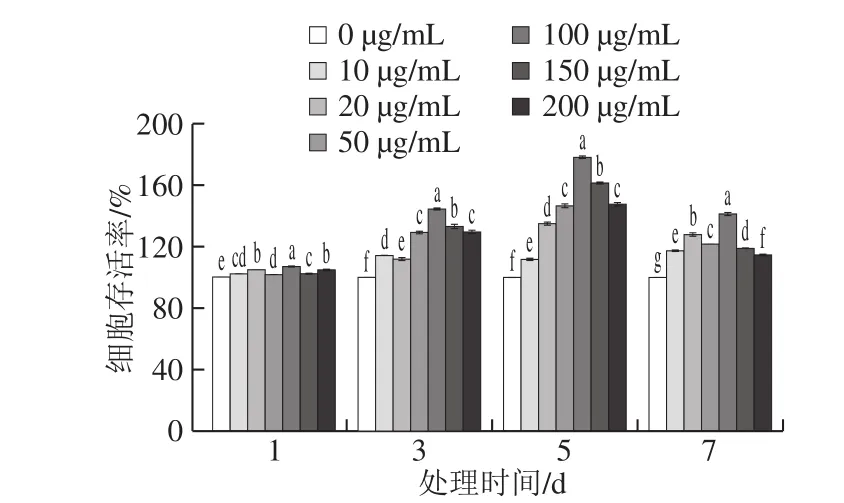
图2 Lf对BMSCs存活率的影响Fig. 2 Effect of Lf on the survival rate of BMSCs
2.3 Lf对损伤BMSCs存活率的影响
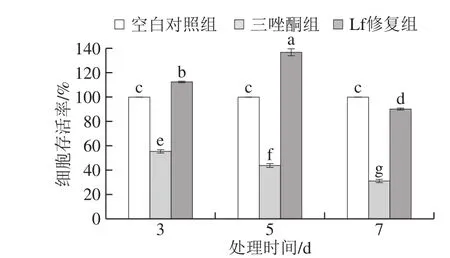
图3 Lf对三唑酮损伤BMSCs增殖的影响Fig. 3 Effect of Lf on the proliferation of BMSCs treated with triadimefon
由图3可知,与空白对照组比较,三唑酮损伤处理不同时间后,BMSCs存活率均显著下降(P<0.05);对损伤模型加入Lf处理不同时间,结果显示均能显著提高BMSCs存活率(P<0.05)。
2.4 Lf对损伤BMSCs成骨分化过程中分泌ALP的影响
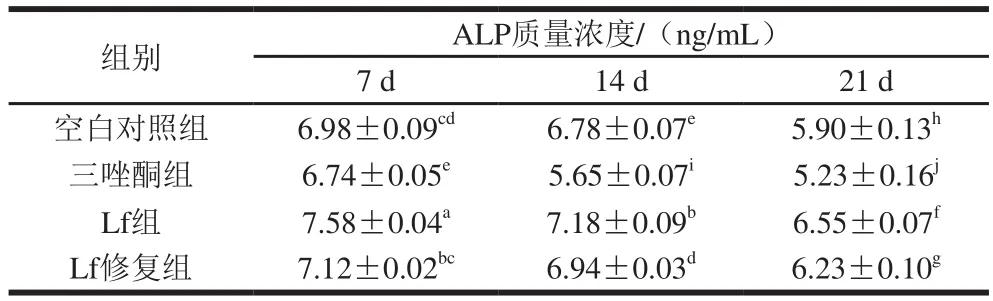
表3 成骨诱导不同时间ALP质量浓度的比较Table 3 ALP activity at different times of osteogenic induction
ALP作为骨形成和骨转换的一个关键标志性酶,1923年被首次发现,作为BMSCs成骨分化初期的标志性酶,ALP在BMSCs增殖末期时质量浓度开始增加,在矿化期前期阶段质量浓度达到最高,ALP质量浓度在一定程度上显示出细胞的成骨分化能力[25]。由表3可知,与空白对照组相比,三唑酮组诱导处理后,ALP质量浓度显著降低(P<0.05);Lf组和Lf修复组的ALP质量浓度显著增加(P<0.05)。由此可知,Lf可有效修复三唑酮对细胞成骨分化造成的损伤。
2.5 Lf对损伤BMSCs成骨分化过程中分泌OCN的影响
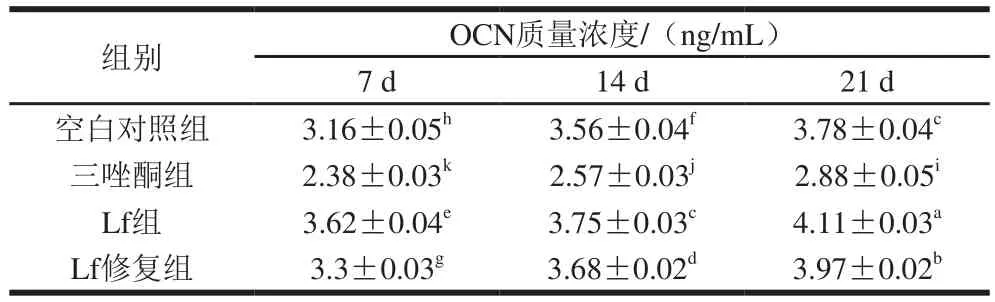
表4 成骨诱导不同时间OCN质量浓度的比较Table 4 OCN contents at different times of osteogenic induction
OCN是成骨分化特异性表达的胞外基质蛋白,可以结合钙、磷离子形成矿化基质,作为分化末期特异性标志物,能调控骨矿物沉积以及转移、促进成骨分化成熟[26]。因OCN仅在成骨细胞内表达,故可以作为特异性指标来评价BMSCs的成骨分化能力。由表4可知,与空白对照组相比,三唑酮组诱导处理后,OCN质量浓度显著降低(P<0.05);Lf组和Lf修复组的OCN质量浓度显著增加(P<0.05)。由此可知,三唑酮会对细胞向成骨分化造成一定损伤,而Lf可有效修复这种损伤。
2.6 Lf对损伤BMSCs成骨诱导21 d后矿化结节形成的影响
矿化结节的形成是体外诱导BMSCs成骨分化能力最直接的表现,是BMSCs定向成骨分化的最后阶段。BMSCs在成骨诱导分化后细胞外基质具有大量的钙沉积,是分化为骨的标志,茜素红可以和矿化结节中的钙结合形成红色的复合物。
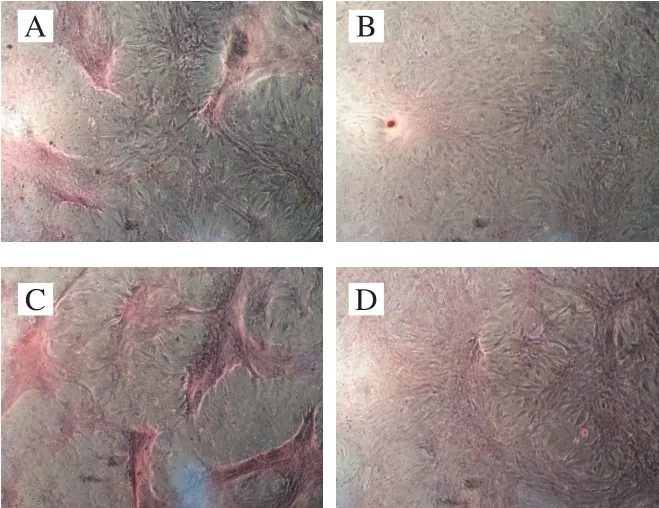
图4 成骨诱导21 d后茜素红染色结果(×100)Fig. 4 Alizarin red staining results after 21 days of osteogenic induction (× 100)
由图4可以看出,与空白对照组相比,三唑酮组细胞形状仍为长梭形,极少有矿化结节形成,说明三唑酮对BMSCs向成骨分化造成了损伤;Lf组形成的矿化结节最多,说明Lf对BMSCs向成骨方向进行分化具有促进作用;Lf修复组和三唑酮组相比矿化结节数量更多,成骨分化较为明显,说明Lf可修复三唑酮对BMSCs向成骨分化造成的损伤。
2.7 Lf对损伤BMSCs成脂诱导21 d后脂滴形成的影响
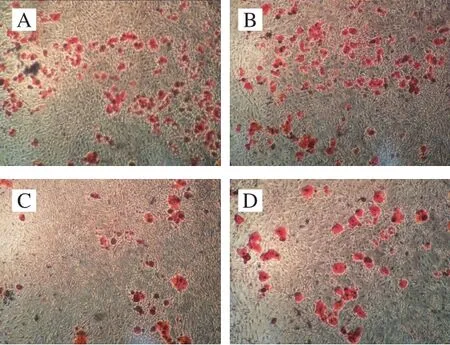
图5 成脂诱导21 d后油红O染色结果(×100)Fig. 5 Oil red O staining results after 21 days of adipogenic induction (× 100)
由图5可以看出,与空白对照组相比,三唑酮组出现脂滴数量最多,说明三唑酮会使BMSCs向成脂方向进行分化;Lf组脂滴数量最少,这说明Lf能抑制脂滴生成;Lf修复组脂滴数量少于三唑酮组,说明Lf对三唑酮促进BMSCs向成脂分化的进程有拮抗作用。
2.8 成骨诱导21 d后成骨分化基因的表达
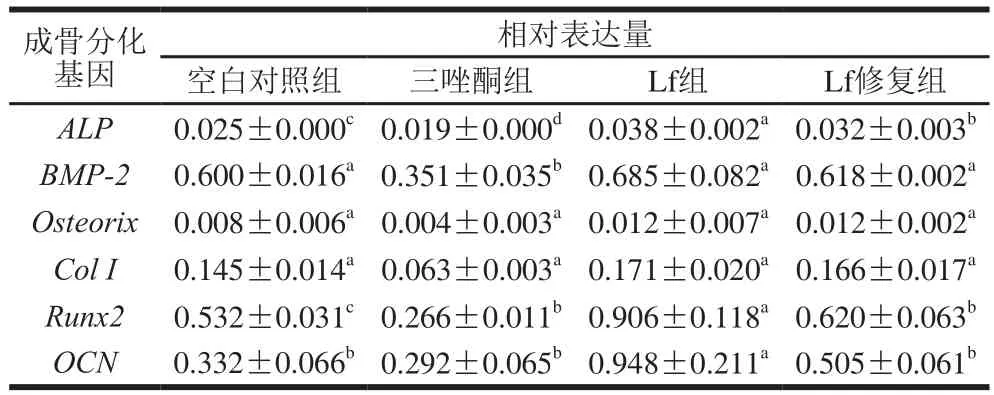
表5 成骨诱导21 d BMSCs成骨分化基因的表达Table 5 Expression of osteogenic differentiation genes in BMSCs after osteogenic induction for 21 days
由表5可知,与空白对照组比较,Lf处理后成骨分化中关键基因的表达水平都有所提高,Lf组ALP、BMP-2、Osteorix、Col I、Runx2、OCN基因表达分别上调52%、14%、50%、18%、70%、186%;Lf修复组上述基因分别上调28%、3%、50%、14%、17%、52%;三唑酮组上述基因分别下调24%、42%、50%、57%、50%、12%。Lf组成骨分化主要基因的上调比例大于Lf修复组。
2.9 成脂诱导21 d后成脂分化基因的表达
由表6可知,与空白对照组比较,Lf处理后都下调了成脂分化中关键基因的表达水平,Lf组PPAR-gamma、LPL、FABP4基因分别下调23%、26%、10%;Lf修复组上述基因分别下调4%、12%、0.5%;三唑酮组上述基因分别上调8%、25%、21%。
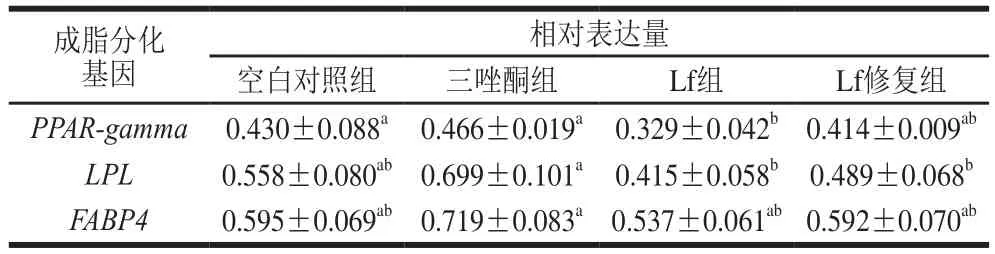
表6 成脂诱导21 d BMSCs成脂分化基因的表达Table 6 Expression of adipogenic differentiation genes in BMSCs after adipogenic induction for 21 days
3 讨 论
本研究选择BMSCs作为细胞模型研究三唑酮对细胞增殖分化损伤及Lf对此损伤的修复作用,选用6 个三唑酮质量浓度梯度(0.01、0.1、1、5、10、20 µg/mL)作用于BMSCs,暴露时间1 d时,最高质量浓度(20 µg/mL)三唑酮能对BMSCs造成损伤,其余较低质量浓度三唑酮会不同程度促进BMSCs增殖;当暴露时间延长至3、5、7 d时,不同质量浓度的三唑酮均能对BMSCs造成显著的损伤,细胞存活率随着暴露时间显著降低,说明三唑酮在所选剂量和时间范围内可抑制BMSCs增殖活性,对BMSCs具有损伤作用。其原因可能是细胞暴露于三唑酮导致活性氧的产生,使细胞膜的结构和功能遭到破坏[27]。三唑酮细胞毒性作用随暴露时间的逐渐增强,可能是由于通过酶的作用使三唑酮产生了毒性作用更强的代谢物三唑醇[28]。Lf可能对这种损伤具有修复作用,所以选用6 个Lf质量浓度梯度(10、20、50、100、150、200 µg/mL)作用于BMSCs后计算细胞存活率,结果表明,Lf对BMSCs无毒性作用且能促进BMSCs的增殖,其中100 µg/mL的Lf作用最显著。分析Lf作用于BMSCs损伤模型后的细胞存活率、ALP质量浓度、OCN质量浓度、茜素红染色、油红O染色和定向分化基因表达变化,结果表明:三唑酮损伤BMSCs后,细胞存活率显著降低,细胞ALP、OCN质量浓度显著降低,矿化结节形成极少,脂滴数量增多,成骨分化相关基因的相对表达显著降低,成脂分化相关基因的相对表达显著增加。而100 μg/mL的Lf就能够提高损伤BMSCs的细胞存活率,增加细胞ALP、OCN水平,增加细胞的矿化结节,减少脂滴的生成,增加成骨分化相关基因的相对表达,减少成脂分化相关基因的相对表达。近年来也有报道证实Lf能够促进不同来源的间充质干细胞定向成骨分化,如Taşli等[29]发现Lf具有促进人源牙胚干细胞向牙源细胞分化的作用;Yagi等[30]研究发现Lf不仅能够使间充质干细胞的ALP、OCN等水平提高,还可以促进软骨分化标志物表达,而成脂分化标志物的表达受到抑制,从而证实Lf能够诱导间充质干细胞定向成骨分化。
综上所述,Lf能够促进骨髓间充质干细胞增殖,使BMSCs向成骨方向进行分化,更好地促进新骨形成,也对三唑酮所诱导的骨髓间充质干细胞损伤具有修复。本研究可以为今后三唑酮残留对BMSCs定向分化的影响提供一定的理论依据,也为Lf调控个体生长发育提供新的理论参考,对于三唑酮在体内的代谢作用机制还有待进一步研究。

