蓝莓花色苷对脂多糖诱导RAW 264.7细胞炎症及结肠癌细胞增殖、凋亡的影响
林 杨,杨 平,张 琦,郎宇曦,邓皓天,孟宪军,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.沈阳师范大学粮食学院,辽宁 沈阳 110034)
炎症性肠病包括克罗恩病、溃疡性结肠炎两种形式,是一种与肠道免疫相关的在结肠和直肠反复发作的炎症性疾病[1]。在过去几十年,炎症性肠病在西方发达国家的发病率很高,近年来,炎症性肠病的发病率在发展中国家迅速增加,已经发展成为一种全球性疾病[2]。炎症性肠病是结肠癌的最主要诱因,炎症性肠病患者的结肠癌发病率高达非炎症性肠病患者的3 倍[3]。研究表明,包括白细胞介素(interleukin,IL)-6、肿瘤坏死因子(tumor necrosis factor α,TNF-α)、IL-1β在内的炎症因子通过调控肠道上皮细胞的增殖、分化及存活而影响癌症的发生[4],而这一过程的发生与由肠道上皮细胞中活性氧失衡引起的氧化应激密切相关[5]。目前,临床通过手术切除结肠及服用一些抗炎或免疫调节药物来治疗炎症性肠病,然而这些药物因为有很强的副作用而不适合长期服用。因此,寻求一种副作用小且安全、有效、健康、绿色的天然替代品对于炎症性肠病及其相关结直肠癌的防治具有重要意义。研究发现,黑果枸杞花色苷提取物[2]、蜂花粉多酚提取物[1]、霉菌胞外多糖提取物[6]、石榴提取物[7]等天然产物可以通过抑制炎症因子,调控细胞增殖、分化明显的改善炎症性肠病及其相关结直肠癌。
蓝莓是杜鹃花科(Ericeceae)越橘属(Vaccinium spp.)植物,因其富含生物活性化合物且具有很强的抗氧化能力而受到广大消费者青睐[8],其主要活性化合物为花色苷。近年来,已有文献报道来源于其他植物的花色苷提取物具有抗肿瘤[9]、抗癌[10]、清除体内氧化应激产生的自由基[11]及改善肠道健康[12]的功效。花色苷已经在一些欧盟国家、澳大利亚及新西兰被批准作为‘E163’食品添加剂使用[13]。抗氧化能力数据库(http://oracdatabase.com)的数据统计显示,每克蓝莓提取物的氧化自由基吸收能力为234.7 μmol(以Trolox计,下同),明显高于葡萄(5.18 μmol/g)、欧洲越橘(56.48 μmol/g)、石榴(188.00 μmol/g)等浆果提取物,研究表明该类浆果中的抗氧化能力主要源自于花色苷[14]。控制炎症是预防和治疗癌症的有效手段,国内外对于蓝莓花色苷提取物的研究主要集中在提取[15]、纯化[16]及稳定性[17]方面。而就蓝莓花色苷提取物对炎症、结肠癌的防治作用及机制方面鲜有报道。本实验采用脂多糖(lipopolysaccharide,LPS)诱导巨噬细胞炎症模型及结肠癌细胞模型,研究蓝莓花色苷提取物对炎症及结肠癌的功效,探讨其可能的机制,为蓝莓花色苷提取物预防炎症性肠病及其结肠癌提供理论依据。
1 材料与方法
1.1 材料与试剂
蓝莓鲜果采购于辽宁省大连市的有机蓝莓基地,冷链运回沈阳农业大学浆果中心实验室,于-80 ℃冰箱冻存至制备提取物。
盐酸(分析纯)、甲醇(分析纯)、甲酸(色谱纯)、乙腈(色谱纯) 国药集团化学试剂公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、噻唑蓝(3-(4,5)-dimethylthiahiazo(-z-yl)-3,5-di-phenytetrazoliumromide,MTT)、LPS 美国Sigma公司;MEM、DMEM培养基 美国HyClone公司;青霉素 美国通用电气医疗集团;胎牛血清(fetal bovine serum,FBS) 美国生命技术公司;对氨基苯甲酸、磷酸、N-(1-萘基)-乙二胺二盐酸盐 北京鼎国生物试剂有限公司;IL-6、TNF-α试剂盒 美国BioLegend公司;鼠抗GAPDH单克隆抗体、兔抗一氧化氮合酶(induced nitric oxide synthase,iNOS)单克隆抗体、鼠抗环氧合酶-2(cyclooxygenase-2,COX-2)单克隆抗体、鼠抗细胞周期蛋白-2(cyclin-dependent kinase 2,CDK2)单克隆抗体、兔抗p53单克隆抗体 美国Proteintech公司。
1.2 仪器与设备
搅拌机 美的集团;电子分析天平 赛多利斯科学仪器(北京)有限公司;SB25-12DTN超声波清洗机 宁波新芝生物科技股份公司;1100高效液相色谱仪(配二极管阵列检测器)、1100质谱仪 美国Agilent公司;CKX41倒置显微镜 日本奥林巴斯公司;SANYAOM10-11AL CO2型恒温细胞培养箱 日本ANTYO公司;酶标仪、C-Digit WB显影仪 美国LI-COR Bioscience 公司;FLUOstar OPTIMA荧光酶标仪 德国BMG公司。
1.3 方法
1.3.1 蓝莓花色苷制备及含量测定
蓝莓果实暗条件下自然解冻后、匀浆,按照前期的方法进行蓝莓提取物的制备[18]。将蓝莓果实与体积分数0.1%盐酸酸化甲醇按照料液比1∶10混合,40 ℃超声波辅助浸提60 min;真空抽滤,并重复浸提至提取液无色;合并滤液,并用旋转蒸发仪在40 ℃条件下浓缩至无甲醇残留。纯化可以去除蓝莓提取物中除花色苷外的糖类、有机酸类、果胶及弱极性的黄酮类物质[19]。本实验将填装有X-AD7大孔树脂的400 mL玻璃柱置于层析柜中,温度设定为4 ℃,蒸馏水冲洗树脂中的杂质,用恒流泵以2 BV/h的流速注入提取物,静置,吸附过夜。用去离子水将水溶性物质洗脱后,用无水乙醇洗脱,流速为2 BV/h。收集并旋转蒸发乙醇洗脱液至无醇味,将浓缩液冷冻干燥。将蓝莓提取物冻干粉至于-80 ℃超低温冰箱,冻存备用。参照前期研究,采用pH示差法测定蓝莓提取物中花色苷含量[18]。
1.3.2 高效液相色谱-电喷雾二级质谱联用分析
样品准备:准确称量5 mg蓝莓提取物冻干粉,并溶解于2 mL色谱纯甲醇溶液,用0.22 μm滤膜过滤,待测。
高效液相色谱-电喷雾二级质谱检测条件:分离柱:Dikma Platisil C18色谱柱(4.6 mm×250 mm,5 μm);柱温:25 ℃;进样量:20 μL;流速:0.7 mL/min;流动相:A为体积分数0.1%甲酸水溶液,B为体积分数0.1%甲酸乙腈溶液;梯度洗脱程序:0~10 min,85% A;10~55 min,85%~35% A;55~67 min,35%~85% A。在正离子模式下进行全自动二级质谱扫描,扫描范围为m/z 150~1 500;毛细管电压为3 500 V;雾化气体为氮气;雾化气压力为40 psi;干燥气流速为12 L/min。使用矢车菊素-3-葡萄糖苷作为标准品,根据二极管阵列检测器检测到的峰面积建立峰面积与物质浓度的标准曲线,计算蓝莓花色苷中各单体的含量。
1.3.3 DPPH自由基清除能力测定
称取2 mg的DPPH粉末溶于50 mL甲醇溶液中,得到DPPH工作液。取两块96 孔板A和B,将100 μL样品和空白溶液分别加入两块96 孔板,在A板中加入100 μL DPPH工作液,在B板中加入100 μL甲醇溶液。避光反应30 min后,在517 nm波长处用酶标仪对板A和B进行读数,并按下式计算DPPH自由基清除率。
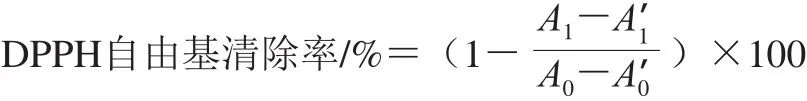
式中:A1为样品与DPPH工作液反应的吸光度;A1’为样品与甲醇溶液反应的吸光度;A0为空白溶液与DPPH工作液反应的吸光度;A0’为空白溶液与甲醇溶液反应的吸光度。
1.3.4 蓝莓提取物对细胞炎症的作用
1.3.4.1 RAW 264.7细胞系培养
将RAW 264.7细胞置于DMEM细胞培养液(含体积分数10% FBS、1%青霉素)中,于培养箱中37 ℃、饱和湿度、5% CO2条件下培养。每2 d进行换液、传代,实验用细胞为2~15 代。
1.3.4.2 RAW 264.7细胞存活率及NO释放能力的测定
在96 孔板中加入200 μL混合均匀的细胞悬液,使细胞浓度达2×104个/孔,过夜培养后,移去培养基并加入200 μL LPS和蓝莓提取物溶液。实验分组包括:空白对照组、LPS(1 μg/mL)组、LPS(1 μg/mL)+不同质量浓度(50、100、200、400、600、800 μg/mL)蓝莓提取物组,空白对照组只加入完全培养基。每组设置4 个复孔,重复3 次,在相同条件下培养24 h。收集培养液用于NO测定,再在每孔中加入100 μL MTT储存液,继续在培养箱中培养3 h,使用酶标仪在490 nm波长处读数。计算对照组细胞的存活率。
采用Griess方法测定收集的培养基上清液中NO含量[20]。即将培养基上清液与Griess试剂等体积混合,反应5 min后,于550 nm波长处测OD值。根据NaNO2标准曲线计算培养基上清液中NO含量。
1.3.4.3 细胞因子IL-6、TNF-α分泌水平测定
在6 孔板中加入2 mL混合均匀的细胞悬液,接种密度为2×105细胞/孔,并分组处理培养24 h。分为空白对照组(细胞生长培养基)、LPS组(1 μg/mL)、LPS(1 μg/mL)+400 μg/mL花色苷提取物组和LPS(1 μg/mL)+600 μg/mL花色苷提取物组。于冰上收集细胞培养基上清液,按照酶联免疫吸附检测试剂盒说明书的步骤测定细胞因子IL-6、TNF-α的含量。
1.3.4.4 RAW264.7细胞中iNOS、COX-2表达测定
将1.3.4.3节中所述细胞于冰上收集上清液后,加入100 μL RIPA裂解液提取细胞核蛋白。用Bradford法测定蛋白含量,计算上样体积。每孔上样15 μg蛋白,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳以200 V恒压、400 mA恒定电流分离样品,转膜,5%脱脂奶粉封闭1 h,TBST清洗后,加入一抗iNOS(1∶1 000)、COX-2(1∶2 000),4 ℃封闭过夜,TBST清洗后,加入稀释5 000 倍的二抗室温孵育1.5 h,TBST再次清洗,曝光显影后拍照。
1.3.5 蓝莓提取物对结肠癌的作用
1.3.5.1 HCT-116细胞培养
HCT-116细胞用含有体积分数10% FBS、1%青霉素的MEM培养基在37 ℃、饱和湿度、5% CO2培养箱中培养,实验用细胞为2~15 代。
1.3.5.2 MTT法检测细胞生存能力
在96 孔板中加入200 μL混合均匀的HCT-116细胞悬液,接种细胞浓度为5×103个/孔,过夜培养,移去培养基后加入不同质量浓度(0、50、100、200 μg/mL)的蓝莓花色苷提取物分组培养24、48、72 h。按照1.3.4.2节中的方法检测并计算细胞存活率。
1.3.5.3 HCT-116细胞中CDK2、p53蛋白表达测定
在6 孔板中加入2 mL混合均匀的HCT-116细胞悬液,接种密度为2×104个细胞/孔,过夜培养后,分别加入50、100、200 μg/mL蓝莓提取物以及添加细胞生长培养基作空白对照组,培养48 h后,参照1.3.4.3节的方法收集蛋白并测定含量,Western blot检测HCT-116细胞中CDK2、p53的表达水平。其中,CDK2一抗、p53一抗均按1∶1 000稀释。
1.4 数据统计与分析
2 结果与分析
2.1 蓝莓提取物花色苷含量及组成鉴定结果
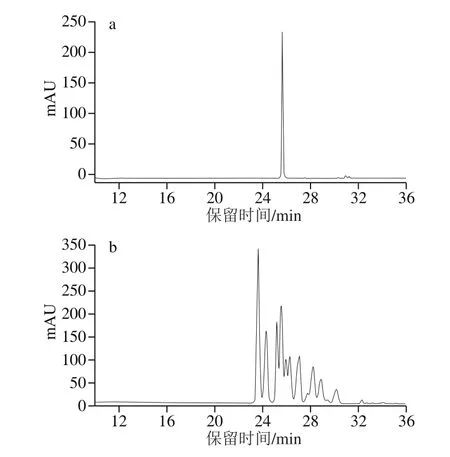
图1 标准品(a)和蓝莓提取物(b)中花色苷高效液相色谱图Fig. 1 HPLC profiles of standards (a) and anthocyanins (b) from BE
蓝莓提取物总花色苷含量为312.75 mg/g(以矢车菊素3-葡萄糖苷质量计,下同),高于文献中报道的黑米、葡萄、紫薯等其他富含花色苷的植物提取物中花色苷含量[21]。Hwang等[22]使用体积分数70%乙醇溶液提取制备的蓝莓提取物花色苷含量仅为11.8 mg/g。蓝莓提取物总花色苷含量测定结果说明本实验的提取、纯化方法能够有效地提取、富集花色苷。图1为蓝莓提取物花色苷组成色谱图,共有12 个峰。参考文献和MS数据(表1)可知:色谱峰1与色谱峰2有相同的分子离子峰(m/z465)和碎片峰(m/z303),Primetta等[23]报道了飞燕草素-3-半乳糖苷优先于飞燕草素-3-葡萄糖苷洗脱,因此判断色谱峰1为飞燕草素-3-半乳糖苷,色谱峰2为飞燕草素-3-葡萄糖苷;同理,判断色谱峰3和色谱峰5分别为矢车菊素3-半乳糖苷和矢车菊素-3-葡萄糖苷,判断色谱峰8和色谱峰10分别为芍药色素-3-半乳糖苷和芍药色素3-葡萄糖苷;色谱峰4和色谱峰7有离子峰(m/z435)、(m/z419)和分子离子峰(m/z303)、(m/z287),而碎片峰(M+-132)代表分子离子峰缺少一个阿拉伯糖,因此色谱峰4为飞燕草素-3-阿拉伯糖苷,同理,判断色谱峰7、9、12分别为矢车菊素-3-阿拉伯糖苷、牵牛花色素-3-阿拉伯糖苷和锦葵色素-3-阿拉伯糖苷;另外,质谱分析发现,在28.6 min,除了芍药色素-3-半乳糖苷,还有锦葵色素-3-半乳糖苷出现,而在液相色谱图中只有色谱峰10出现,因此推测二者为共同洗脱,同理推测色谱峰11为芍药色素-3-葡萄糖苷和锦葵色素-3-葡萄糖苷的共同洗脱峰。这与文献报道的在蓝莓、蓝靛果等浆果的花色苷组成分析中出现共同洗脱现象相似[24]。根据表1对液相色谱图的峰面积统计可得:该蓝莓提取物中质量浓度最高的4 种花色苷为:飞燕草素-3-半乳糖苷(51.66 μg/mL)、飞燕草素-3-阿拉伯糖苷(34.33 μg/mL)、飞燕草素-3-葡萄糖苷(27.21 μg/mL)、矢车菊素-3-阿拉伯糖苷(28.08 μg/mL)。飞燕草素家族花色苷广泛存在于果蔬中,已经被证明能够通过抗氧化作用抑制肿瘤的发生、迁移[25],蓝莓提取物中飞燕草素家族花色苷在总花色苷组成中占很大比例,因此推测蓝莓提取物具有抑制炎症、抗癌的作用。
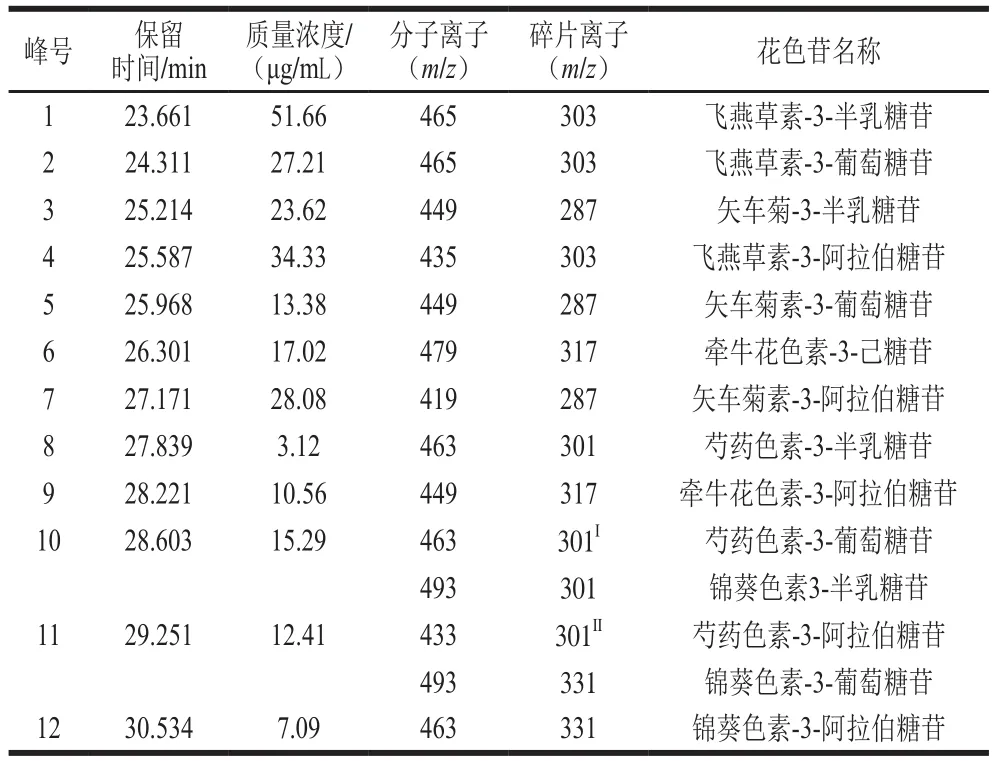
表1 蓝莓花色苷提取物中花色苷组成鉴定Table 1 Identification of anthocyanins in BE
2.2 蓝莓提取物DPPH自由基清除能力
人体内代谢产生的自由基和活性氧可以引起细胞膜脂质、细胞蛋白质、DNA和酶的损伤,而具有抗氧化能力的活性物质能够有效清除这些自由基和活性氧[26]。本实验通过对DPPH自由基清除能力的测定来分析蓝莓提取物的抗氧化能力。
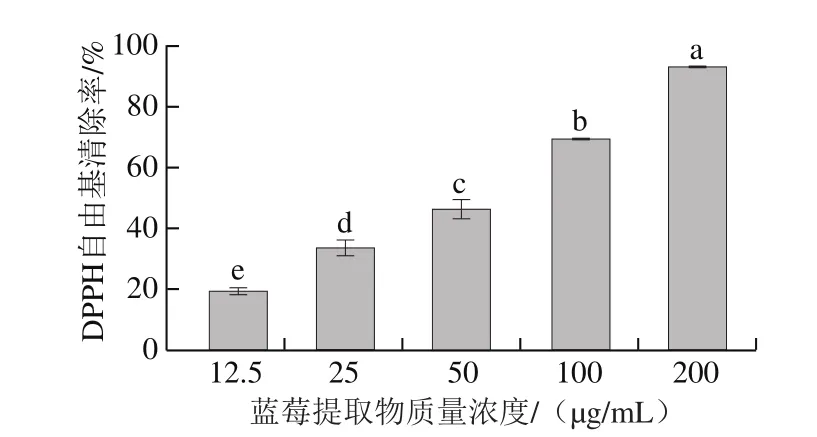
图2 不同质量浓度蓝莓提取物对DPPH自由基清除率Fig. 2 DPPH radical scavenging capacity of BE at different concentrations
由图2可知,蓝莓提取物有很好的DPPH自由基清除能力,且随着质量浓度增加而显著升高(P<0.05),在质量浓度为200 μg/mL时,蓝莓提取物的DPPH自由基清除率高达(93.38±3.84)%。蓝莓提取物DPPH自由基清除率的半抑制浓度(half maximal inhibitory concentration,IC50)为42.00 μg/mL,比多种黑醋栗(56.19~61.17 μg/mL)[27]和枸杞(784~1 254 μg/mL)[28]DPPH自由基清除率的IC50低,说明其抗氧化性更高。
2.3 蓝莓提取物对LPS诱导RAW 264.7细胞炎症的作用
2.3.1 蓝莓提取物对RAW 264.7细胞NO释放的影响
肠道发生炎症时,LPS的生成量会随革兰氏阴性菌数量而增加,影响炎症性肠病的发生发展,炎症和肿瘤有着十分紧密的联系,长期的炎症是肿瘤发展的主要诱因,通过LPS诱导RAW 264.7细胞产生炎症也是常见的炎症研究模型[29]。NO与免疫调节密切相关,是炎症发病机制中的重要信使[30]。

图3 蓝莓提取物对LPS诱导RAW 264.7细胞NO释放的影响Fig. 3 Effect of BE on LPS-induced NO production in RAW 264.7 cells
由图3可知,与空白对照组相比,LPS组RAW 264.7细胞NO释放水平显著升高(P<0.05)。蓝莓提取物质量浓度不高于100 μg/mL的处理对LPS诱导的RAW 264.7细胞NO释放水平无显著影响(P>0.05),而质量浓度范围为200~800 μg/mL的蓝莓提取物显著降低了LPS诱导RAW 264.7细胞NO释放水平(P<0.05),且蓝莓提取物对LPS诱导264.7细胞NO释放水平随质量浓度增加而增加,说明蓝莓提取物具有抗炎作用。
2.3.2 蓝莓提取物对RAW 264.7细胞增殖的影响
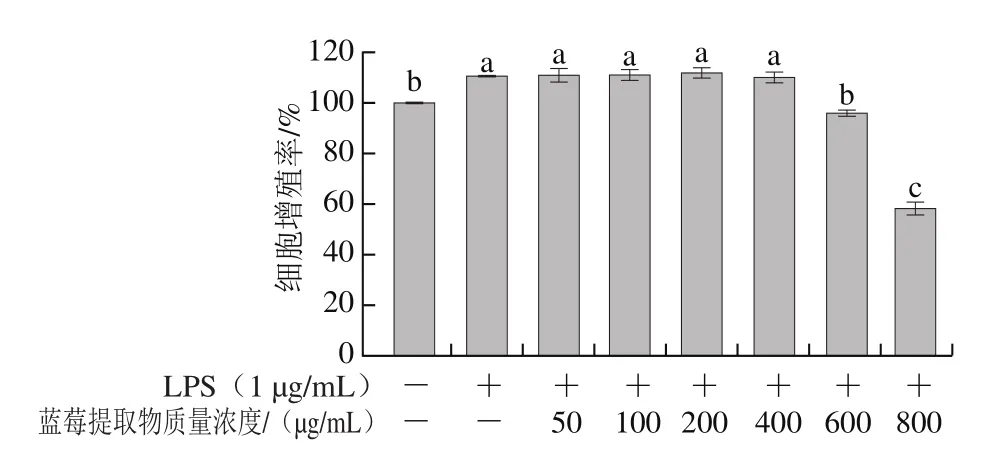
图4 蓝莓提取物抑制RAW 264.7细胞增殖的作用Fig. 4 Effect of BE on the proliferation of RAW 264.7 cells
肠道慢性炎症是结直肠癌发病的一个主要诱因[31]。如图4所示,与空白对照组相比,经过1 μg/mL LPS处理24 h后,RAW 264.7细胞增殖率显著升高(P<0.05),说明建模成功,LPS成功诱导了RAW 264.7细胞炎症。与LPS组相比,50、100、200、400 μg/mL蓝莓果实提取物处理组RAW 264.7细胞增殖率无显著差异;而经过24 h处理后,600、800 μg/mL蓝莓提取物对RAW 264.7的抑制率分别增加至4.32%和41.94%,均显著低于空白对照组和LPS组,因此选择质量浓度为400 μg/mL和600 μg/mL的蓝莓提取物溶液处理RAW 264.7细胞以进行炎症因子调节作用的研究。
2.3.3 蓝莓提取物对LPS诱导RAW 264.7细胞中IL-6和TNF-α分泌的影响
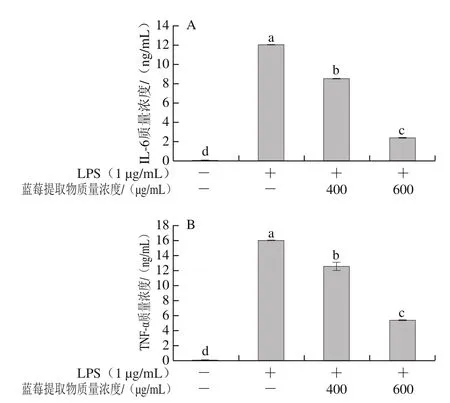
图5 蓝莓提取物对LPS诱导RAW 264.7细胞分泌IL-6(A)、TNF-α(B)的影响Fig. 5 Effect of BE on LPS-induced secretion of IL-6 (A) and TNF-α (B)in RAW 264.7 cells
细胞中促炎因子分泌的增加可加速炎症的发展[32]。由图5可知,LPS组中IL-6、TNF-α的水平显著高于空白对照组(P<0.05),而400、600 μg/mL的蓝莓花色苷提取物显著降低了LPS诱导的RAW 264.7细胞中IL-6、TNF-α的分泌水平(P<0.05)。与LPS组比,600 μg/mL蓝莓提取物处理使得LPS诱导的RAW 264.7细胞中IL-6、TNF-α分泌分别下降了80.0%和66.21%。实验结果表明,蓝莓提取物能够通过下调RAW 264.7细胞炎症因子的分泌从而抑制炎症。
2.3.4 蓝莓提取物对LPS诱导RAW 264.7细胞iNOS和COX-2表达的影响
如图6所示,蓝莓提取物能够有效抑制LPS诱导RAW 264.7细胞模型中COX-2的表达,且抑制效果随质量浓度增加而增加。在空白对照组中未检测到COX-2蛋白的表达,与LPS组相比,400、600 μg/mL蓝莓提取物处理后,COX-2的蛋白表达量下降至LPS组的89.7%和39.74%。研究表明,非甾体类抗炎药可以有效地抑制COX-2蛋白表达[33],并且通过抗IL-6抗体阻断IL-6的分泌可以减缓溃疡性结肠炎患者的炎症[34]。相似的,本实验发现蓝莓花色苷对COX-2蛋白的表达具有抑制作用。
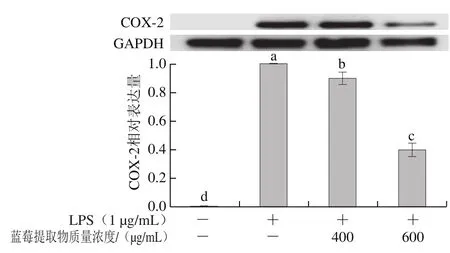
图6 蓝莓提取物对LPS诱导RAW264.7细胞COX-2蛋白表达的影响Fig. 6 Effect of BE on LPS-induced expression of COX-2 in RAW 264.7 cells
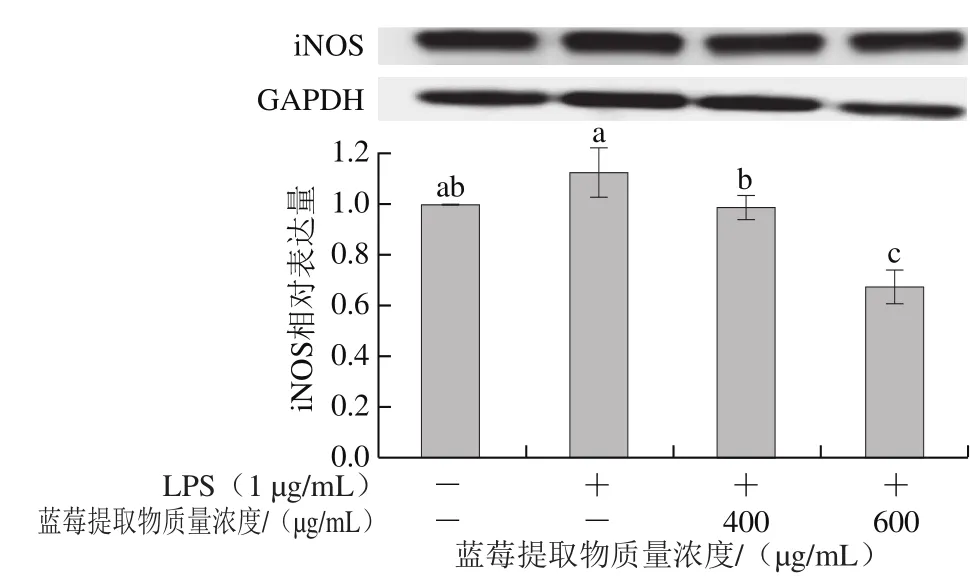
图7 蓝莓提取物对LPS诱导RAW264.7细胞iNOS蛋白表达的影响Fig. 7 Effect of BE on LPS-induced expression of iNOS in RAW 264.7 cells
如图7所示,LPS组中iNOS表达量高于空白对照组,蓝莓提取物有效地降低了iNOS蛋白表达量,且600 μg/mL蓝莓提取物处理后,iNOS的表达量显著低于空白对照组。Serra等[35]发现矢车菊素-3-葡萄糖苷通过抑制NO、PGE2、IL-8的产生及iNOS、COX-2的表达降低HT-29细胞中促炎因子的水平。本实验结果进一步证实了蓝莓提取物可以调控NO的释放以及炎症因子IL-6、TNF-α和iNOS、COX-2的表达,对炎症产生具有抑制作用。
2.4 蓝莓提取物对结肠癌细胞的作用
2.4.1 蓝莓提取物对结肠癌细胞增殖的影响
如图8所示,蓝莓提取物明显抑制了HCT-116细胞的增殖,不同质量浓度蓝莓提取物处理相同时间后HCT-116细胞增殖率显著减小(P<0.05),说明蓝莓提取物对HCT-116细胞的增殖作用具有剂量依赖性。蓝莓提取物处理24、48 h和72 h后,HCT-116结肠癌细胞的IC50分别为196.86、191.52 μg/mL和153.36 μg/mL,其IC50随时间延长而减小,具有时间依赖性。蓝莓提取物对结肠癌细胞增殖的抑制作用归因于其中的花色苷、黄酮、多酚类化合物,这些化合物已经被证实对结肠癌有很强的抗增殖效果[10]。
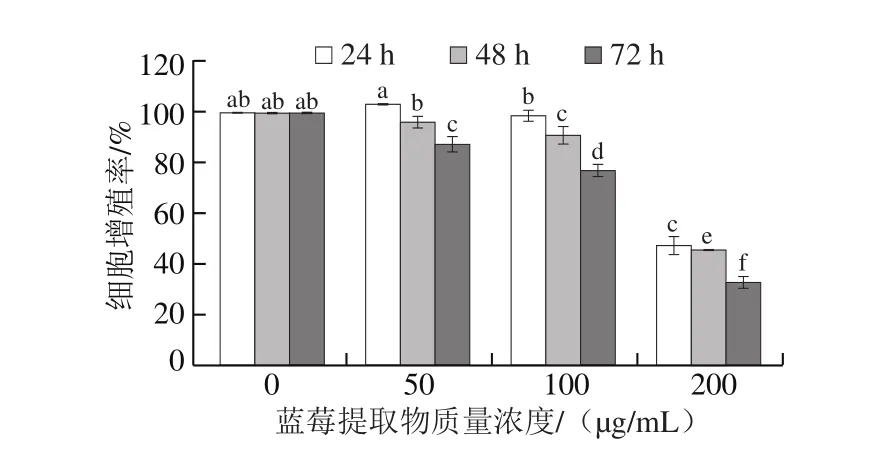
图8 蓝莓提取物对HCT-116细胞增殖的影响Fig. 8 Effect of BE on the proliferation of HCT-116 cells
2.4.2 蓝莓提取物对结肠癌细胞CDK2和p53蛋白表达的影响
诱导细胞周期停滞是控制癌症发展的有效策略[36],细胞周期激酶(cyclin dependent kinases,CDKs)的表达水平可以很大程度影响细胞周期。作为细胞G1期的重要调节因子,CDK2被认为是化学手段预防治疗癌症的重要靶点[37]。
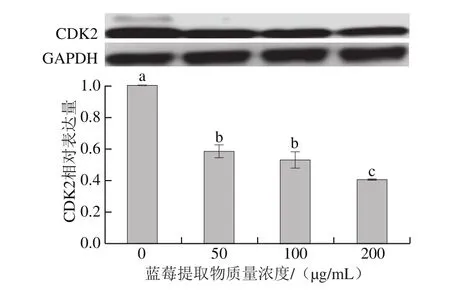
图9 蓝莓提取物对HCT-116细胞中CDK2蛋白表达的影响Fig. 9 Effect of BE on the expression of CDK2 in HCT-116 cells
如图9所示,蓝莓提取物可以显著降低HCT-116细胞中CDK2蛋白的表达量(P<0.05),50、100 μg/mL和200 μg/mL的蓝莓花色苷提取物处理48 h后,CDK2蛋白的表达水平分别下降至对照组的58.55%、52.83%和40.66%。研究表明,CDK2参与多个通路的调控,在肿瘤细胞细胞周期的调节中发挥关键作用[38-39]。
诱导细胞凋亡是预防与治疗癌症的另一有效手段[40]。肿瘤抑制因子p53能够抑制异常细胞的生长并诱导其凋亡[41]。实验结果如图10所示,与空白对照组相比,蓝莓提取物处理显著上调了细胞凋亡相关蛋白p53的表达水平(P<0.05)。随着蓝莓提取物质量浓度的增加,p53蛋白的表达水平显著增加(P<0.05)。使用200 μg/mL蓝莓提取物处理后,p53蛋白的表达水平是空白对照组的2.69 倍。结果表明蓝莓提取物对p53蛋白的表达具有调节作用。这与León-González等[25]的研究结果相似,黑醋栗花色苷提取物处理急性T细胞白血病细胞,能够抑制细胞增殖、诱导p53蛋白的激活并下调细胞凋亡蛋白Bcl-2的表达。Srivastava等[42]研究发现蓝莓花色苷提取物能够通过增加DNA的片段化及Caspase-3的活性诱导HT-29结肠癌细胞凋亡;体内、体外研究说明几种花色苷单体对HCT-116和HT-29细胞无抑制作用,全食品具有协同作用,其对癌细胞的效果优于几种花色苷或酚类化合物单体的效果[21]。
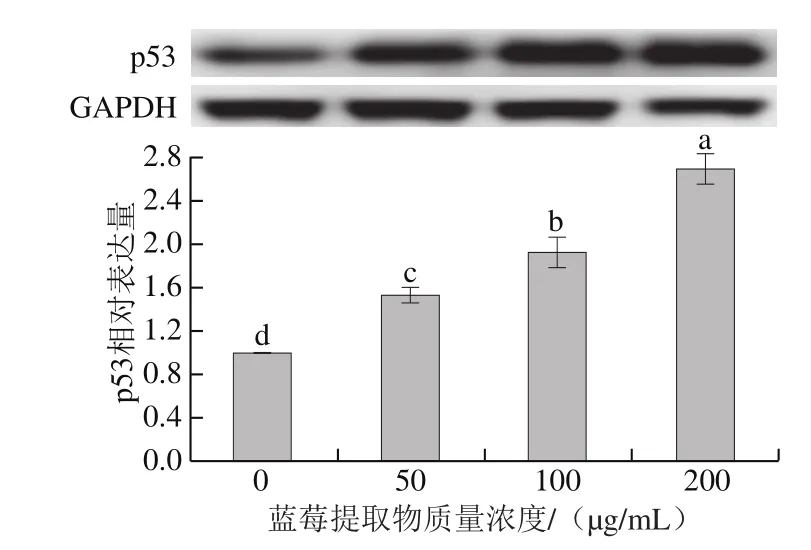
图10 蓝莓提取物对HCT-116细胞中p53蛋白表达的影响Fig. 10 Effect of BE on the expression of p53 in HCT-116 cells
3 结 论
本实验通过高效液相色谱-电喷雾二级质谱技术测定了蓝莓提取物的花色苷组成,并通过测定DPPH自由基清除能力发现蓝莓提取物有很强的抗氧化能力;同时,构建了LPS诱导RAW.264.7细胞模型,发现蓝莓提取物可以通过抑制NO释放,下调炎症因子IL-6、TNF-α的水平,降低iNOS、COX-2蛋白表达来抑制炎症;通过结肠癌细胞模型,发现蓝莓花色苷提取物能够抑制结肠癌细胞增殖,调控CDK2和p53蛋白的表达。因此,蓝莓提取物能够显著地抑制炎症及结肠癌细胞的增殖,并且对与细胞增殖、凋亡相关的蛋白表达具有调节作用,这为蓝莓提取物在炎症性肠病及相关结直肠癌的应用提供了理论依据。

