烟酰胺核糖对酒精暴露小鼠抑郁样行为及肠黏膜通透性改善效果
姜雨杉,刘 颖,王子龙,薛美兰,常志尚,梁 惠,*
(1.青岛大学公共卫生学院,山东 青岛 266021;2.青岛大学基础医学院,山东 青岛 266071;3.青岛大学生物医学公共支撑平台,山东 青岛 266021)
抑郁症作为一种常见的精神障碍,已被世界卫生组织列为全球残疾或非致命健康损失首要单一因素,它也是造成全球疾病负担以及自杀的主要因素之一[1-3]。酒精滥用是诱发抑郁症的关键危险因素[4-5],由此引发的严重危害已引起社会广泛关注,并成为公共卫生领域研究热点。肠道黏膜屏障是防止肠道内有害物质入侵机体内环境并维持其稳态的一道重要屏障[6-8],肠黏膜屏障完整性的破坏与炎症性肠病、酒精性肝病等多种疾病的发生发展密切相关[9-11]。多项研究表明,抑郁症患者常伴有肠道屏障功能受损和肠黏膜通透性增加[12-13]。因此,修复肠黏膜损伤、减少肠渗漏,可望作为新的作用靶点用于抑郁症防治。烟酰胺核糖(nicotinamide riboside,NR)作为一种VB3,主要来源于牛奶和酵母等[14]。近年来,多项研究发现,NR作为一种营养补充剂具有神经保护作用[15-17],而神经可塑性、神经发生、神经营养状态、神经元死亡等都与抑郁症的发生密切相关[18-19]。但目前关于NR对酒精性抑郁改善效果及肠黏膜屏障修复作用的研究却鲜有报道。本研究以酒精暴露小鼠为研究对象,探讨NR对其抑郁样行为的改善效果,并系统观察NR对其肠黏膜通透性的保护作用。
1 材料与方法
1.1 动物、材料与试剂
SPF级7 周龄雄性C57BL/6J小鼠,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006。
NR(纯度96%) 湖北巨胜科技有限公司;乙醇(分析纯) 国药集团化学试剂有限公司;组织蛋白提取试剂盒、蛋白检测试剂盒 江苏碧云天生物技术有限公司;occludin及ZO-1抗体 美国Cell Signaling Technolog公司;β-actin抗体及各相应二抗北京中山金桥生物技术有限公司;生物素(EZ-link Sulfo-NHS-Biotin) 美国Pierce Chemical公司;链霉亲和素(Streptavidin DyLightTM488 Conjugated) 美国Thermo公司。
1.2 仪器与设备
DYY-6C电泳仪 北京六一仪器厂;JEM 1200型电子透射显微镜 日本JEOL公司;RM 2135型石蜡切片机德国LEICA公司;BX53荧光显微镜 美国Olympus公司;RT-6100型酶标仪 美国Rayto公司;ChemiDoc化学发光成像分析系统 美国Bio-Rad公司。
1.3 方法
1.3.1 模型建立与分组
30 只雄性C57BL/6J小鼠,随机分为3 组:对照组、模型组和NR干预组(NR组),每组10 只。按以下方法进行酒精暴露和NR干预:每周一至周四8∶00~16∶00给予模型组和NR组小鼠新鲜配制的体积分数15%乙醇水溶液自由饮用,16∶00~8∶00给予其自来水自由饮用,对照组小鼠全天给予自来水自由饮用,周五和周六切断3 组小鼠一切水源,周日给予3 组小鼠自来水自由饮用。每天8∶00~16∶00给予小鼠光照,16∶00~8∶00剥夺小鼠光照。于每天12∶00对各组小鼠进行灌胃处理,其中,对照组和模型组小鼠给予0.2 mL生理盐水灌胃,NR组小鼠给予400 mg/kg mbNR灌胃。干预期间,各组小鼠自由进食。实验持续10 周后,进行行为学检测。随后禁食不禁水12 h,40 mg/kg mb戊巴比妥钠麻醉,眼球取血,分离血清,-80 ℃冻存;留取脑组织、空肠及结肠组织,部分用于病理学观察及渗透性实验,部分于-80 ℃冻存,用于后续检测。
1.3.2 行为学检测
所有行为学测试均于9∶00~12∶00在同一个光照微弱且安静的房间内进行。于测试前2 h将小鼠引入该实验室以充分适应实验室环境。
1.3.2.1 旷场实验
于酒精暴露10 周后进行旷场实验,以评估小鼠的运动能力以及抑郁样行为。旷场装置是一个长宽高为40 cm×40 cm×30 cm的开放敞箱,内壁全部覆盖白色涂层,上方装有摄像机并连接电脑,使用SMART V3.0软件在敞箱中央标出20 cm×20 cm的中央区域,并记录分析小鼠的运动情况。每次测试前,使用蘸有体积分数75%乙醇溶液的棉球擦拭旷场内壁,以消除残留的小鼠尿液、粪便、气味等对待测试小鼠运动情况的影响。测试时,将小鼠由敞箱中央放入,适应性探索1 min,消除小鼠对新环境的紧张感以免影响其探索运动。记录小鼠随后7 min总运动距离和在中央区域的停留时间。
1.3.2.2 糖水偏好实验
于酒精暴露前及暴露10 周后分别进行糖水偏好实验。本研究参照文献[20-21]报道的糖水实验方案并进行了一定改进。在正式测试之前,为每只小鼠提供两瓶1 g/100 mL蔗糖溶液,持续饮用24 h后,将其中一瓶蔗糖溶液换成自来水,继续饮用24 h,以避免小鼠对蔗糖溶液这一新鲜事物产生恐惧。随后,切断小鼠一切饮水和食物,持续24 h后,进行糖水偏好测试。在实验过程中,为每只小鼠提供一瓶1 g/100 mL蔗糖溶液和一瓶自来水使其自由饮用。并在小鼠饮用前、饮用后1 h和12 h时分别称量瓶质量,以计算小鼠饮用蔗糖溶液和自来水的量。于第0.5小时和第6小时,分别交换两个瓶子的位置,以避免小鼠位置偏好对实验结果的影响。按下式计算小鼠糖水偏爱度。

1.3.2.3 强迫游泳实验
于酒精暴露10 周后进行强迫游泳测试。将小鼠置于圆柱形玻璃容器中(高25 cm、直径10 cm),水深10 cm,水温(23±1)℃。每次实验持续6 min,记录小鼠在最后4 min的运动情况。抑郁小鼠在强迫游泳实验中会出现“不动”状态,主要表现为停止挣扎,被动地漂浮在水中,仅通过一些轻微动作以保持头部浮在水面以上。本研究使用SMART v3.0软件,将运动速率小于0.6 cm2/s作为小鼠“不动”的标准,每隔0.5 s进行一次判断和记录。每次强迫游泳实验后,更换新鲜自来水,消除其对待测小鼠的干扰。测试结束后,将小鼠拭干,放回饲养笼中。
1.3.3 海马组织病理学检查
快速分离小鼠海马组织,置于体积分数10%中性甲醛固定过夜,进行常规石蜡包埋,随后进行连续切片,厚度为5~7 μm,脱蜡。行苏木精-伊红染色,中性树胶封片,光学显微镜下观察各组小鼠海马组织形态学变化。每组观察5 张切片,每张切片观察5 个视野。
1.3.4 血清中脑源性神经营养因子质量浓度检测
采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)实验检测各组小鼠血清中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)质量浓度,严格按照试剂盒说明书操作。
1.3.5 肠黏膜通透性检测
1.3.5.1 血清脂多糖质量浓度检测
采用ELISA实验检测各组小鼠血清中脂多糖(lipopolysaccharide,LPS)质量浓度,严格按照试剂盒说明书操作。
1.3.5.2 空肠及结肠组织细胞连接装置超微结构观察
迅速留取小鼠空肠及结肠1 mm×2 mm组织块,生理盐水漂洗,体积分数2.5%戊二醛溶液固定。24 h后采用pH 7.2 PBS漂洗3 次,体积分数1%锇酸溶液固定80 min,双蒸水漂洗后,梯度丙酮脱水,环氧树脂包埋。制备半薄切片用于组织定位,将定位后的样品块以70 nm厚度切片,质量分数3%醋酸双氧铀染色30 min,柠檬酸铅染色15 min,双蒸水冲洗,于透射电子显微镜下观察肠上皮细胞连接装置并拍摄。每组观察5 张切片,每张切片观察5 个视野。
1.3.5.3 空肠及结肠组织渗透性示踪实验
取空肠和结肠中部2 cm,将一端结扎,采用小鼠灌胃针从另一端缓慢注入2 mg/mL生物素,之后将另一端结扎。室温孵育5 min,体积分数4%多聚甲醛固定3 h以上,冰PBS漂洗3 次,每次3 min。将灌注样品制备成5 μm厚度石蜡组织切片,与链霉亲和素(1∶500稀释)在暗室共孵育30 min。利用荧光显微镜观察生物素在肠道中分布情况。每组观察5 张切片,每张切片观察5 个视野。
1.3.5.4 空肠及结肠组织紧密连接相关蛋白表达水平检测
采用Western blot检测空肠及结肠组织中occludin及ZO-l蛋白表达水平,以β-actin作为内参,结果经化学发光成像分析系统进行定量检测和图片采集。实验重复3 次。
1.4 数据统计与分析
采用SPSS 17.0统计软件进行数据统计分析,多组间比较采用单因素方差分析,以±s表示,P<0.05被认为有统计学意义。
2 结果与分析
2.1 烟酰胺核糖对酒精暴露小鼠认知功能损伤和行为的影响
旷场实验结果显示,模型组小鼠的总运动距离和中央区域停留时间较对照组分别缩短了15.9%和27.7%,NR组小鼠则较模型组分别升高了10.5%和18.5%,但3 组间比较均未见显著性差异(P>0.05)(图1B)。糖水偏好实验结果显示,酒精暴露前,各组小鼠1 h和12 h的糖水偏爱度均未见显著性差异(P>0.05);酒精暴露10 周后,3 组小鼠1 h糖水偏爱度无明显差异,但12 h后,模型组小鼠糖水偏爱度较对照组显著降低了15.1%,NR组小鼠则较模型组显著提高了21.0%(P<0.05)(图1C2)。强迫游泳实验结果显示,模型组小鼠不动时间达到(168.6±34.4)s,与对照组((107.9±47.4)s)相比,显著延长了56.3%,NR补充使小鼠不动时间达到(95.8±24.8)s,较模型组明显缩短了43.2%(P<0.05)(图1D)。
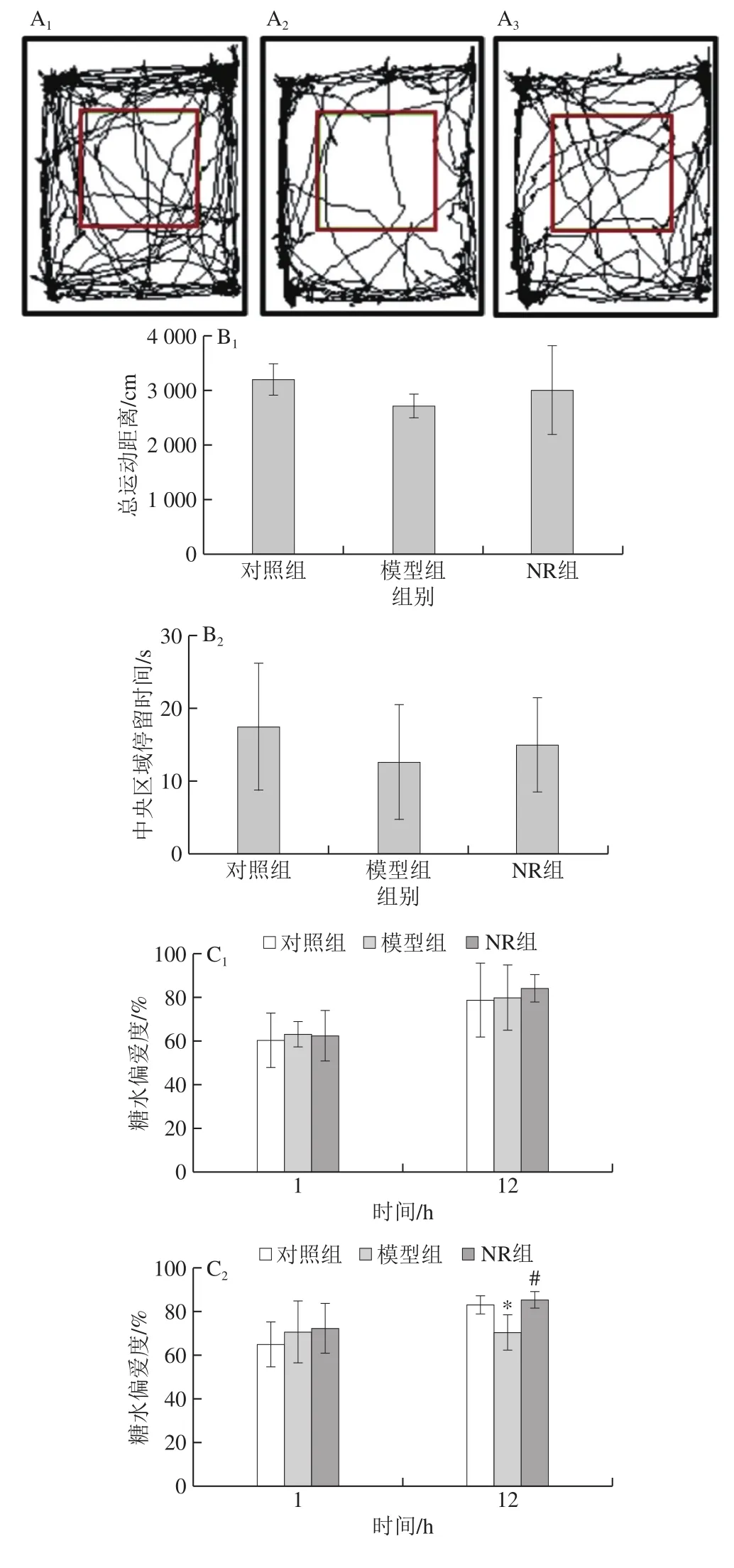
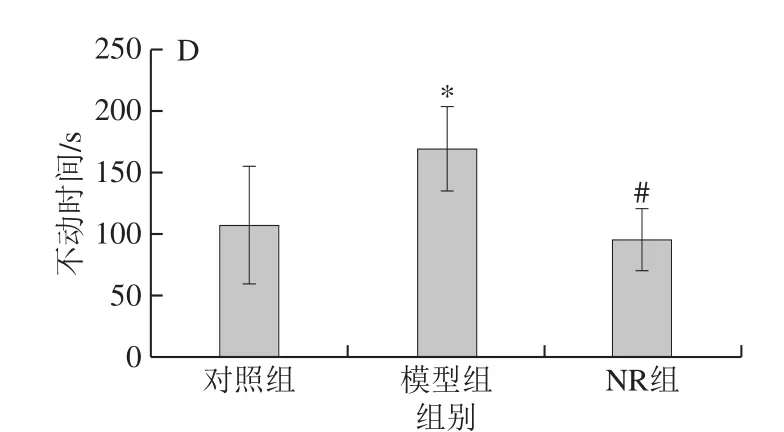
图1 烟酰胺核糖对酒精暴露小鼠抑郁样行为的影响Fig. 1 Effect of NR on depression-like behavior in mice
2.2 烟酰胺核糖对酒精暴露小鼠海马组织病理学的影响
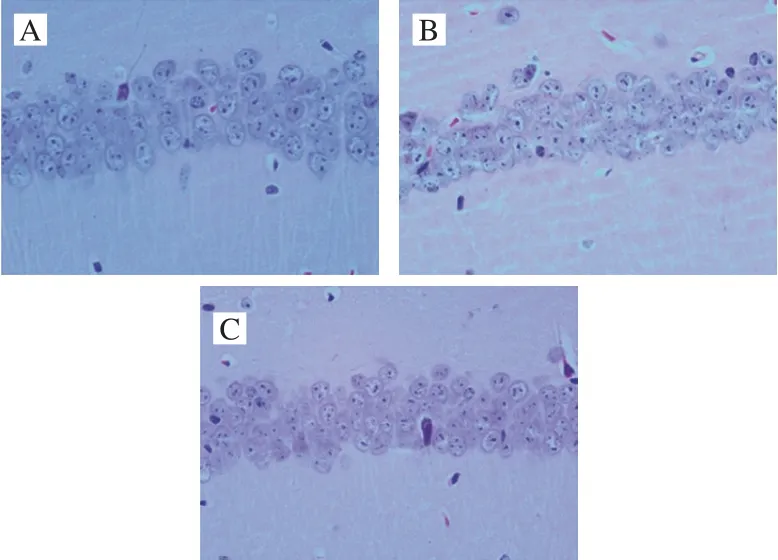
图2 烟酰胺核糖对酒精暴露小鼠海马组织病理学的影响(×400)Fig. 2 Effect of NR on hippocampal histopathology in mice (× 400)
由图2可知,对照组和NR组小鼠海马组织CA1区细胞形态完整规则,排列整齐有序;模型组小鼠海马组织CA1区表现为部分胞体空染,细胞排列无序化,有部分不规则状的深染细胞,提示神经元损伤甚至死亡。
2.3 烟酰胺核糖对酒精暴露小鼠血清BDNF水平的影响
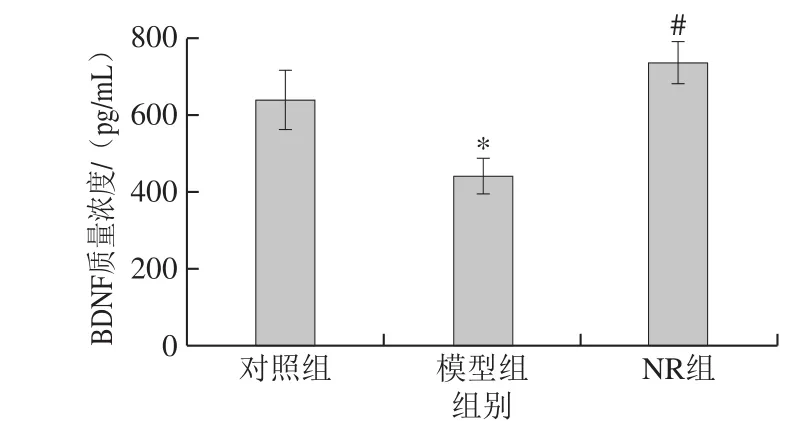
图3 烟酰胺核糖对酒精暴露小鼠血清BDNF质量浓度的影响Fig. 3 Effect of NR on serum BDNF level in mice
由图3可知,模型组小鼠血清BDNF质量浓度达到(438.9±46.7)pg/mL,与对照组((638.1±77.3)pg/mL)相比,显著降低了31.2%;NR干预后,小鼠血清BDNF质量浓度达到(735.7±55.7)pg/mL,较模型组显著增加了67.6%,经统计学分析,均具有显著性差异(P<0.05)。
2.4 烟酰胺核糖对酒精暴露小鼠肠黏膜通透性的影响
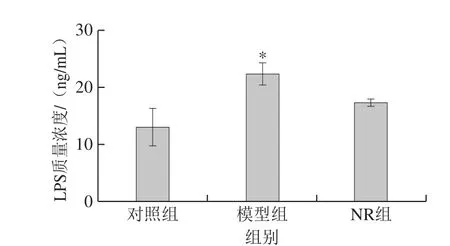
图4 烟酰胺核糖对酒精暴露小鼠血清LPS水平的影响Fig. 4 Effect of NR on serum LPS level in mice
由图4可知,对照组血清LPS质量浓度为(13.2±3.0)ng/mL,模型组达到(22.5±1.8)ng/mL,较对照组显著升高了70.5%(P<0.05);透射电子显微镜结果显示,模型组小鼠空肠及结肠黏膜上皮细胞紧密连接模糊,电子密度降低,中间连接缝隙异常增宽;示踪实验结果显示,模型组小鼠空肠和结肠组织生物素示踪剂向黏膜下层渗透(图5);Western blot结果发现(图6),与对照组比较,模型组小鼠空肠及结肠occludin和ZO-1蛋白表达水平均显著降低(P<0.05)。NR补充使酒精暴露小鼠血清LPS质量浓度较模型组减少,达到(17.5±0.3)ng/mL(图4);空肠及结肠黏膜上皮细胞连接装置得到明显修复(图5);肠黏膜渗透性降低;occludin和ZO-1蛋白表达水平亦出现不同程度升高,其中,空肠ZO-1蛋白表达水平较模型组显著升高(P<0.05)(图6)。
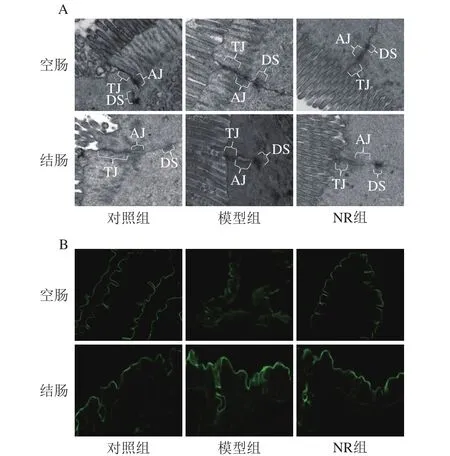
图5 烟酰胺核糖对酒精暴露小鼠肠黏膜超微结构和渗透性的影响Fig. 5 Effect of NR on intestinal mucosal ultrastructure and permeability in mice
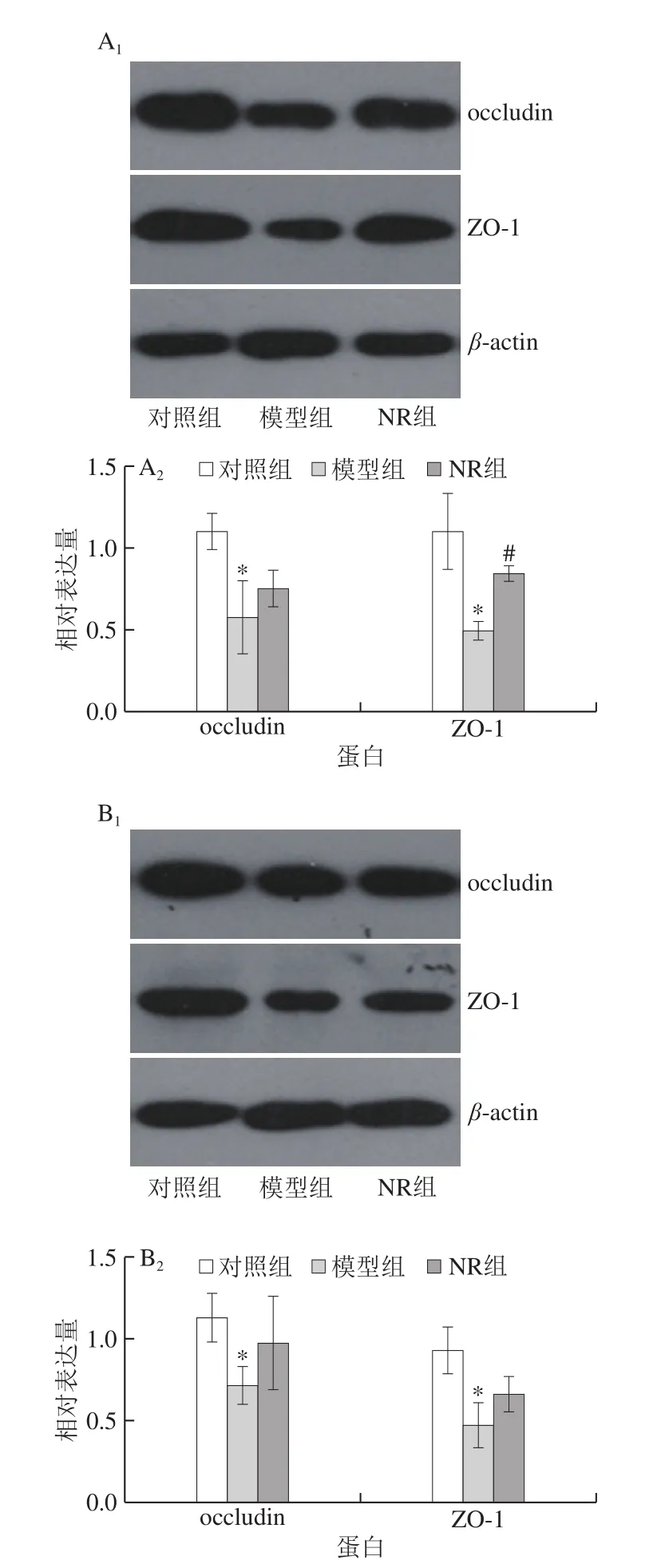
图6 烟酰胺核糖对酒精暴露小鼠空肠及结肠组织occludin和ZO-l蛋白表达水平的影响Fig. 6 Effect of NR on the expression of occludin and ZO-l in jejunum and colon of mice exposed to alcohol
3 讨 论
多项研究表明,NR作为一种营养补充剂具有神经保护作用。王柔昕等[22]研究发现,NR可有效改善母婴隔离后青春期大鼠抑郁样行为,并提高其空间学习记忆能力。Brenner等[23]研究发现,与常规饲料喂养的母鼠相比,饲料里添加了NR的母鼠其乳汁中含有更多的BDNF,其子代的成年后代更少表现出焦虑和抑郁样行为,且空间记忆力能力更强。Hou Yujun等[15]研究发现,NR可显著地恢复AD模型小鼠神经炎症、突触可塑性和DNA损伤,并改善小鼠学习记忆和运动功能。上述研究均表明,NR对部分中枢神经系统病变具有良好的修复作用,但尚不清楚其对酒精性抑郁是否同样具有预防和保护作用。本研究以NR为干预物,通过一系列行为学、病理学和生物标志物检测,观察其对酒精暴露小鼠抑郁样行为的改善效果;并采用多种肠黏膜通透性检测方法,探讨NR改善抑郁样行为可能的肠道屏障功能作用机制。
旷场实验、糖水偏好实验和强迫游泳实验是目前评价动物模型抑郁样行为的常用方法[24-27]。本研究结果发现,酒精暴露导致了小鼠典型抑郁状态的发生。如在旷场实验中,总运动距离的减少及其在中央区域停留时间的缩短,表明酒精暴露小鼠在面对新环境时的探索能力、好奇心及适应能力均受到明显影响;强迫游泳实验中不动时间的显著延长,表明酒精暴露小鼠表现出一定程度行为绝望状态;同时,糖水偏爱度的显著降低也提示酒精暴露小鼠欣快感的缺失。研究结果还发现,NR补充能够提高小鼠运动能力和探索行为,显著缓解小鼠绝望、淡漠等抑郁样行为,表明NR对酒精暴露小鼠抑郁样行为具有一定预防和保护作用。
为了进一步明确酒精暴露小鼠的抑郁样状态以及NR对其的预防和保护作用,本研究进行了小鼠海马组织病理学检查及BDNF血清学检测。海马是抑郁症最常累及的大脑区域,它对下丘脑-垂体-肾上腺皮质轴的活动具有抑制作用,并广泛地参与机体认知功能和情感处理[28-29]。多项研究表明,抑郁症患者存在海马区神经元损伤及死亡[18,30]。BDNF是在脑组织中合成的一种蛋白质,广泛分布于中枢神经系统[31]。它在抑郁症的学习记忆、认知功能和情绪障碍等病理生理学改变的调节中发挥关键作用[32-33]。血清BDNF含量可在一定程度上反映脑组织BDNF水平,它被认为是抑郁症发生发展及药物疗效评价可能的生物标志物之一[34-35]。Bus等[34]对1 751 人持续2 年的随访研究及Molendijk等[36]对179 项研究进行的系统回顾和荟萃分析发现,抑郁症患者常伴随血清BDNF含量的显著减少,抗抑郁治疗后血清BDNF水平随之恢复正常。本研究结果发现,酒精暴露小鼠海马组织出现神经细胞损伤,且血清BDNF水平显著降低,而NR干预后均得到明显改善,表明除了典型的抑郁样行为外,酒精暴露小鼠也出现明显的抑郁样病理和生理学改变,从而进一步证实了本研究已成功建立酒精性抑郁的小鼠模型,并进一步肯定了NR对小鼠酒精性抑郁具有一定的预防和保护作用。
近年来,研究发现抑郁症会伴随肠黏膜屏障损伤[12-13],修复肠黏膜屏障也因此成为药物改善抑郁状态潜在的作用靶点。肠黏膜上皮细胞连接装置对于维持肠黏膜屏障的完整性至关重要[10],主要由紧密连接、黏附连接、缝隙连接和桥粒组成[11],其中,紧密连接是肠黏膜上皮细胞间最主要的连接方式,occludin是紧密连接中主要跨膜蛋白和功能蛋白,它与支架蛋白ZO-1及其他跨膜蛋白及黏附分子共同构成细胞间稳定的紧密连接体系,参与肠黏膜屏障功能调节[37-38]。LPS是肠道中革兰氏阴性菌代谢产物,如肠黏膜屏障遭到破坏,肠黏膜通透性增高,LPS等有毒物质便可大量释放入血,引发肠渗漏及多种炎症性疾病的发生[39-41]。本研究检测结果发现,酒精暴露小鼠存在肠黏膜通透性和血清LPS异常增高的现象,NR补充使肠黏膜紧密连接等细胞连接装置得到有效修复,渗透性降低,血清LPS含量也出现一定程度的下降。以上结果均表明,NR补充可使小鼠肠黏膜屏障损伤状况得到有效缓解和改善,这可能是NR对小鼠酒精性抑郁发挥预防和保护作用的机制之一。
综上,NR作为一种重要的营养补充成分,可有效缓解酒精暴露小鼠抑郁样行为,其作用机制可能与NR对酒精性抑郁小鼠肠黏膜通透性的修复作用有关。这些新发现为合理补充膳食营养素以改善人体健康提供了科学依据。

