加热温度对麻鸭肌原纤维蛋白结构与凝胶特性的影响
王正雯,田宏伟,周富裕,张志芳,何 俊,孙杨赢,曹锦轩,潘道东,*
(1.宁波大学 浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315800;2.宁波大学食品与药学学院,浙江 宁波 315800;3.湖北周黑鸭企业发展有限公司,湖北 武汉 430040)
骨骼肌蛋白主要包括肌原纤维蛋白和肌浆蛋白[1],其中肌原纤维蛋白占总蛋白质量分数的52%~56%[2],是肌肉蛋白的重要组成部分。肌原纤维蛋白是一种动态蛋白复合体系,其中不同蛋白的相互作用为蛋白复合物和肌肉结构提供稳定性[3]。肌原纤维蛋白具有良好的凝胶能力和水结合能力,加热可诱导形成凝胶[4]。热凝胶化过程涉及蛋白受热变性展开,包括蛋白的构象变化、疏水相互作用以及氢键、二硫键等相互作用,随后蛋白之间发生聚集,形成有序的三维网状结构[5-6],因此温度是肌纤维蛋白凝胶特性的最重要影响因素之一。凝胶性能会直接影响肉制品的嫩度、咀嚼性、保水性和颜色等品质,这些变化最终决定了产品的品质和口感。柔软多汁的质地是影响消费者对熟肉制品选择和接受的主要因素[7],因此肉类加工业的目标是在确保并增强理想感官属性的同时,改进加工工艺生产安全的消费产品[8]。
肌肉的来源和类型也影响其凝胶特性。目前,肌原纤维蛋白的热凝胶特性也已在不同物种中被广泛研究,包括鸡、牛、猪、兔、火鸡、鱼类、虾类和鱿鱼[5],尽管大多数肉类产品具有相似的蛋白组分,但肌原纤维蛋白的胶凝特性却有所不同,而关于鸭肉肌原纤维蛋白凝胶特性尚需进行深入研究。麻鸭品种优良,具有肉质细嫩、味道鲜美的特点,其蛋白含量高于鸡肉、羊肉等禽畜肉,宜加工为既营养又易于消化吸收的鸭肉制品,具有广阔的发展前景。因此,研究不同加热温度对麻鸭肌原纤维蛋白凝胶特性及其结构的影响,阐明二者变化之间的内在联系,有助于优化麻鸭肌原纤维蛋白凝胶工艺条件、补充和完善麻鸭肌原纤维蛋白凝胶理论。
本实验以麻鸭胸脯肉为研究材料,利用拉曼光谱、质构分析仪、扫描电子显微镜等研究不同加热温度下肌原纤维蛋白二级结构、凝胶质构特性和微观结构的变化;探讨加热温度对麻鸭肌原纤维蛋白二级结构和凝胶特性的影响,并分析蛋白结构与凝胶特性之间相关性,以期为拓展鸭肉制品的工业应用提供理论依据。
1 材料与方法
1.1 材料与试剂
麻鸭 浙江省宁波市镇海江南家禽育种有限责任公司;戊二醛、乙醇、叔丁醇等(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
TA-XT2i质构分析仪 英国Stable Micro Systems公司;inVia-Reflex拉曼光谱仪 法国Renishaw公司;Allerga高速冷冻离心机 贝克曼库尔特有限公司;M200全波长酶标仪 瑞士Tecan公司;S3400N扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 原料预处理
选取360 日龄、体质量2 kg麻鸭,于当地屠宰场宰后,放血、去毛,取鸭胸脯肉,剔除可见脂肪和结缔组织后切碎,真空包装于-40 ℃冰箱存放。
1.3.2 肌原纤维蛋白的提取
参照曹锦轩等[9]的方法,并作适当修改。取2 g样品剪碎加入到15 mL的焦磷酸盐饱和缓冲液(含100 mmol/L KCl、2 mmol/L MgCl2、2 mmol/L乙二胺四乙酸二钠、1 mmol/L二硫苏糖醇、2 mmol/L Na4P2O7、10 mmol/L马来酸,pH 6.8)中,10 000 r/min匀浆30 s,每10 s间歇1 次。匀浆液于1 000×g冷冻离心10 min收集沉淀。将沉淀物重新分散于15 mL肌原纤维蛋白提取液(含100 mmol/L KCl、2 mmol/L MgCl2、2 mmol/L乙二胺四乙酸二钠、1 mmol/L二硫苏糖醇、10 mmol/L马来酸,pH 6.8)中,再次以1 000×g冷冻离心10 min收集沉淀,重复3 次。将多次提取所得沉淀用15 mmol/L pH 8.0的Tris-HCl缓冲液洗涤3 次,用纱布过滤即得纯化的肌原纤维蛋白。蛋白质量浓度采用双缩脲法测定,用牛血清白蛋白作蛋白质量浓度标准曲线,测得所提取肌原纤维蛋白质量浓度为5.29 mg/mL,并将其置于4 ℃保存,48 h内用于制备蛋白凝胶。
1.3.3 肌原纤维蛋白热诱导凝胶的制备
用pH 7.0、30 mmol/L Na2HPO4缓冲液(含0.6 mol/L NaCl)将蛋白质量浓度调至40 mg/mL,加入到25 mm×25 mm称量瓶中,水浴加热,从25 ℃分别线性升温到50、60、70、80、90、100 ℃,保温30 min,随后取出冰浴30 min,4 ℃静置过夜。
1.3.4 肌原纤维蛋白凝胶保水性测定
参照Kocher等[10]的方法,肌原纤维蛋白形成热诱导凝胶后,8 000 r/min条件下冷冻离心10 min。保水性按式(1)计算。
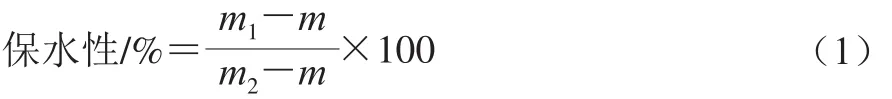
式中:m1为离心后试管与凝胶总质量/g;m2为离心前试管和凝胶总质量/g;m为离心管质量/g。
1.3.5 肌原纤维蛋白凝胶质构分析
参照Dondero等[11]的方法略作改动,采用质构分析仪测定肌原纤维蛋白热诱导凝胶硬度、黏性、弹性。参数设置为:测试探头P/5、测前速率l.0 mm/s、测试速率l.0 mm/s、穿刺距离3 mm、感应力5 g、停留时间5 s。
1.3.6 扫描电子显微镜观察肌原纤维蛋白凝胶微观结构
参照Nishimura等[12]的方法制备观察所用样品,将制备好的蛋白凝胶切成0.5 cm×0.4 cm×0.3 cm的长方体,用体积分数2.5%戊二醛固定2 d后,用磷酸盐缓冲液(pH 7.2)清洗3 次,每次20 min;依次用体积分数为50%、60%、70%、80%、90%的乙醇溶液梯度洗脱各20 min,再用无水乙醇洗脱3 次,每次30 min;最后用叔丁醇置换3 次,每次30 min;将置换后样品冷冻干燥,喷金,用扫描电子显微镜在15.0 kV电压下放大1 000 倍观察蛋白凝胶的微观结构变化。
1.3.7 肌原纤维蛋白表面疏水性的测定
参考Chelh等[13]的方法,用15 mmol/L Tris-HCl缓冲液配制质量浓度10 mg/mL肌原纤维蛋白溶液。取1 mL蛋白溶液加入40 μL 1 mg/mL的溴酚蓝溶液,漩涡混匀,冷冻离心20 min。取上清液,于595 nm波长处测定样品溶液光密度值(OD595nm)。空白对照用15 mmol/L的Tris-HCl缓冲溶液代替蛋白溶液。表面疏水性以溴酚蓝结合量表示,按式(2)计算。
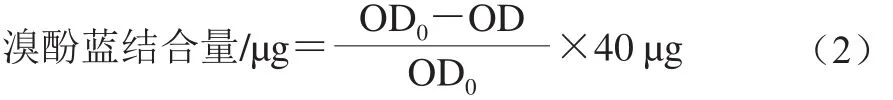
式中:OD0为空白对照组溶液OD595nm;OD为样品溶液OD595nm。
1.3.8 肌原纤维蛋白凝胶的拉曼光谱分析
用20 倍长聚焦镜头将激光聚焦于载玻片上冷冻干燥后的肌原纤维蛋白凝胶样品。具体条件为:532 nm氩离子激光器,功率12 mW,分辨率1 cm-1,每个样品扫描10 次,扫描范围500~4 000 cm-1。用Labspcc软件对光谱进行基线校正去除荧光背景,以苯丙氨酸的单基取代苯基环在1 003 cm-1处的伸缩振动强度作为内标进行归一化。用Peakfit软件对拉曼光谱进行傅里叶去卷积处理,用Origin 2017软件绘制图谱。参考Alix等[14]的方法计算肌原纤维蛋白二级结构相对含量。
1.4 数据处理及分析
本实验每个数据处理设5 个重复,采用SAS 8.01软件进行单因素方差分析,并用Duncan multiple-range test进行多重比较,当P<0.05时为差异显著。
2 结果与分析
2.1 加热温度对麻鸭肌原纤维蛋白凝胶特性的影响
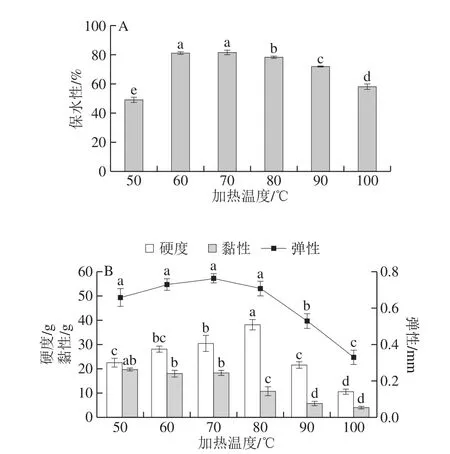
图1 加热温度对麻鸭肌原纤维蛋白凝胶特性的影响Fig. 1 Effect of heating temperature on sheldrake myofibrillar protein gel properties
如图1A所示,麻鸭肌原纤维蛋白凝胶保水性随加热温度的升高呈先上升后下降趋势。加热温度为50 ℃时保水性最低,由于肌球蛋白变性温度至少为68 ℃[15],肌球蛋白重链及头部尚未形成凝胶结构[16]。加热温度为60~70 ℃时,肌球蛋白发生尾-尾聚集,初步形成凝胶,保水性显著升高(P<0.05),于70 ℃时达到最大,表明肌球蛋白尾部相互结合已完成,形成有序的三维网状结构[16]锁住水分,从而提高了凝胶保水性。加热温度进一步升高,麻鸭肌原纤维蛋白凝胶三维网状结构遭到破坏,肌纤维变性收缩失水,凝胶保水性迅速降低,此结果与不同加热温度下鸡肉和猪肉凝胶保水性的变化结果[17-18]相一致。
如图1B所示,凝胶硬度在50~80 ℃范围内逐渐增加,且在80 ℃时达到最大,随后急剧降低。凝胶硬度与蛋白的变性程度有关,蛋白变性程度随着加热温度的升高而加剧,暴露出更多的功能性基团,凝胶硬度随之增大[19]。凝胶弹性于70 ℃达到最大值,有研究表明肌球蛋白尾部的结合程度与凝胶弹性相关[16],表明此时肌球蛋白尾-尾聚集完成,凝胶结构达到最佳状态。蛋白凝胶的黏性随着加热温度的升高,整体呈下降趋势(P<0.05),说明加热使得蛋白的变性行为加剧,其刚性变大而导致黏性降低。
2.2 加热温度对麻鸭肌原纤维蛋白表面疏水性的影响
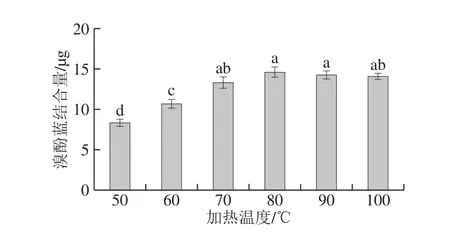
图2 加热温度对麻鸭肌原纤维蛋白表面疏水性的影响Fig. 2 Effect of heating temperature on surface hydrophobicity of sheldrake myofibrillar protein
疏水相互作用对蛋白构象结构稳定性以及蛋白的功能特性具有重要作用,它是维持蛋白质三级构象的主要作用力。如图2所示,随着加热温度的升高,麻鸭肌原纤维蛋白表面疏水性逐渐增强(P<0.05),在80 ℃时达到最大,随后略有下降,但降幅不显著。热处理会改变肌原纤维蛋白部分疏水氨基酸的暴露状态,导致其表面疏水性改变,而疏水相互作用是蛋白间的主要作用力,疏水基团暴露程度的增加可导致凝胶形成硬质结构[19],使得凝胶硬度与蛋白表面疏水性变化趋势一致[20]。
2.3 不同加热温度下麻鸭肌原纤维蛋白凝胶的超微结构

图3 不同加热温度对麻鸭肌原纤维蛋白凝胶微观结构的影响Fig. 3 Effect of heating temperature on microstructure of sheldrake myofibrillar protein gel
由图3可知,50 ℃时麻鸭肌原纤维蛋白凝胶尚未形成,蛋白结构分散;60 ℃形成的蛋白凝胶孔径均匀一致但较为松软,交联不紧密;70 ℃时蛋白充分变性并完成交联,形成紧凑细腻的三维网络结构;随着加热温度进一步升高,蛋白过度变性,凝胶结构逐渐被破坏,凝胶孔径变大甚至发生断裂,出现分离的片状结构。Warner等[21]研究结果表明,随着温度升高,肌原纤维蛋白凝胶超微结构可产生肉眼可分辨的收缩变化。从凝胶微观结构与其保水性的变化趋势可以推测,肌原纤维蛋白凝胶保水性与其孔径呈负相关。
2.4 不同加热温度下麻鸭肌原纤维蛋白凝胶的拉曼光谱分析结果
通过分析蛋白拉曼光谱图中特征峰的峰位置、相对强度以及峰面积,可分析得到蛋白凝胶结构的变化。通过与文献[22-23]比对,可对肽键骨架振动和氨基酸侧链光谱条带进行指认,麻鸭肌原纤维蛋白凝胶拉曼光谱中谱带的归属如表1所示。
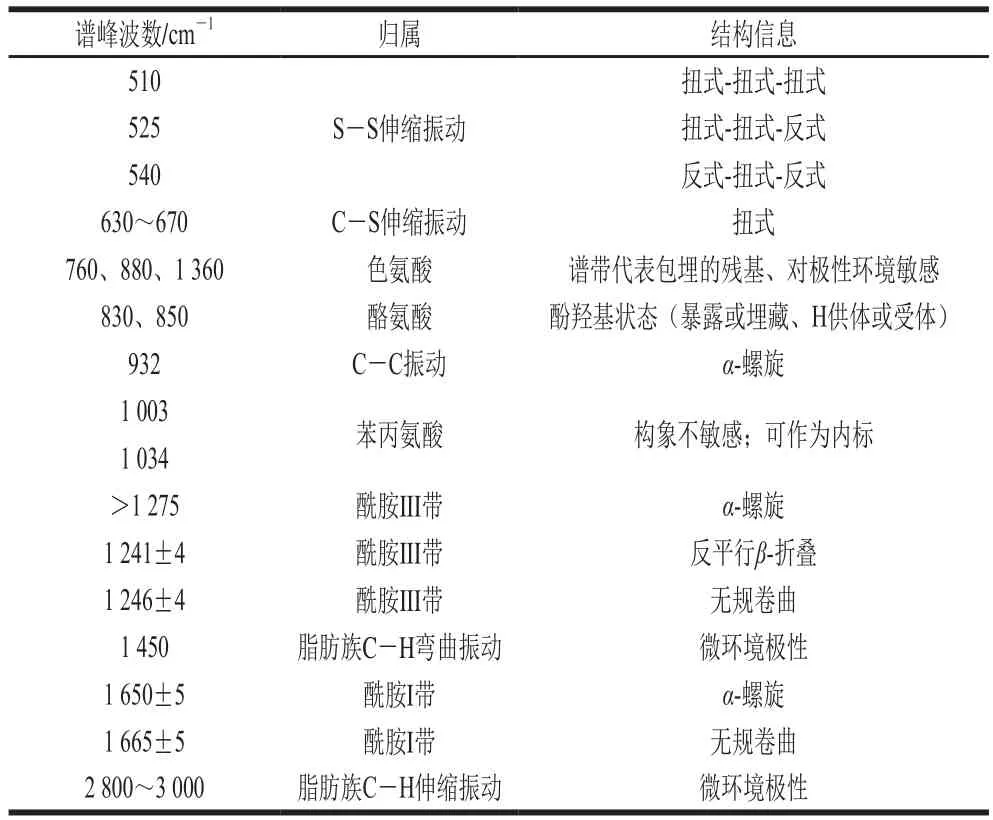
表1 麻鸭肌原纤维蛋白凝胶拉曼光谱中谱带的归属Table 1 Tentative assignment of selected bands in the Raman spectra of sheldrake myofibrillar protein gel
2.4.1 热诱导凝胶过程中麻鸭肌原纤维蛋白二级结构的变化

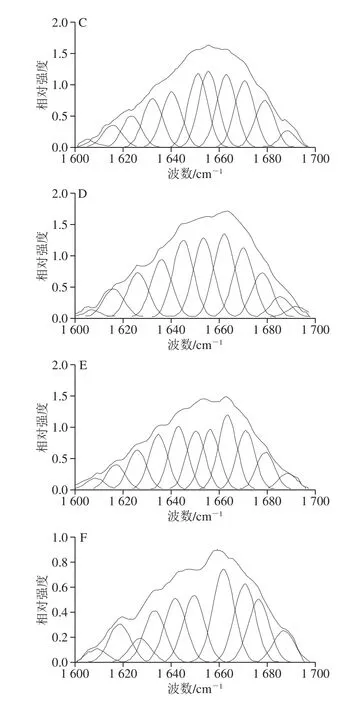
图4 不同加热温度下麻鸭肌原纤维蛋白酰胺I带拉曼光谱去卷积变化图Fig. 4 Deconvolved and curve-fitted Raman bands of amide I of sheldrake myofibrillar protein gels obtained at different heating temperatures
对麻鸭肌原纤维蛋白在1 600~1 700 cm-1范围内的拉曼光谱进行去卷积和曲线拟合,如图4所示。以1 655 cm-1为中心最突出的波段(主导峰)归属于酰胺I带的振动,其主要涉及C=O拉伸,其余低相对强度波谱主要涉及肽基团的C-N平面伸缩振动、Cα-C-N弯曲振动和N-H平面内弯曲振动。这些条带的确切位置取决于多肽链的二级结构,因此,可用于预测蛋白质的二级结构[14]。酰胺I带中α-螺旋含量高的峰集中在1 650~1 658 cm-1,β-折叠含量高的峰集中在1 665~1 680 cm-1,而无规卷曲与β-转角的峰分别集中在1 660~1 665 cm-1和1 680 cm-1附近。50 ℃时,酰胺I带主导峰出现在1 654 cm-1附近,随着加热温度的升高,主导峰位置向高波数偏移;在100 ℃时,主导峰位置偏移至1 660 cm-1,表明α-螺旋逐渐展开,并向β-折叠、β-转角和无规卷曲结构转变。
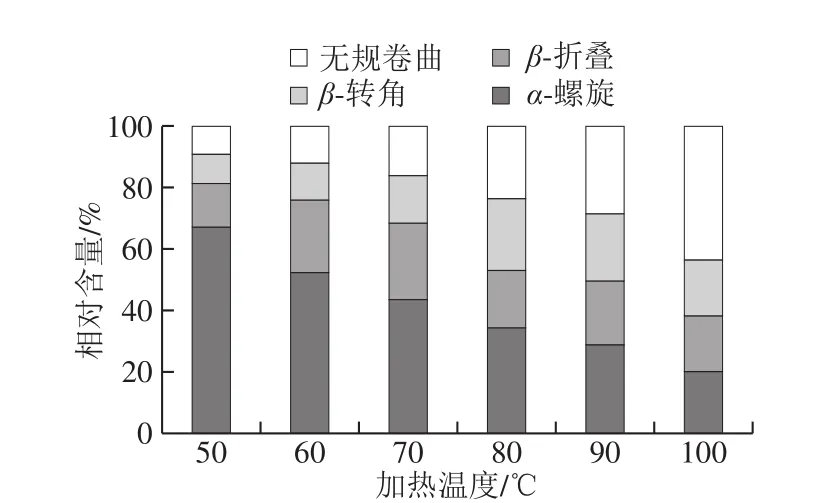
图5 不同加热温度下麻鸭肌原纤维蛋白二级结构相对含量的变化Fig. 5 Relative contents of secondary structures in sheldrake myofibrillar protein at different heating temperatures
酰胺I带可直接定量蛋白二级结构的谱带,因此对其进行去卷积并结合曲线拟合估算麻鸭肌原纤维蛋白中二级结构的相对含量[14]。如图5所示,50 ℃时α-螺旋相对含量高达66.95%,β-折叠相对含量为14.27%;70 ℃时,α-螺旋相对含量显著降低(P<0.05),β-折叠相对含量增加。研究表明α-螺旋含量的降低和β-折叠含量的增加是半透明类型蛋白凝胶的共同特征[24]。Zhuang Xinbo等[25]提出肌原纤维蛋白溶液热诱导凝胶化过程中,蛋白分子通过疏水基团交联聚集形成三维网络结构,过程中伴随着α-螺旋逐渐展开并转变成为β-折叠和β-转角。在100 ℃时,α-螺旋相对含量降低至19.73%,无规卷曲相对含量高达43.81%(P<0.05),表明凝胶结构已逐渐被破坏。Yuan Li等[26]发现类似结果,从50 ℃加热到90 ℃过程中,鳙鱼肌球蛋白的α-螺旋相对含量从75.27%降低至16.74%,且90 ℃下形成的肌球蛋白凝胶呈较不规则孔状结构。
2.4.2 热诱导凝胶过程中麻鸭肌原纤维蛋白色氨酸和酪氨酸残基微环境的变化
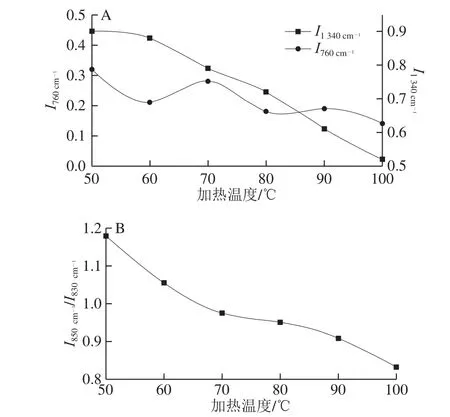
图6 不同加热温度对麻鸭肌原纤维蛋白微环境的影响Fig. 6 Effects of different heating temperatures on microenvironment of sheldrake myofibrillar protein
拉曼光谱在760 cm-1()和1 340 cm-1处谱带相对强度()可用于表征色氨酸残基的微环境变化,即色氨酸残基从包埋的疏水环境暴露于极性环境中时,指代谱带相对强度会降低[22]。由图6A可知,及总体均随着加热温度的升高呈下降趋势,说明掩埋于疏水微环境中的色氨酸残基从包埋态逐渐暴露于极性水溶剂中[24]。热诱导温度由50 ℃升至60 ℃时,由于色氨酸残基环的伸缩振动,明显降低,证明初始阶段麻鸭肌原纤维蛋白表面疏水微环境暴露于极性水溶液中,参与热诱导凝胶化过程。当加热温度达70 ℃时,有所升高,表明加热到70 ℃有效暴露了蛋白的疏水基团[27]。
830 cm-1和850 cm-1附近的双峰带是由酪氨酸费米共振引起的,二者的相对强度比值()可用于监测酪氨酰残基附近的微环境变化[24]。在0.7~1.0之间时,酪氨酸残基包埋在蛋白分子内部;当大于1时,酪氨酸残基暴露于蛋白表面。如图6B所示,随着加热温度的升高,逐渐减小。50 ℃时为1.17,大于1;100 ℃时为0.838,小于1,说明麻鸭肌原纤维蛋白凝胶化后酪氨酸残基从暴露态转变为包埋态,这是由蛋白表面疏水作用导致的[28]。
2.4.3 热诱导凝胶过程中麻鸭肌原纤维蛋白二硫键构象的变化
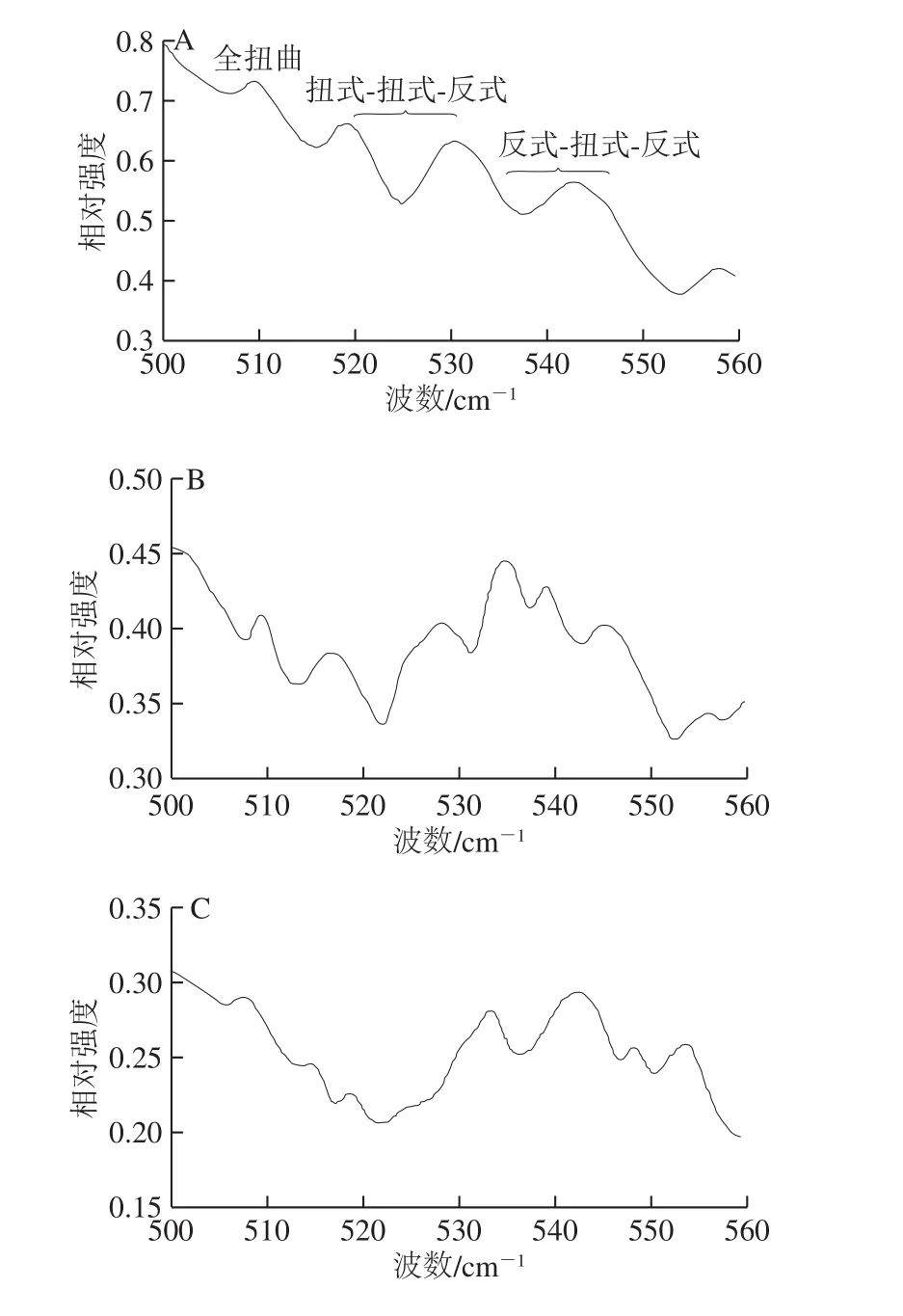

图7 不同加热温度下麻鸭肌原纤维蛋白二硫键构象的变化Fig. 7 Effects of different heating temperatures on the conformation of disulfide bonds in sheldrake myofibrillar protein
拉曼光谱中二硫键谱带位于500~550 cm-1处,其中位于510 cm-1处的谱带归属于含有胱氨酸残基的天然蛋白全扭曲构象。由图7可知,随着加热温度的升高,全扭曲构象谱带相对强度逐渐减弱,80 ℃时510 cm-1峰几乎消失,可能是S-S拉伸振动减小所致,这与Nonaka等[28]指出热诱导凝胶过程中乳清蛋白在508 cm-1附近谱带相对强度降低的结果相同。516~530 cm-1和535~545 cm-1处的谱带分别归属于二硫键扭式-扭式-反式和反式-扭式-反式构象[24]。50 ℃时,二硫键的3 种构象均存在,其中全扭曲构象峰相对强度最强,扭式-扭式-反式其次,反式-扭式-反式相对较弱。综上,二硫键的3 种构象均随着温度的升高不同程度地减少,说明二硫键在热诱导凝胶过程中遭受破坏的同时,也伴随着3 种构象间的相互转化。
2.4.4 热诱导凝胶过程中麻鸭肌原纤维蛋白脂肪族C-H的伸缩振动变化
2 930 cm-1附近出现的明显谱带是由-CH2-和-CH3的不对称性振动引起的[29]。如图8所示,随着加热温度的升高,2 930 cm-1附近的特征峰向高波数方向迁移,50 ℃时位于2 934 cm-1处,而在100 ℃时偏移至2 940 cm-1,这是由于蛋白在解折叠过程,甲基或亚甲基基团暴露,导致拉曼光谱向高波数方向偏移[30]。Careche等[24]发现冷藏后肌球蛋白在2 933 cm-1处的特征峰会向高波数方向移动,并认为是由脂肪族氨基酸基团的暴露所导致的。本实验中随着加热温度的升高,2 933 cm-1处的特征峰强度呈先下降后上升的趋势。70 ℃时,峰强度明显增大,这可能是氢键和疏水相互作用导致的。Bouraoui等[30]研究结果表明,与生鱼糜相比,蒸煮鱼糜中2 930 cm-1处特征谱峰略微向高波数迁移,且此区域特征谱峰相对强度先有所减小,但随着加热温度进一步升高,碳氢化合物链周围环境的极性增强,峰强度又明显增大。因此,由以上结果可以推断,2 900~3 000 cm-1区域内谱峰位置迁移和强度变化取决于脂肪族C-H基团的微环境变化,还可能与疏水相互作用有关。
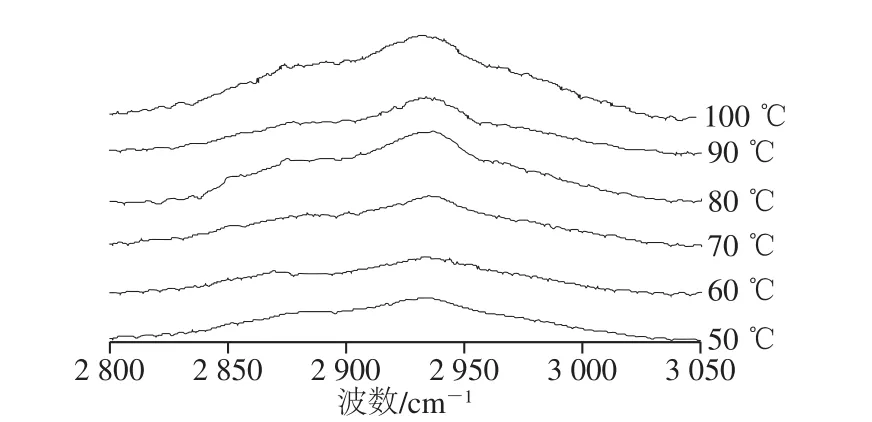
图8 不同加热温度对麻鸭肌原纤维蛋白脂肪族C-H伸缩振动的影响Fig. 8 Effects of different heating temperatures on the C-H stretch vibration of sheldrake myofibrillar protein
2.5 加热温度、麻鸭肌原纤维蛋白结构及其凝胶特性间的相关性
对加热温度、麻鸭肌原纤维蛋白二级结构相对含量及特征峰相对强度、热诱导凝胶特性进行相关性分析。由表2可知,加热温度与α-螺旋相对含量呈极显著负相关(r=-0.990,P<0.01),而与无规卷曲相对含量呈极显著正相关(r=0.961,P<0.01),其中α-螺旋与无规卷曲相对含量呈极显著负相关(r=-0.930,P<0.01),说明随着加热温度的升高,肌原纤维蛋白发生变性、结构展开,二级结构发生改变,α-螺旋结构向β-折叠、β-转角及无规卷曲结构转化,且最终几乎全部转化为无规卷曲结构。表面疏水性与α-螺旋结构相对含量呈极显著负相关(r=-0.918,P<0.01),说明蛋白解螺旋后,表面疏水性增强。由α-螺旋结构相对含量分别与(r=0.961,P<0.01)及(r=0.906,P<0.05)呈极显著或显著正相关可知,随着蛋白二级结构展开,降低,色氨酸残基逐渐暴露于极性环境,使得表面疏水性增强,酪氨酸残基变为包埋态。麻鸭肌原纤维蛋白凝胶弹性与(r=0.890,P<0.05)及(r=0.835,P<0.05)均呈显著正相关,表明加热诱导蛋白变性对凝胶质构产生了明显影响。凝胶保水性与凝胶黏性和硬度均呈显著正相关,且黏性与弹性呈显著正相关。由此可知,凝胶过程是一个蛋白变性和蛋白相互聚集形成三维网状结构的动态过程,凝胶质构的变化伴随着凝胶持水性的改变,蛋白结构决定着凝胶的特性且相互影响。
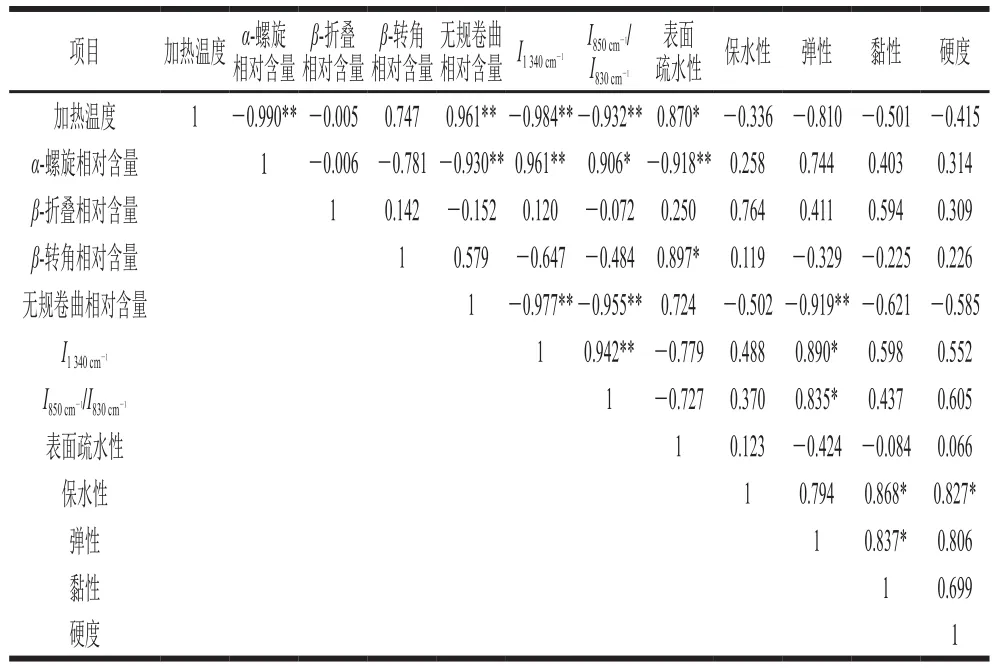
表2 加热温度、麻鸭肌原纤维蛋白结构及其凝胶特性之间的相关性Table 2 Correlation analysis of heating temperature, protein structures and heating-induced gel properties
3 结 论
在50~100 ℃加热过程中,麻鸭肌原纤维蛋白结构展开,β-折叠相对含量升高,促进了凝胶的形成;在凝胶形成过程中,麻鸭肌原纤维蛋白疏水性氨基酸残基暴露,导致蛋白表面疏水性增强;70 ℃是麻鸭肌原纤维蛋白凝胶形成的较佳温度,此时α-螺旋相对含量降低,β-折叠、β-转角、无规卷曲相对含量升高,蛋白形成孔径均匀致密的三维网状凝胶结构,且保水性最高;随着加热温度的继续升高,肌纤维直径明显收缩,导致凝胶结构被破坏,蛋白质无规卷曲相对含量显著增加。

