洋葱AcSVP基因的克隆及其表达分析
陈 微,惠林冲,李威亚,杨海峰,郇国磊,何林玉,缪美华,陈振泰,潘美红*
(1.江苏省连云港市农业科学院,江苏 连云港 222000;2.江苏省云台农场有限公司,江苏 连云港 222000)
洋葱是百合科二年生草本植物,是我国主要的出口蔬菜品种之一,也是推进农业供给侧结构性改革的优质品种。洋葱含有丰富的营养成分,但其先期抽薹会影响产量和品质,使商品性变差,因此,深入了解洋葱的抽薹开花的调控机理,分离鉴定洋葱抽薹开花的关键基因,解析洋葱抽薹开花的机制,可为耐抽薹洋葱种质资源创新和遗传育种提供理论依据。
抽薹开花标志着植物从营养生长到生殖生长的转变,是植物重要的发育特征之一。植物的抽薹开花涉及一个复杂的基因调控网络。对拟南芥的研究发现有5条主要控制开花的遗传途径,包括:光周期途径、赤霉素途径、自主途径、春化途径和年龄途径。在正常条件下,环境或外部条件如光照(光照强度和光照时间)和低温是决定植物开花的关键因素。植物年龄、碳水化合物同化物(主要是蔗糖)和激素(主要是赤霉酸)等内源因素与外部因素的共同作用确定开花时间。
植物中的MADS-box基因家族是被研究最多的转录因子之一,其特征在于N-末端区域的MADS-box保守结构域,参与DNA结合和二聚化[1-2]。MADS-box在植物的花器官形成以及开花时间的调控等方面起到关键作用[3-4]。SVP作为MADS-box家族基因的开花抑制因子,能够抑制FT的表达[5-6]。SVP突变体导致早花,而拟南芥中SVP的过表达能延迟开花并影响花的发育[7-8]。相关研究表明,SVP蛋白通过与FLC蛋白相互作用形成二聚体来调控下游开花整合子基因;另外SVP可能是开花调控网络的另一个中心调节因子,因为该基因受温度、自主和赤霉素途径的控制,并直接抑制茎尖和叶片中SOC1的转录[9]。
目前已从拟南芥[7]、葡萄[10]、猕猴桃[11]、大白菜[5]、小麦[12]、水稻[13]、水仙[14]等多种植物中克隆到SVP的同源基因。在猕猴桃中,已经鉴定出4种SVP的同源基因,并在拟南芥中进行了功能鉴定;SVP基因在冬季芽中的表达增加,但在花分化前下调表达,表明这些基因可能对芽休眠和开花具有重要作用[11]。
鉴于SVP基因在植物花发育过程中的重要作用,本研究利用转录组测序结果,克隆了洋葱的SVP基因的同源序列,并对其后续的生物学信息进行了分析,以期为进一步研究该基因在洋葱花芽分化中的作用提供依据,为阐明洋葱成花调控的分子机理提供技术支撑。
1 材料与方法
1.1 材料
供试洋葱材料“70-1”采自连云港市农业科学院试验基地。其在自然条件下生长,采用小株留种的方法,于2018年9月播种,11月定植,4月下旬抽薹开花。于洋葱的营养生长期S1采集叶片,于抽臺前期S2(有花薹在洋葱内部但未抽出)采集叶片、臺和花蕾(未开放),于抽薹后期S3(外部可见花薹)取叶片、臺和花蕾(未开放),于开花期S4取开放的花朵,用液氮处理后,储存于-80 ℃冰箱中,备用。
1.2 总RNA的合成和cDNA的合成
采用Trizol试剂盒(生工,中国上海)提取洋葱的RNA;以提取的植株总RNA为模板,反转录获得cDNA,所用的反转录试剂是vazyme Hiscript®II Q RT Super Mix for qPCR (+gDNA Wiper) (Vazyme,中国南京)。操作参照试剂盒说明书进行。
1.3 基因的克隆和生物信息学分析
以营养生长期的洋葱叶片总RNA反转录所得的cDNA为模板,以AcSVP-F1和AcSVP-R1为引物(表1),克隆AcSVP基因的全长。反应体系包括:2× Phanta Max Buffer 25 μL、dNTP (10 mmol/L) 1 μL、引物(10 μmol/L)各2 μL、Phanta Max Sμper-Fidelity DNA Polymerase (1 μmol/L) 1 μL、模板cDNA 2 μL,用水补足至50 μL。反应条件为:95 ℃ 3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30 个循环;72 ℃ 5 min。

表1 实验所用的引物
对目标条带进行回收、T-A克隆、测序。利用ExPASy数据库中的ProtParam工具对洋葱的SVP基因的氨基酸序列的理化性质进行分析;利用在线SOPMA程序对蛋白质的二级结构进行预测;利用Blastn检索和DNAMAN 软件对序列的同源性进行分析;利用MEGA生物学软件进行氨基酸多重序列比对及系统发育树构建;利用STRING网站,预测SVP蛋白的共表达网络。
1.4 洋葱AcSVP基因的荧光定量分析
设计特异引物进行表达分析,以Actin-F和Actin-R作为内参,用荧光染料法进行qRT-PCR 表达分析,所用的荧光试剂是AceQ®qPCR SYBR®Green Master Mix (Vazyme,中国南京)。反应体系为10 μL。每个植株样品3个机械重复。扩增的反应条件:95 ℃ 5 min;95 ℃ 10 s,58 ℃ 30 s,共40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s;40 ℃ 5 min。采用2-ΔΔCt法计算基因的相对表达量。
2 结果与分析
2.1 洋葱AcSVP基因的克隆与序列分析
用特异性AcSVPF/R为引物,以洋葱营养生长期叶片的cDNA为模板,扩增得到1个CDS序列,命名为AcSVP;该基因具有1个完整的开放阅读框,其CDS区全长为741 bp,编码246个氨基酸,预测蛋白质的相对分子质量为27798.10,理论等电点(pI)为8.77(图1)。利用NCBI网站中的BLASTp对AcSVP的氨基酸序列进行分析,发现其包含1个MADS-box结构域及1个K-box结构域,属于MIKC型MADS-box基因(图2)。

图2 AcSVP基因的CDS序列和推测的氨基酸序列
图1 洋葱SVP基因扩增的PCR产物
利用ExPASy程序分析发现,该蛋白的氨基酸序列含有带正电荷的氨基酸残基(Arg+Lys)37个、带负电荷的氨基酸残基(Asp+Glu)34个;其不稳定系数为60.59,属于不稳定蛋白。应用SOPMA对该蛋白质的二级结构进行预测分析,结果显示,SVP含有54.47%的α-螺旋、2.85%的β-转角、11.38%的延伸链和31.3%的无规则卷曲。
利用STRING网站,预测与SVP蛋白相互作用的其他蛋白,结果发现,SVP与多个开花蛋白相互作用,共同调控植物的成花过程(图3)。
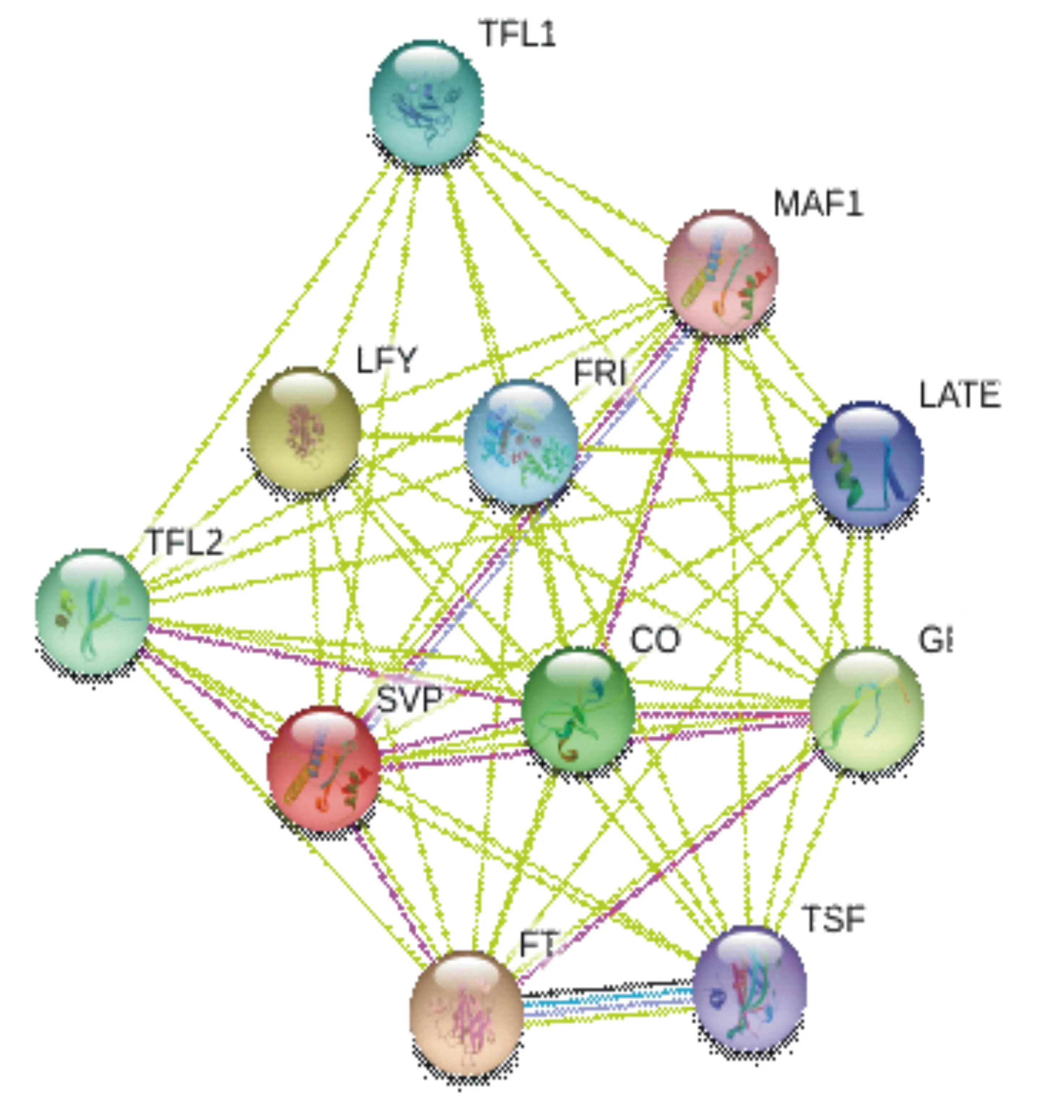
图3 AcSVP蛋白的共表达网络
2.2 洋葱AcSVP氨基酸序列的同源性分析
利用DNAMAN软件,将洋葱AcSVP基因所编码的氨基酸序列与其他植物中SVP基因进行同源性比对,结果(图4)发现:洋葱AcSVP的氨基酸序列与水仙的相似性较高,为60.57%;与小兰屿蝴蝶兰的氨基酸序列的同源性为54.09%;与油棕的同源性为57.59%;与龙眼的同源性为55.69%;与葡萄的同源性为55.47%。
2.3 洋葱AcSVP的系统进化树分析
为了进一步研究洋葱AcSVP与其他植物SVP同源基因的系统进化关系,选取了一些植物的SVP蛋白,利用MEGA 6.0软件构建了系统进化树(图5),其中算法选择N-J算法,重复抽样次数为1000次。结果显示,洋葱与水仙、小兰屿蝴蝶兰、铁皮石斛、菠萝、油棕、马来西亚野生蕉的亲缘关系较近,与葡萄、拟南芥、赤豆、芝麻等的亲缘关系较远。

图5 一些植物SVP基因的系统进化分析结果
2.4AcSVP基因表达的定量分析
为了确定AcSVP基因在洋葱生长过程中的表达情况,将不同发育时期的各个器官进行实时荧光定量PCR, qPCR反应的熔解峰单一,无杂峰,特异性良好。定量结果(图6)显示:AcSVP基因在洋葱叶、花蕾等器官中均有表达,但在不同器官中的表达量存在明显差异;AcSVP基因在花蕾中具有最高的表达量,在叶中的表达量较高,在花和臺中的表达量低。

图6 洋葱AcSVP基因的时空表达特性

AcSVP:洋葱; DlSVP1:龙眼; EgSVP:油棕; NSVP2:水仙; PeAGL22:小兰屿蝴蝶兰; VvSVP:葡萄。图4 洋葱与其他物种SVP氨基酸序列的比对结果
3 讨论
SVP是植物调控开花的重要转录因子,属于MADS-box基因家族,受温敏途径、自主途径与赤霉素途径的调控,在调控植物的成花时间、花发育以及休眠等方面发挥重要的作用[15-17]。目前在许多植物中都发现了SVP同源物,包括一年生和多年生物种。研究显示, SVP家族的1 个关键基因MdMADS50在控制苹果芽休眠及萌发中起重要作用[18],并介导赤霉素信号参与苹果花芽孕育的调控[17]。桃中2个SVP同源基因在芽的休眠和花芽分化过程中起到一定的作用[19]。本研究利用转录组的数据,克隆得到了SVP的全长序列;序列分析发现,AcSVP具有MIKC型MADS-box基因的典型特点,包括1个MADS-box结构域和1个K-box结构域;系统进化分析进一步表明,AcSVP基因与水仙、小兰屿蝴蝶兰、铁皮石斛等物种的SVP基因遗传距离较近。
另有研究发现,SVP蛋白通过与FLC蛋白相互作用形成复合体来抑制FT和SOC1基因的表达,从而延迟开花[20]。组织特异性分析表明,SVP基因在拟南芥的花原基中表达,在花中不表达[7]。梅(Prunusmume)中的PmSVP1基因一般在营养组织中表达,在花芽分化发育期间的表达量降低[21]。在桉树中发现SVP主要在芽、叶和根以及未开放的花蕾中表达[22]。本研究发现,SVP基因在洋葱叶和未开放的花蕾中的表达量较高,在开放的花中表达量低,这与前人的研究结果相似,推测洋葱中的SVP基因作为开花的抑制因子在植物成花转变中发挥作用。但是,洋葱AcSVP与其他MADS-box开花相关基因、蛋白的作用关系还需进一步探讨研究。
4 结论
本研究克隆得到了1个SVP同源基因,命名为AcSVP。AcSVP包含1个741 bp的开放阅读框,编码246个氨基酸。该基因具有MIKC型基因的保守结构域。AcSVP与水仙的亲缘关系较近。AcSVP在洋葱未开放的花蕾中表达量最高,在花薹抽出前的叶中次之,在花中的表达量最低。

