1株鹅细小病毒的分离鉴定及致病特性、VP基因特征分析
刘宝山,李珮瑶,许莉莉,高晶萍,张瑞华,徐 彤
(1.滦平县农业农村局,河北 滦平 068250; 2.河北北方学院 预防兽医学重点实验室,河北 张家口 075000)
鹅细小病毒病是由鹅细小病毒(Goose parvovirus,GPV)引起的可在鹅和番鸭中流行的急性或亚急性败血性传染病,又称小鹅瘟[1],主要侵害4~20日龄雏鹅或雏番鸭。该病传播速度快且病死率高,其特征性病理变化为空肠和回肠的纤维素性坏死性肠炎,坏死脱落的肠黏膜与凝固的纤维素性渗出物形成栓子堵塞肠道[2]。GPV最早由我国学者方定一在江苏地区发现[3],随后迅速传播到全国各地。小鹅瘟是鹅养殖业中不可忽视的传染病,每年都有不同程度的流行,给鹅养殖业造成了严重的经济损失。
承德白鹅是经多年选育形成的地方优良品种,在河北承德地区均有饲养。承德白鹅是中小型品种鹅,适应性强,耐寒耐粗饲,抗病性强,其肉质鲜嫩,适口性好,并且蛋白质含量高、脂肪含量低,对人体健康十分有益[4-5]。承德白鹅主要由当地农户散养,因缺乏防疫和品种保护意识,鹅的数量减少,养殖效益受损。
随着我国经济的快速发展和人们生活水平的提高,人们对饮食健康的要求越来越高,禽产品在饮食结构中占比例越来越大。GPV感染雏鹅导致的死亡率高达90%~100%[6],成为承德白鹅养殖和繁育中的巨大威胁。2018年7月,承德某农户家中饲养的10日龄雏鹅出现大量死亡。对该农户家中疑似GPV感染发病的承德白鹅进行实验室诊断、病毒的分离鉴定及致病特性研究,以期为日后承德白鹅小鹅瘟的防控提供参考。
1 材料和方法
1.1 材料
1.1.1 病料及供试动物 疑似GPV感染的病料由河北承德某农户提供;鹅胚购于张家口市某农户;6日龄雏鹅由河北北方学院预防兽医学重点实验室自行孵化。
1.1.2 主要试剂 GPV标准诊断抗原和标准抗体均购自上海莼试生物技术有限公司;营养琼脂、麦康凯培养基购自北京奥博星生物技术有限责任公司;聚乙二醇6000购自天津市永大化学试剂有限公司;TIANamp Genomic DNA Kit、TIANgel Midi Purification Kit等均购自天根生化科技有限公司;RNA PCR Kit(AMV)Ver.3.0、Taq、DL2000 Marker等均购自TaKaRa(大连) 有限公司;50×TAE 购自北京索莱宝科技有限公司;乙醇、氯仿、异丙醇等均购自天津光复精细化学研究所有限公司。
1.2 方法
1.2.1 背景调查 2018年7月,承德某农户家中孵化的承德白鹅出现大量死亡。据该农户叙述,自行孵化的承德白鹅在孵化后3 d开始出现精神萎靡、不愿走动、食欲不振、饮水增加,5~7 d出现大量死亡,临床可见病鹅排水样白色稀粪、泄殖腔周围被毛被粪便污染、鼻孔内有浆液性黏液、喙部呈暗紫色,剖检可见肝脏肿大变脆,心肌苍白,在消化道出现小鹅瘟典型症状,空肠和回肠的坏死性肠炎,坏死脱落的肠黏膜与纤维素性渗出物形成栓子堵塞肠道。
鉴于上述临床症状和剖检变化,初步怀疑该病是由GPV感染引起的,为进一步确诊该病进行实验室诊断。
1.2.2 细菌分离 无菌采集发病鹅的肝脏、肺脏、脾脏、肾脏等脏器,在超净工作台中接种于普通琼脂和麦康凯培养基中,37 ℃温箱培养18~24 h,观察是否有细菌生长及菌落颜色、形态等。
1.2.3 病毒分离 采集发病鹅的心脏、肝脏、肠道等组织,研磨离心,经抗生素过夜处理后过滤除菌,经尿囊腔接种鹅胚,每胚接种0.3 mL,去除24 h内死亡鹅胚,观察120 h,收集鹅胚尿囊液,盲传3代,将收集的病毒尿囊液备用。
1.2.4 病毒鉴定 将扩增的病毒尿囊液纯化、浓缩后作为待检病毒,以GPV标准诊断抗原为阳性对照,通过琼脂扩散试验鉴定待检病毒。
1.2.5 致病性试验 将10枚鹅胚随机分为试验组和对照组,每组5枚。鹅胚孵化后饲养至第6天,接种分离的病毒尿囊液,试验组每只肌肉注射0.2 mL尿囊液,对照组相同途径注射0.2 mL生理盐水。将上述雏鹅隔离饲养,观察其临床症状并统计死亡情况。
1.2.6 分子特征分析
1.2.6.1 引物设计 根据GenBank中已公布的GPV标准株B序列基因序列,设计2对特异性引物(表1),扩增VP基因,预计VP1片段大小1 397 bp,VP2片段大小1 273 bp,引物由上海生工生物有限公司合成。
1.2.6.2 PCR扩增 按照TIANamp Genomic DNA Kit说明书提取病毒DNA,采用50 μL体系进行PCR扩增:10×PCR Buffer 5 μL,dNTPs 4 μL,Taq0.25 μL,DNA模板2 μL,上、下游引物各1 μL,用水补至50 μL。扩增条件:94 ℃ 5 min;94℃ 30 s,55 ℃ 1 min,72 ℃ 2 min 20 s,进行30个循环;72 ℃ 10 min,最后4 ℃保存。PCR反应结束后,取5 μL反应产物进行0.8%琼脂糖凝胶电泳检测。

表1 VP基因的PCR扩增引物序列Tab.1 Primer sequence of PCR amplification of VP gene
按TIANgel Midi Purification Kit说明书进行DNA回收,取2 μL回收产物进行电泳检测,由华大基因公司进行测序。
1.2.6.3VP基因序列分析 采用DNAStar软件将测得的序列进行拼接,获得完整VP基因序列,用MegAlign秩序进行氨基酸同源性的分析,利用MEGA 6.06软件对分离到的毒株与GenBank中已公布的其他不同种属的GPV(表2)进行序列比对分析。

表2 GPV VP基因序列参考毒株相关信息Tab.2 Reference information of VP gene sequence of GPV
2 结果与分析
2.1 发病鹅细菌分离普通培养基和麦康凯培养基中均未见有细菌生长,表明雏鹅未有细菌感染。
2.2 发病鹅病毒分离鉴定接种病料的鹅胚接种110 h后死亡2枚,其余鹅胚未死亡,但尿囊膜增厚、部分有尿酸盐沉积。将鹅胚解剖后发现,鹅胚胚体有大量出血点,肝脏呈黄红色,有血斑及坏死灶,心肌苍白、肾脏肿胀(图1)。将上述尿囊液收集浓缩后进行琼脂扩散试验,GPV标准抗原与标准抗体反应后,在24 h出现明显白色沉淀线,待检抗原与标准抗体在28 h出现白色沉淀线,表明分离到的病毒是GPV,将其命名为HB株。
2.3 分离病毒致病性试验试验组在感染后28 h死亡2只,48 h死亡1只,96 h死亡2只,死亡鹅与临床雏鹅症状表现及剖检变化相似(图2),均表现白色下痢、精神萎靡、呆立、不愿行走;剖检可见肝脏呈黄红色,肾脏肿大,肠壁变薄,肠道有纤维素性渗出物形成肠道栓塞。

A.肠道栓塞;B.肠壁变薄、出血、白色下痢;C.肾脏肿大;D.肝脏出血A.Intestinal embolism;B.Intestinal wall thinning,bleeding and white diarrhea;C.Kidney enlargement;D.Liver bleeding图2 感染鹅剖检变化Fig.2 Necropsy change of infected goose
2.4 分离病毒分子特征分析
2.4.1VP基因PCR扩增结果 根据设计的2对特异性引物,扩增出的2个片段大小分别约为1 397 bp和1 273 bp,如图3所示,扩增出的片段与目的片段一致。将测序结果拼接后得到VP片段长度为2 475 bp,包含VP1、VP2、VP3等3个开放阅读框(ORF),其大小分别为2 199、1 764、1 605 bp。
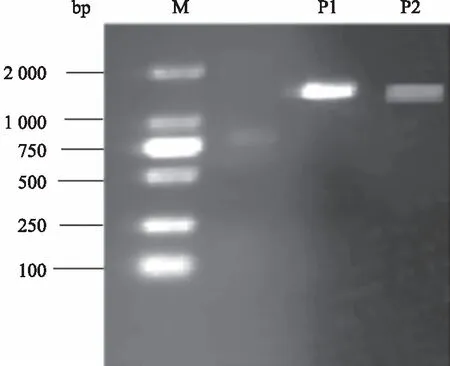
M:DL2000 Marker;P1:VP1片段产物;P2:VP2片段产物M: DL2000 Marker;P1:VP1 fragment product;P2:VP2 fragment product图3 VP基因PCR扩增结果Fig.3 The PCR amplification results of VP gene
2.4.2VP基因遗传进化树分析 将获得的VP基因序列与GenBank中已发表的21株细小病毒进行比较,应用MEGA 6.06软件(NJ法)绘制VP基因的遗传进化树。从图4可以看出,供试细小病毒分为GPV、MDPV 2个大分支,MDPV分支中中国的GPV D株宿主为番鸭,推测可能是GPV感染番鸭后在其体内发生变异,故在分群中处于MDPV分支。GPV分为2个基因亚群,其中Ⅰa群中毒株大多为匈牙利、法国等欧洲毒株,为欧洲亚群;Ⅰb群为亚洲群,Ⅱ群则主要是疫苗毒株。本研究分离毒株HB株(用●表示)处于Ⅰb亚洲群。
2.4.3VP基因编码氨基酸相似性 采用DNAStar软件中MegAlign程序将分离毒株HB株与表2中氨基酸序列进行相似性比较,结果如图5所示,氨基酸相似性在86.7%~99.7%,GPV HB与GPV各毒株VP基因氨基酸相似性在96.6%~99.7%,其中与SHFX1201、Y株的相似性最高,达99.7%;HB株与MDPV毒株氨基酸差异较大。可见,GPVVP基因较为稳定,氨基酸差异不大。

●表示分离毒株HB株● indicates isolated HB strain图4 HB株VP基因遗传进化树Fig.4 Genetic evolution tree of VP gene of HB strain
3 结论与讨论
本试验从河北承德地区的承德白鹅中分离到1株病毒,琼脂扩散试验结果显示,分离毒株为GPV。致病性试验结果显示,试验组6只雏鹅在感染后96 h全部死亡,死亡率为100%,并表现与临床发病鹅相似的症状和剖检变化,即肝脏、肾脏、脾脏肿大,肠壁变薄,肠道有纤维素性渗出物形成的肠道栓塞。这与毛文智等[7]、李琳等[8]的研究结果相似,表明GPV感染是造成此次雏鹅发生死亡的重要原因。
GPV基因组大小约为5 kb,包含2个ORF,左侧ORF编码非结构蛋白NS,右侧ORF编码结构蛋白VP,VP基因包含VP1、VP2、VP3等3个ORF,VP1包含VP2、VP3,他们使用同一终止密码子;NS主要参与DNA复制和转录的调节,还与病毒的增殖有关;VP蛋白是GPV的主要免疫保护性抗原,与病毒毒力和病毒致病性有关[9]。为进一步了解分离毒株HB株的基因变异情况,本研究采用PCR方法对HB株VP基因进行扩增。将测序结果拼接后得到VP片段长度为2 475 bp,包含VP1、VP2、VP3等3个ORF,其大小分别为2 199、1 764、1 605 bp。将VP基因与国内外的GPV毒株进行比对,结果显示分离到的HB株GPV与5株国内分离毒株同处于遗传进化树Ⅰb群(亚洲群);匈牙利、法国等地流行毒株同处于Ⅰa群(欧洲群);Ⅱ群则主要是疫苗毒株。由此可见,HB株与GPV国内分离株VP基因之间差异较小,而与国外分离株结构基因的差异相对较大。这与孔宪刚等[10]对中国分离株HG5/82株VP基因的分子特征分析结果相同。本研究将以上毒株进行了氨基酸序列分析发现,HB株与GPV各毒株VP基因编码氨基酸相似性在96.6%~99.7%,其中与国内SHFX1201、Y株的氨基酸相似性最高,达99.7%,表明其VP同源性较高,这与遗传进化分析结果一致,即目前存在的GPV分离株的遗传关系较近[11-13]。刘中勇等[14]对7株鹅细小病毒进行了克隆扩增并将其与标准毒株B株进行比对,发现目前国内的GPV相似性较高,但强弱毒株之间存在一些差异,以上结果也验证了GPV只有1个血清型的观点[11-12,15]。
GPV与MDPV同属于细小病毒属,两者在病毒大小、形态结构、理化特征及免疫学特性上极为相似[2,16]。程由铨等[17]发现,GPV与MDPV在血清学检测时不发生交叉反应,推测两者在抗原性上存在差异。因此,研究GPV与MDPV核苷酸和推导氨基酸序列的差异性,可为进一步研究两者抗原性差异和宿主感染范围提供基础。本研究将分离的HB株与3株MDPV进行遗传进化分析和推导氨基酸序列分析,结果显示,VP基因遗传进化树分为GPV和MDPV 2支,HB株与MDPV毒株氨基酸差异较大。以上结果表明,GPV与MDPV之间存在较近的遗传关系,两者可能是由同一种病毒在不同宿主体内长期适应的结果。
经过病毒分离鉴定、致病性研究和VP基因扩增,可确定此次承德白鹅的死亡是由GPV感染造成的。本研究对分离毒株的VP基因进行分子特征分析发现,分离到的HB株与其他GPV毒株遗传关系较近,证实GPV只有1个血清型。

