LGALS1对猪繁殖与呼吸综合征病毒在Marc-145中复制的影响
崔一龙,石 芸,薛江东,2,马德慧,2*
(1.内蒙古民族大学 动物科学技术学院,内蒙古 通辽 028000;2.内蒙古自治区肉牛疾病防控工程技术研究中心,内蒙古 通辽 028042)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome ,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的以母猪繁殖障碍和新生仔猪呼吸道疾病为典型症状并导致高死亡率的传染病[1]。PRSSV属于尼多病毒目(nidovirales)动脉炎病毒科(arteriviridae)动脉炎病毒属(arteriviers)[2]。病毒基因组大小约为15 kb,包括10个开放性阅读框(ORFs)。2b蛋白由ORF2b编码,相对分子质量约为8 000,由73个氨基酸组成[3]。2b蛋白是一种较小的PRRSV结构蛋白,目前对其功能的研究相对其他蛋白较少。LEE等[4]试验证明,2b蛋白在PRRSV的复制和感染细胞过程中发挥重要作用。本实验室前期通过构建含有PRRSV 2b蛋白的钓饵菌株与猪肺泡巨噬细胞(PAM)cDNA文库进行酵母双杂交,筛选到了与2b蛋白相互作用的宿主细胞蛋白LGALS1。
LGALS1归属于动物凝集素家族,是一类能够与糖蛋白或聚乳糖胺中β-半乳糖残基相结合的蛋白质。目前哺乳动物中已发现15种该家族成员,依据分子结构不同分为原型、嵌合型和串联重复型3类,但是它们的氨基酸序列同源性很高,都包含至少1个糖结合结构域(CRD,carbohydrate-recognition domain),用以与N-或O-糖链相互作用[5]。LGAL-S1归属于原型,常以单体和非共价结合的两种同源二聚体形式存在,广泛的分布在动物心脏、肺脏、脾脏、脑、淋巴结等组织器官中,在内皮细胞、巨噬细胞、树突状细胞和胸腺上皮细胞等多种细胞中也广泛存在。LGALS1虽然是典型的胞浆蛋白,但是在细胞核内、细胞表面和细胞外基质也有表达,在细胞黏附、增殖、凋亡、免疫反应、肿瘤的病理反应等过程中起到关键作用[6]。很多与LGALS1相互作用的分子已经相继被发现[7]。在黑素瘤细胞中,LGALS1可以介导同型肿瘤细胞的聚集[8];在结肠癌细胞中,LGALS1可以与细胞表面的CD44和CD326等粘附相关因子发生作用[9];在肺癌细胞荷瘤小鼠的肿瘤组织中,LGALS1表达量明显变高并且可以促进肿瘤增殖[10];将LGALS1过表达质粒转染至胶质瘤细胞后可以明显促进肿瘤增殖[11];外源性LGALS1也可以明显促进卵巢癌和胰腺癌细胞的增殖[12];使用LGALS1 siRNA抑制其表达后,恶性胶质瘤细胞和宫颈癌细胞增殖明显降低[13];使用瞬转、稳转LGALS1干涉片段或直接注射中和抗体等方法,可明显抑制卵巢癌、肺癌、乳腺癌、头颈鳞癌和宫颈癌细胞的生长[14]。我们由此猜测LGALS1也可能会在PRRSV入侵机制中扮演重要角色,因此以PRRSV易感细胞Marc-145为研究对象,通过抗体阻断和siRNA法,利用间接免疫荧光、TCID50测定、荧光定量和Western blot来测定病毒的增殖、滴度变化和表达情况,为探索LGALS1对PRRSV在Marc-145细胞中复制的作用提供理论依据,并为PRRSV的防治提供新的思路。
1 材料与方法
1.1 试验细胞、动物和毒株Marc-145细胞、2 kg家兔2只由内蒙古民族大学动物科学技术学院实验室提供;PRRSV毒株JXA1由金宇生物扬州优邦生物药品有限公司惠赠。
1.2 主要试剂与仪器DMEM培养基、胰蛋白酶、2×SDS上样缓冲液购自北京索莱宝科技有限公司;UNIQ-10柱式Trizol总RNA抽提试剂盒、RIPA蛋白裂解液、HRP标记羊抗兔IgG、FITC标记兔抗猪IgG购自生工生物工程(上海)股份有限公司;DNA Marker、蛋白质Marker、Realtime PCR试剂盒购自TaKaRa公司;Lipofectamine 2000、反转录试剂盒购自Invitrogen公司;胎牛血清购自ThermoFisher公司;PRRSV N蛋白单克隆抗体由内蒙古民族大学动物科学技术学院实验室保存。PCR仪、多功能成像系统购自美国Applied Biosystem公司;倒置显微镜购自Olympus公司;制冰机购自SANYO公司;Milli-Q超纯水仪购自美国Millipore公司;5424R台式高速离心机、5810R大容量台式冷冻离心机购自Eppendorf公司;电泳仪购自Bio-rad公司;超净工作台、生化培养箱、电热恒温培养箱、空气摇床购自ThermoFisher公司。
1.3 重组蛋白免疫家兔及抗体效价测定取2 kg家兔2只,1只为蛋白免疫组,1只注射PBS缓冲液作为阴性对照组。取实验室前期纯化保存的LGALS1重组蛋白(0.8 g/L)1 mL,加入等体积的弗氏佐剂进行乳化后对家兔进行首次免疫,2周后加强免疫1次。之后每周耳源静脉采血,分离血清,-20℃保存。按常规间接ELISA方法测定免疫家兔血清的抗体效价,包被抗原为纯化后的重组蛋白,洗涤缓冲液为PBST(Tween 20 3.3 mL,PBS 1 400 mL),封闭液为5%脱脂奶粉(脱脂奶粉5 g,PBST100 mL),第2抗体为HRP标记的羊抗兔IgG。
1.4 免疫血清的Western blot分析按常规方法制备Marc-145细胞和PK-15细胞膜蛋白,经12% SDS-PAGE分离后,将凝胶取出转印,第1抗体为稀释后的免疫兔血清,第2抗体为1∶5 000稀释的羊抗兔IgG。
1.5 siRNA引物设计与合成根据LGALS1基因序列特征,设计特定siRNA,序列为shRNA-F:5′-CACCGCAAAGACAGCAACAACCTGTTTCAA-GAGAACAGGTTGTTGCTGTCTTTGCTTTTT-TG-3′,shRNA-R:5′-AGCTCAAAAAAGCAAA-GACAGCAACAACCTGTTCTCTTGAAAACAG-GTTGTTGCTGTCTTTGC-3′;PRRSV N蛋白荧光定量引物为qN-F:5′-TCCTCTAGCGACCG-AAGATGACG-3′,qN-R:5′-AGGCAGTCTGGAT-CGACGACAG-3′;LGALS1荧光定量引物为qLGALS1-F:5′-CTCGTTTCGACATGCACGGA-3′,qLGALS1-R:5′-CTGGCAGCTTGATGGTGAGG-3′;GAPDH荧光定量引物为GAPDH-F:5′-CTGCCGCCTGGAGAAACCT-3′,GAPDH-R:5′-GCTGTAGCCAAATTCATTGTCG-3′。上述引物由生工生物工程(上海)股份有限公司合成。设置转染siRNA阳性质粒的试验组与转染阴性质粒的对照组,培养24,48 h后分别按照UNIQ-10柱式Trizol总RNA抽提试剂盒提取RNA并反转录为cDNA,实时荧光定量PCR检测质粒抑制效果。反应体系20 μL:10×SYBR GREEN Realtime PCR Master Mix 10.0 μL,模板cDNA 2.0 μL,ROX Reference Dye 0.4 μL,ddH2O 6.0 μL,上下游引物各0.8 μL。扩增条件:50℃ 2 min,94℃10 min进行预变性反应,40个循环反应为94℃ 15 s,60℃ 30 s,72℃ 1 min。
1.6 间接免疫荧光试验在24孔板上培养Marc-145细胞至基本铺满平板。1组取等体积抗LGALS1血清和PRRSV病毒液混合,4℃孵育2 h,然后加入各细胞孔中,500 μL/孔,37℃孵育2 h后吸弃,用PBS洗3次,加入DMEM培养基继续培养;另1组按Invitrogen公司的脂质体Lipofec-tamine2000的转染要求将阳性siRNA质粒转染到Marc-145细胞中,24 h之后接种PRRSV;对照组直接以PRRSV孵育Marc-145细胞。48 h后吸弃培养液,用PBS洗3次,每孔加入500 μL 60%冷丙酮乙醇,-20℃固定20 min,用PBS洗3次,晾干后每孔加500 μL已作100倍稀释的PRRSV阳性血清,37℃孵育1.5 h,再用PBS洗3次,每孔加500 μL 已作100倍稀释的FITC标记羊抗猪IgG,37℃孵育1.5 h,PBS洗3次后,每孔加1滴甘油,用荧光显微镜观察荧光。
1.7 TCID50测定细胞分组处理同1.6。48 h之后,收取试验组与对照组细胞,用培养液在无菌管中作倍比稀释,即10-1~10-8等。将稀释度10-4~10-8的病毒液分别取100 μL接入96孔细胞培养板第1~5列中,每列8孔,同时第6~7列加等量的生长液做对照。之后再向每孔加入100 μL的细胞悬液。然后将96孔细胞培养板放入37℃、5%CO2培养箱中进行培养,48 h后开始观察实验结果,记录产生细胞病变的孔数,直到对照细胞开始衰老为止。按Reed-Muench两氏法计算细胞半数感染剂量(TCID50)[15]。
1.8 qPCR测定目的基因mRNA表达水平细胞分组处理同1.6。48 h之后采集样品qPCR测定各组目的基因mRNA表达水平,具体操作见1.5。
1.9 Western blot测定目的基因蛋白水平细胞分组处理同1.6。48 h之后弃掉细胞样品上清,用PBS洗3次,每孔加入适量RIPA裂解液裂解,之后加入10 μL上样缓冲液,沸水中加热5 min,12 000 r/min离心10 min,取上清经12% SDS-PAGE分离后,将凝胶取出转印,第1抗体为稀释后的PRRSV N蛋白单克隆抗体,第2抗体为1∶5 000稀释的HRP标记羊抗兔IgG。
2 结果
2.1 免疫血清抗体滴度测定免疫后1周开始采集血样分离血清,每周采集1次用间接ELISA方法检测免疫家兔血清中的抗体效价。结果显示,免疫血清抗体水平在免疫后第5周达到高峰期,抗体滴度为1∶10 000左右(图1)。

图1 抗LGALS1血清的抗体滴度
2.2 免疫血清的Western blot鉴定以家兔免疫血清为第1抗体进行Western blot分析,结果显示,能检测到预期的21 000蛋白条带,证明表达的蛋白确为LGALS1蛋白,且重组蛋白仍然保持有免疫原性(图2)。
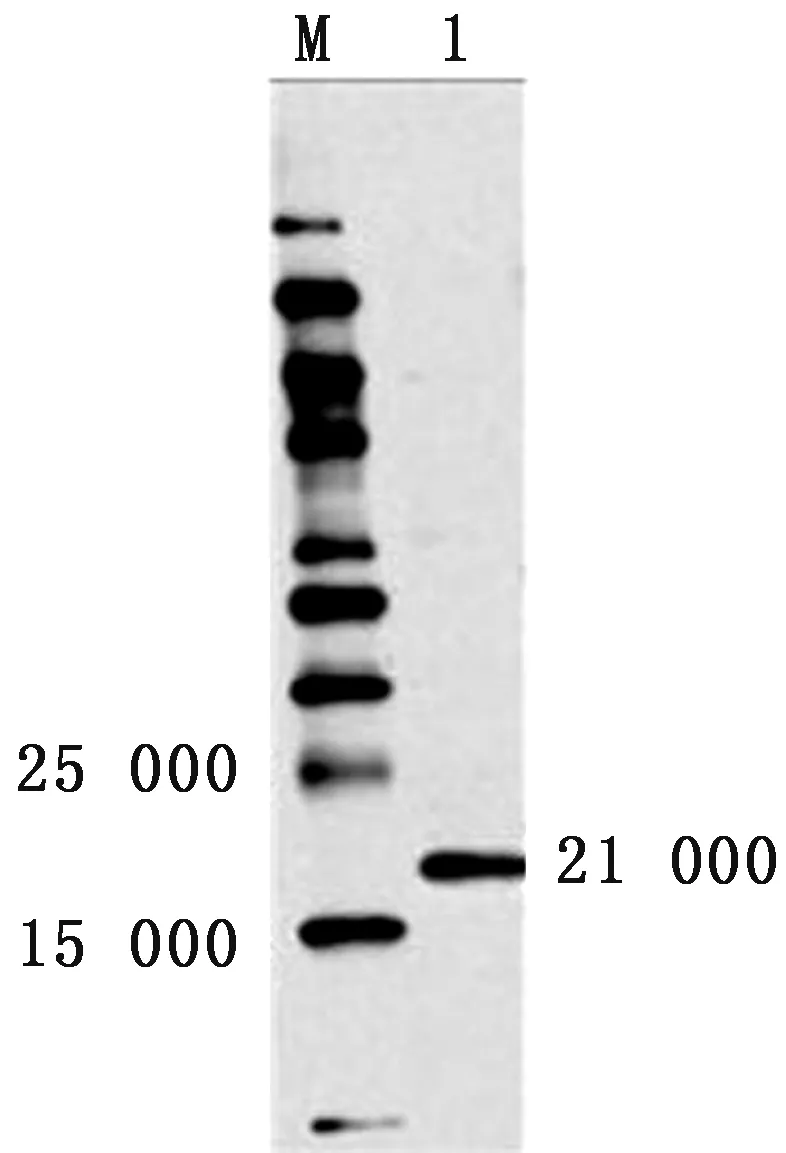
图2 融合蛋白的Western blot分析 M.低分子量蛋白标准;1.融合蛋白表达
2.3 siRNA干扰效果判定数据采用GraphPad软件进行分析处理,结果显示转染siRNA质粒的试验组比对照组LGALS1 mRNA表达水平显著下降(P<0.05),表明siRNA抑制效果明显(图3)。

图3 siRNA干扰LGALS1 mRNA表达的效果 相同小写字母间表示差异不显著(P>0.05),不同小写字母间表示差异显著(P<0.05)
2.4 间接免疫荧光试验结果间接免疫荧光试验结果显示,2个试验组与对照组荧光无明显差异,说明LGALS1对PRRSV在Marc-145中复制无作用(图4)。

图4 间接免疫荧光试验结果 A.加免疫血清48 h;B.转染质粒48 h;C.对照组48 h
2.5 TCID50测定结果siRNA组、免疫血清组与对照组的TCID50差异不显著(P>0.05),表明LGALS1对PRRSV在Marc-145中复制无作用(图5)。

图5 TCID50检测
2.6 实时荧光定量PCR检测结果实时荧光定量PCR检测结果显示,siRNA组、免疫血清组与对照组的PRRSV mRNA含量差异均不显著(P>0.05),说明LGALS1对PRRSV在Marc-145中复制无作用(图6)。

图6 PRRSV mRNA表达
2.7 N蛋白表达水平变化通过Western blot检测N蛋白表达量,发现2个试验组与对照组细胞中病毒N蛋白水平未见明显差异,说明LGALS1对PRRSV在Marc-145中感染增殖无作用(图7)。
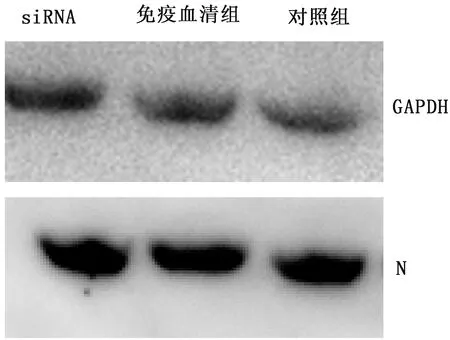
图7 N蛋白表达水平的变化
3 讨论
PRRSV是养猪业最重要的传染病之一,一直是兽医领域研究的重点对象。疫苗虽是控制PRRSV的一种选择,但其效果却并不理想。注射PRRSV灭活疫苗后再对猪只攻毒,仔猪还是会受到感染,且灭活疫苗还存在免疫力产生期较长,免疫剂量大、次数多等缺点。有些国家会使用PRRSV弱毒疫苗,但也存在很多安全问题,比如在对公猪接种后再进行攻毒,会出现精液质量下降并排毒的现象,弱毒疫苗还会感染未接种的母猪并经胎盘感染胎儿,弱毒疫苗存在的毒力返强现象提醒人们必须要对其谨慎使用。近期发展的基因工程亚单位疫苗、重组活载体疫苗等较为理想,但由于PRRSV是单链RNA病毒,基因组突变常常发生,致使经常出现不同的毒株或分离株,这给免疫防治带来了很高的难度。
在本实验室前期研究中,我们通过构建含有PRRSV 2b蛋白的钓饵菌株与猪肺泡巨噬细胞cDNA文库进行酵母双杂交,筛选到了与2b蛋白相互作用的LGALS1,本研究以PRRSV易感细胞Marc-145为研究对象,通过抗体阻断和siRNA法,利用间接免疫荧光、TCID50测定、荧光定量和Western blot来测定病毒的增殖、滴度变化和表达情况,进一步探索LGALS1对PRRSV在Marc-145中复制中的作用。在将纯化的LGALS1蛋白对家兔进行免疫后,获得了高质量的抗体,ELISA效价达到1∶10 000;用Marc-145细胞裂解液为抗原,免疫家兔血清为第1抗体进行Western blot分析,证明了表达的蛋白确为LGALS1蛋白;合成LGALS1 siRNA干扰分子,转染至Marc-145细胞后,利用实时荧光定量PCR技术对LGALS1的表达量进行了检测,证实了所构建的siRNA具有有效的干扰效果;这些都为研究LGALS1对PRRSV在Marc-145中复制的作用奠定了基础。
siRNA技术作为一项全新的基因沉默手段,对基因抑制作用明显,具有高度特异性、高穿透性和级联式放大效应等特点,在动物基因沉默的研究中是一种有效的方法[16]。间接免疫荧光是一种将抗原抗体反应的特异性和敏感性呈现在显微镜下的技术,可显著观察到细胞中病毒的含量及增殖情况[17]。本研究不仅在Marc-145细胞上进行了抗LGALS1血清阻断试验,还设计了LGALS1 siRNA干扰序列,综合探索LGALS对PRRSV在Marc-145感染增殖中的作用,保证了试验的准确性与可信度。分析LGALS1对PRRSV在Marc-145感染增殖中无作用的原因可能为,细胞中存在的其他高水平受体发挥了比LGALS1更加显著的作用。
本课题组在前期的酵母双杂交试验中筛选到的出现机率最高的互作蛋白为LGALS1,但是还发现了其他出现机率相对较低的互作蛋白,我们将继续探索它们在PRRSV入侵易感细胞中发挥的作用。本研究证实了LGALS1在PRRSV感染增殖过程中没有显著的作用,且建立了一套科学有效的探索宿主细胞蛋白在PRRSV感染细胞中所发挥的作用的研究方法,可以为其他研究人员提供经验和参考。相信在大家共同的努力下,我们在PRRSV的防控问题上必将取得良好的对策。

