何首乌饮片颜色-成分-活性快速无损评价
,2,*
(1.广东药科大学中药学院,广东广州 511400;2.国家中医药管理局中药数字化质量评价技术重点研究室,广东广州 511400)
何首乌别名首乌、赤首乌,是蓼科植物何首乌PolygonummultiflorumThunb的干燥块根[1],其药用初载于《开宝本草》,归肝、心、肾经。依据炮制方法的不同,可分为生何首乌和制何首乌,其功效有所不同:生何首乌通便、消痈肿、解疮毒;制何首乌可补肝肾、益精血、乌须发、强筋骨[1]。作为传统的药食两用药材,在卫生部公布的《关于进一步规范保健食品原料管理的通知》中,制何首乌入选《可用于保健食品的物品名单》。何首乌市场发展潜力巨大,有效区分和快速辨别何首乌的生熟及炮制程度,对何首乌进一步开发利用具有指导意义。
用于何首乌质量和炮制程度的评价方法主要有化学成分分析[2-4]、体内外活性研究[5-8]等。常用的分析方法有TLC、HPLC含量测定[9-10]和指纹图谱[11-12]等,均需较繁琐的样品前步骤。近年来,以仿生技术为代表的中药快速分析技术以其操作简便、无损样品以及快速分析等优势得到了快速发展[13]。现代仿生技术主要包括电子鼻、电子舌和电子眼,其中电子眼,即色差计,特别适用于食品[14]和药物[15]在炮制方面的色泽量化。
颜色是区别制何首乌和生何首乌的重要指标,颜色变化能在一定程度上表征饮片中化学成分的转化,测定颜色值可避免化学成分测定受限以及单一成分无法判断药材整体质量的问题。二苯乙烯苷类、蒽醌类、磷脂类、多糖是何首乌中主要化学成分[16-18],在炮制加热过程中,结合蒽醌逐渐转变为游离蒽醌类[19-20],多糖分解成还原糖进而引发美拉德反应(Millard reaction)导致药材颜色变化[21-22];而二苯乙烯苷类等其他成分,与何首乌饮片颜色变化相关性不强,不入选本研究的测定指标。
鉴于目前对何首乌炮制程度的评价缺乏快速直观的标准化检测方法,本文以广东德庆道地产区何首乌为研究对象,采用色差计对何首乌粉末颜色进行客观的量化分析,以何首乌颜色值、游离总多糖和总蒽醌为指标,评价其质量。现代研究表明,肝脏是何首乌的敏感器官,因此本研究还探讨了不同炮制程度何首乌对体外培养的肝细胞增殖的影响。通过何首乌饮片颜色、成分含量及与体外细胞活性的相关性分析,评价何首乌的炮制程度,实现中药何首乌炮制品快速无损评价的客观化和数字化。
1 材料与方法
1.1 材料与仪器
何首乌饮片 购于广东德庆,由广东药科大学李书渊教授鉴定为蓼科植物何首乌(PolygonummultiflorumThunb)干燥块根;D-无水葡萄糖对照品(批号:10833-200503)、1,8-二羟基蒽醌对照品(批号:CHB180224)、醋酸镁 天津市致远化学试剂有限公司;HepG2细胞系 CC0101,购自广州赛库公司,在含有10%胎牛血清的DMEM高糖培养基中,于37 ℃ 5% CO2进行常规培养,实验均在细胞生长对数期进行;DMEM高糖培养基 赛默飞世尔(苏州)仪器有限公司。
MJ-78A全自动高压蒸汽灭菌锅 上海飞迪生物科技公司;SQP十万分之一天平 北京赛多利斯科学仪器有限公司;CR-410色差计 日本柯尼卡美能达公司;UV-2600紫外可见分光光度计 日本岛津公司;ELX800酶标仪 BioTek Instruments。
1.2 实验方法
1.2.1 不同何首乌样品的制备 按2015版《中国药典》[1]通则0213制备何首乌饮片炮制品。取蒸馏水润透何首乌饮片于高压蒸汽灭菌锅内,温度设置为120 ℃,蒸制30 min,压力为0.15 MPa,取出,稍晾,翻拌至汁液吸净,置电热鼓风干燥箱40 ℃干燥10 h。重复蒸制干燥步骤,制备不同炮制次数何首乌饮片,标记为P0~P9(其中P0(Processed zero)表示为何首乌生品,P1表示为炮制一次的何首乌,以此类推)。
精密称取何首乌饮片P0~P9各30 g,以300 mL水煎煮2次,每次1.5 h,滤过,合并滤液,于100 ℃下浓缩至10 mL(原体积的1/60),得1 g/mL(生药浓度)水提液,以硫酸-苯酚显色法测总多糖含量,MTT法测细胞增殖率的影响。
分别精密称取何首乌饮片P0、P3、P6、P9各30 g,以300 mL 95%乙醇回流提取,同法得到醇提液,以醋酸镁甲醇显色法测总蒽醌含量,MTT法测细胞增殖率的影响。
1.2.2 颜色值的测定 取约30 g何首乌样品粉碎,过65目筛得到何首乌细粉。取约2.5 g何首乌细粉于石英样品杯轻轻振摇使分布均匀,以积分球漫反射法重复测量3次,取平均数。色差计测定条件为光源D65,标准观察角2度,照明口径50 mm,分辨分辨率8 cm-1,扫描次数64次,温度(25±2) ℃,相对湿度45%~50%。以颜色明度值L*、红绿色值a*、黄蓝色值b*、总色值E*ab进行色泽量化[23]。
1.2.3 何首乌炮制过程中化学成分的测定
1.2.3.1 总多糖含量的测定 精密称取葡萄糖标准品5.02 mg,加水制成0.01004 mg/mL葡萄糖标准品溶液储备液,备用。取1 mL水提液,稀释,作为何首乌水提供试品溶液,备用。
准确吸取0.1、0.2、0.3、0.4、0.6、0.7、0.8 mL标准品溶液,分别加入纯水至1.0 mL,迅速加入显色剂(1 mL 5%苯酚水溶液和5 mL浓硫酸),60 ℃水浴30 min,冰浴30 min,置于紫外可见分光光度计于486.5 nm处测其吸光度[24]。
精密称取水提液1 mL,按照上述方法显色后,以浓硫酸苯酚溶液为空白对照,用紫外可见分光光度计在486.5 nm下测其吸光度,计算总多糖含量和相对质量分数。
1.2.3.2 游离总蒽醌含量的测定 精密称取1,8-二羟基蒽醌标准品4.36 mg,加0.2%的醋酸镁甲醇溶解制成0.436 mg/mL的1,8-二羟基蒽醌标准品溶液储备液,备用。取1 mL何首乌醇提液,加0.2%醋酸镁甲醇溶液稀释,作为何首乌醇提供试品溶液,备用。
准确吸取1,8-二羟基蒽醌标准溶液0.05、0.10、0.20、0.40、0.50、0.60、0.80 mL分别置于5 mL容量瓶中,加入0.2%醋酸镁甲醇定容摇匀。以0.2%醋酸镁甲醇作为空白对照溶液,在511 nm处测其吸光度[25]。
精密称取何首乌醇提供试品溶液1 mL,按上述方法显色,以醋酸镁溶液为空白对照,置紫外可见分光光度计于511 nm下测定,计算游离总蒽醌含量和相对质量分数。
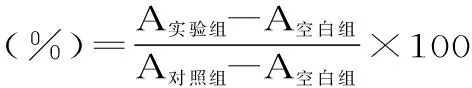
总蒽醌相对质量分数(%)=制何首乌总蒽醌含量/生何首乌总蒽醌含量×100
1.2.4 何首乌提取液对细胞体外增殖活性影响 取1.2.1得到的水提液,分别用DMEM高糖培养基稀释成生药浓度为10、1 mg/mL,用0.22 μm微孔滤器除菌。
将消化下来的细胞按2×105cell/mL接种于96孔培养板,每孔200 μL,每组设5个复孔。培养24 h后,弃去培养基,加入配好的何首乌水提液200 μL,培养24 h后弃去药液,加入5 mg/mL MTT溶液20 μL,孵育4 h,弃去MTT溶液,加DMSO 150 μL震摇15 min,置酶标仪490 nm下测定,计算细胞增殖率,应用GraphPad Prism 5软件进行数据处理。
用DMEM高糖培养基将得到的何首乌醇提液稀释成生药浓度为12.5 mg/mL,用0.22 μm微孔滤器除菌。将消化下来的细胞按2×105cell/mL接种于96孔培养板,每孔200 μL,每组设5个复孔。培养24 h后,弃去培养基,加入配好的何首乌醇提液200 μL,分别培养24、48 h。检测步骤同上所述。
1.3 数据处理
利用SPSS 21.0软件做统计描述和相关性分析,采用GraphPad Prism 5作图,用SIMCA-P 14.0软件进行主成分分析(PCA)、偏最小二乘判别分析(PLS-DA)和偏最小二乘回归分析(PLS)等数据处理分析。
2 结果与分析
2.1 总多糖的线性线性范围及含量测定
以葡萄糖对照溶液浓度为横坐标(c,mg/mL),以吸光度为纵坐标(A),得回归方程为:Y=9.2001X-0.013(R2=0.9994),结果表明,葡萄糖终浓度在0.0014~0.0115 mg/mL范围内呈良好的线性关系。何首乌饮片P0~P9水提液总多糖含量测定结果见表1。炮制会引起何首乌多糖含量的变化:生何首乌多糖含量最低,只有0.343%;在炮制零次~炮制六次期间,多糖含量总体呈现较快的上升趋势,在炮制六次~炮制八次时增长速率达到平台期,此时,多糖含量达到最大,在0.783%~0.792%之间,与生首乌相比,此时多糖含量上升了2.3倍左右。何首乌在第九次炮制时,多糖含量出现下降的情况,这可能是还原糖转化为类黑精或挥发性成分所致[26]。
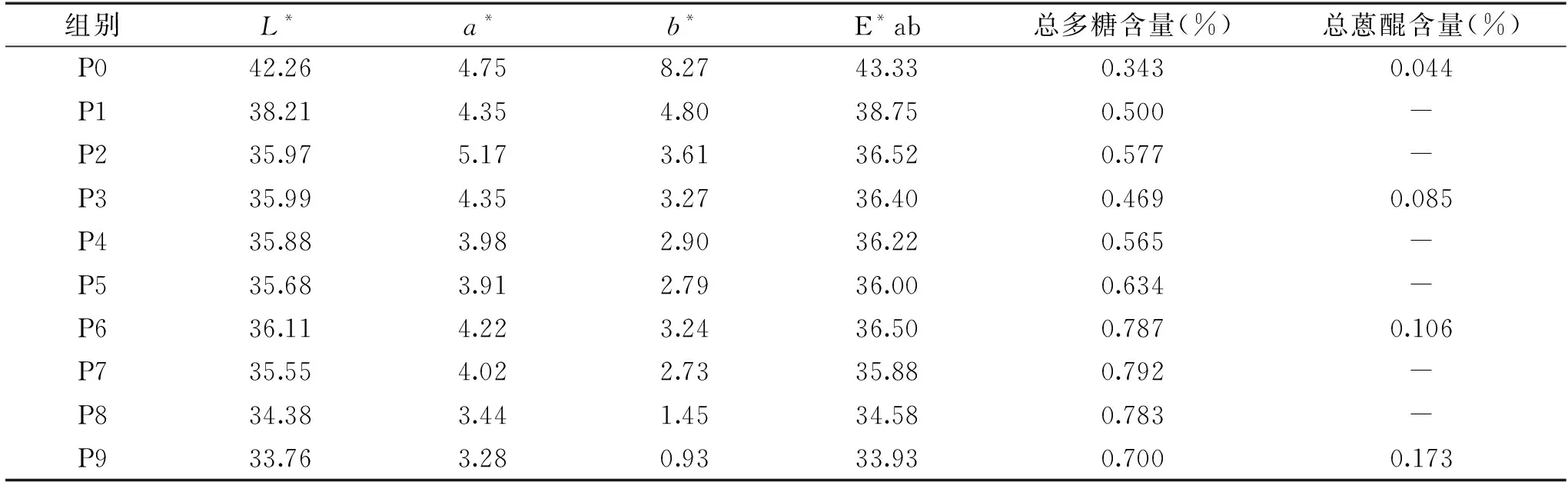
表1 何首乌饮片颜色值及化学成分含量Table 1 Color determination and chemical components contents of Polygonum multiflorum Thunb
2.2 游离总蒽醌的线性线性范围及含量测定
以1,8-二羟基蒽醌对照溶液浓度为横坐标(c,mg/mL),以吸光度为纵坐标(A),得回归方程为:Y=37.305X-0.01(R2=0.9993),结果表明,1,8-二羟基蒽醌在0.0005~0.0174 mg/mL范围内呈良好的线性关系。何首乌饮片P0、P3、P6、P9醇提液总游离蒽醌含量测定结果见表1。炮制也会引起药材总蒽醌含量的变化,蒽醌含量为P9>P6>P3>P0,说明游离蒽醌含量也随着炮制次数的增加而变化(见图1),这可能是由于何首乌在高温炮制过程中结合蒽醌水解成游离蒽醌[27]。
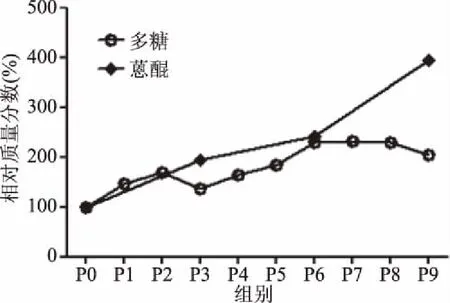
图1 何首乌炮制过程中多糖、总蒽醌含量的相对质量分数Fig.1 Relative content variation of total polysaccharide and total anthraquinone in processing of Polygonum multiflorum Thunb
2.3 样品颜色值测定数据
L*表示明度值,L*值越大越白,反之则越黑;a*表示红绿色值,a*值越大越红,反之则越绿;b*表示黄蓝色值,b*值越大越黄,反之则越蓝[28]。在D65光源下,色差值L*介于33.76~44.26之间,a*介于3.28~4.75之间,b*介于0.93~8.27之间;相较生品,何首乌在高压清蒸炮制过程中,样品色差值L*、a*、b*、E*ab均呈下降趋势,表明何首乌在炮制过程中亮度变暗,偏绿、蓝色泽。何首乌炮制样品较生品颜色深,可能是由于在高压炮制过程中何首乌多糖类成分和氨基酸发生了美拉德反应,使何首乌发生了由黄色转呈黑褐色的非酶促褐变过程[29]。
2.4 何首乌提取液对细胞体外增殖活性影响
水提液对细胞增殖有显著促进作用(图2),醇提液对细胞增殖活性无影响(图3)。何首乌提取液不同浓度、不同作用时间对体外细胞增殖活性结果见表2。
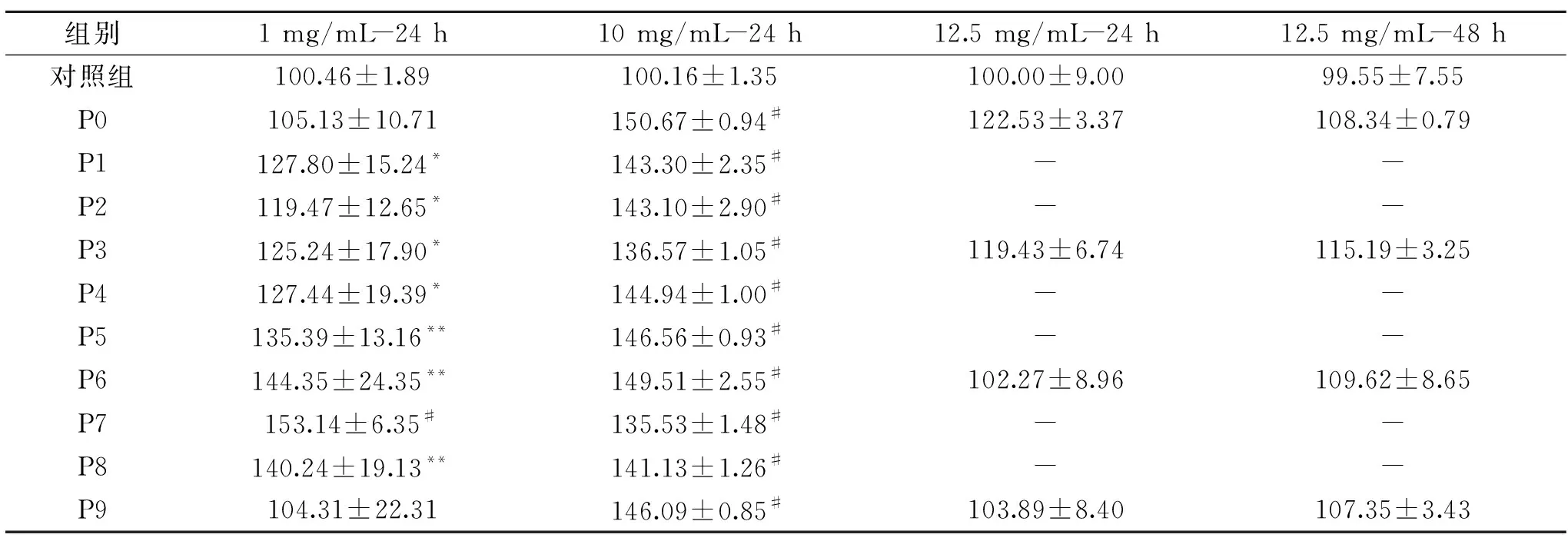
表2 何首乌提取液对细胞增殖的影响(%,n=5)Table 2 Effects of Polygonum multiflorum Thunb extracts on cell proliferation rate(%,n=5)

图2 何首乌水提液对细胞增殖的影响Fig.2 Effects of Polygonum multiflorum Thunb water extract on cell proliferation rate
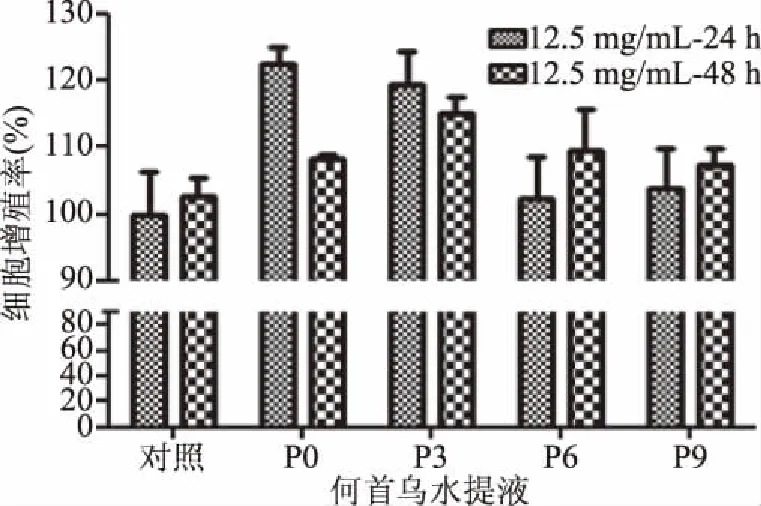
图3 何首乌醇提液对细胞增殖的影响Fig.3 Effects of Polygonum multiflorum Thunb ethanol extract on cell proliferation rate
何首乌水提液对细胞增殖存在显著促进作用(P<0.05),各不同炮制阶段(P7除外)的MTT结果比较发现,高浓度组(10 mg/mL)细胞增殖率高于低浓度组(1 mg/mL)。在低浓度组,炮制的何首乌细胞增殖率增长速度呈先上升再下降的趋势,何首乌在炮制七次时,细胞增殖率最高,达153.14%;在高浓度组,细胞增殖率在135.53%~150.67%之间,均能显著促进细胞增殖,说明何首乌水提液高浓度组体外活性更好。
预实验结果表明,不同浓度何首乌醇提液对细胞体外增殖率在102.27%~122.53%之间,均无显著性影响,故选用较高浓度(12.5 mg/mL)何首乌醇提液分别给药24和48 h检测细胞增殖活性的影响。因此,何首乌醇提液体外活性实验结果不作为活性相关性分析的数据来源。
2.5 何首乌炮制品颜色-成分含量的相关性分析
分别以总多糖、总蒽醌含量为因变量,以色差值L*、a*、b*、E*ab为自变量,利用SPSS 21.0软件进行相关性分析,结果见表3。游离总多糖含量与L*、b*和E*ab值在0.05水平上存在显著的负相关关系,游离总蒽醌含量与色差值a*在0.01水平上存在显著的负相关关系,即在一定程度上,炮制次数越高,色差值越小,何首乌中总多糖和总蒽醌含量越高。对SPSS 21.0软件进行回归分析,得回归方程:Y(总多糖含量)=1.362-0.013L*-0.032a*-0.036b*,可通过何首乌炮制的颜色值快速预测总多糖含量。

表3 化学成分含量与颜色的相关性分析(n=10)Table 3 Pearson correlation analysis of apparent color and chemical components(n=10)
2.6 何首乌炮制品颜色-成分-活性的关联分析
以何首乌游离总多糖含量,色差值L*、a*、b*、E*ab和细胞增殖活性为变量,用Simcap 14.1软件进行主成分分析(PCA),结果见图4。分析结果显示,以颜色值和总多糖为变量时,可将9批不同程度的何首乌炮制饮片分为3组,即炮制一次到炮制三次为一组,炮制四次到炮制五次为一组,炮制六次到炮制九次为一组。以PCA的结果对细胞增殖率建立偏最小二乘法判别分析(PLS-DA)模型(如图5)对何首乌饮片的分组更为细致,可将9批不同程度的何首乌炮制饮片分为5组,从分组可知炮制六次和炮制九次为归为一组,推测可能是炮制到某个程度后,何首乌的量效到达一定阈值,再增加炮制次数并不能提高何首乌饮片多糖含量及体外细胞增殖率,甚至出现下降的趋势,因此可认为何首乌高压清蒸的最佳炮制程度为炮制六次到炮制八次。通过PLS建立了何首乌饮片细胞活性与颜色值、游离总多糖偏最小二乘回归模型:Y=0.434X1-0.239X2+0.317X3+0.235X4(Y为细胞活性,X1~X4分别为色差值L*、色差值a*、色差值b*、游离总多糖含量)。由本模型结合数据分析可知,何首乌饮片炮制一次到炮制八次后其Y值介于14.7~17.2之间,而生何首乌和九次炮制何首乌的Y值分别是19.9、14.3;结合表1、表2数据得,Y值14.7~17.2数据区间何首乌多糖含量较高,细胞活性较好。由此可知,该模型可通过代入何首乌炮制品的颜色值和游离总多糖含量快速预测其细胞增殖活性,评估何首乌的等级。
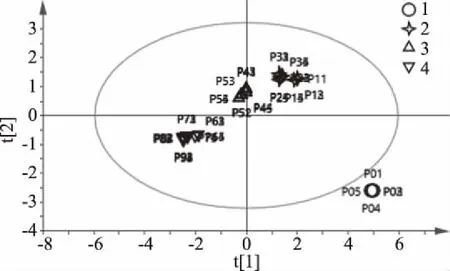
R2×[1]=0.367 R2×[2]=0.106Ellipse:Hotelling’s T2(95%)图4 颜色-游离总多糖PCA分布图Fig.4 Scatter score plot of PCA of color-total polysaccharide-viability
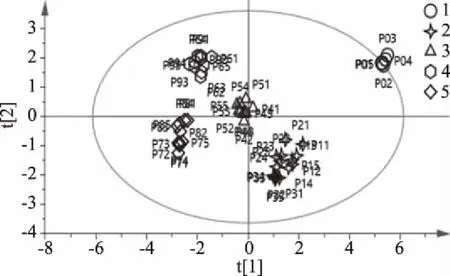
R2×[1]=0.340 R2×[2]=0.122Ellipse:Hotelling’s T2(95%)图5 颜色-游离总多糖-活性PLS-DA分布图Fig.5 Scatter score plot of PLS-DA of color-total polysaccharide-viability
3 讨论
何首乌是我国一种传统常用中药材,也是食疗保健之佳品。何首乌含有15种氨基酸、丰富的无机营养元素、9种维生素和13种苷磷脂等[30],有较高的营养价值。何首乌生熟异用,快速辨别何首乌的炮制程度,对其资源的综合利用、完善质量评价等具有重要意义。
本文应用色差计对不同炮制批次何首乌饮片进行辨色,实现何首乌饮片传统性状的量化描述(L*,a*,b*);采用分光光度法测定何首乌饮片提取液中游离总多糖含量和游离蒽醌含量。对何首乌外观颜色与内在化学成分进行相关性研究,发现色差值L*、b*、E*ab与总多糖含量存在显著的负相关关系,a*与总蒽醌含量存在显著的负相关关系,即随着颜色的加深(总色差值E*ab降低),总多糖呈先明显上升后稳定的趋势,而总蒽醌含量呈上升趋势。对何首乌颜色-总多糖-活性进行PLS-DA分析,结果发现炮制到一定程度后,何首乌饮片六制和九制的颜色-总多糖-活性相重叠,炮制达到第九次时,何首乌饮片的体外活性及化学成分呈现下降趋势,据此推断何首乌高压炮制的最佳次数为六次~八次。
鉴于何首乌炮制品内在质量存在较大差异的现状,本实验基于“表里关联”思路,将何首乌外观颜色与游离总多糖和总蒽醌含量及对细胞增殖作用的强弱相关联,建立PLS偏最小二乘回归模型,对何首乌炮制程度进行分组,为常用中药何首乌快速无损质量评价提供参考,为中药炮制过程监控及质量控制研究提供新思路。

