低分子量酵母甘露聚糖的制备及其抗氧化性研究
赵国群,申崇宇,季小莉,孙 旭
(1.河北科技大学生物科学与工程学院,河北石家庄 050018; 2.沧州医学高等专科学校,河北沧州 061001)
酵母细胞壁约占细胞干重的25%~30%。甘露聚糖位于酵母细胞壁的外层,约占细胞壁干重的40%[1]。酵母甘露聚糖是一种多糖,主链由多个甘露糖分子通过α-1,6-糖苷键连接形成。主链上连接有以α-1,2-糖苷键或α-1,3-糖苷键连接的甘露糖侧链,它通过O-糖肽键和N-糖肽键与蛋白质连在一起[2]。酵母甘露聚糖通常含有5%~20% 蛋白质和80%~90%甘露糖,其相对分子量为20~200 kDa[3]。由于能够增加动物的免疫能力、调节肠道菌群平衡、促进益生菌生长、结合吸附外源性病原菌,因而酵母甘露聚糖已作为饲用添加剂应用于饲料工业[4]。此外,酵母甘露聚糖具有抗肿瘤、抗氧化、抗病毒、降血脂等多种生理功能,是一种极具潜力的功能性食品配料[5-6]。
作为生物高分子化合物,多糖的生理活性,不仅取决于多糖的组成及结构,也与多糖的相对分子量及分布、支化度、链构像等性质密切相关[7]。有研究表明,小分子多糖具有比大分子多糖更强的抗氧化活性[8-9]。国内报道的酵母甘露聚糖的制备方法有酸法[10]、碱法[11]、高温水提法[12]和酶法[13]。采用这些方法制备甘露聚糖时,基本上都忽视了所制备甘露聚糖的分子量问题,而低分子量甘露聚糖以及甘露寡糖的制备尚极少研究。饲料级酵母甘露寡糖(Mannanoligosaccharide)已经在美国实现了工业化生产,但其制备方法及其具体分子量仍处于保密状态[14]。本文首先采用环境友好型高温水提法制备出酵母甘露聚糖,然后探索不同的降解酵母甘露聚糖的方法,并对筛选出的降解方法进行工艺优化,以期为开发低分子量酵母甘露聚糖以及甘露寡糖提供参考。
1 材料与方法
1.1 材料与仪器
酿酒酵母(活性干酵母粉) 安琪酵母股份有限公司;无水乙醇 天津市百世化工有限公司;30% H2O2天津市永大化学试剂开发中心;甘露聚糖酶 南宁庞博生物工程有限公司;葡聚糖标准品(Dextran,1、5、12、25、50、270、410 kDa) 美国Sigma公司;邻二氮菲、邻苯三酚、维生素C 上海阿拉丁生化科技股份有限公司。
SPX-250B-Ⅱ生化培养箱 上海贺德实验设备有限公司;D-1型自动蒸汽灭菌锅 北京发恩科贸有限公司;KQ-800DE超声波清洗器 昆山市超声仪器有限公司;P70D20TL-D4微波炉 广东格兰仕微波生活电器制造有限公司;DZF-6050型真空干燥箱 上海博讯实业有限公司;752型紫外可见分光光度计 上海光谱仪器有限公司;LC1100安捷伦液相色谱仪 安捷伦科技有限公司;Waters 2695 型凝胶渗透色谱系统 美国Waters公司。
1.2 实验方法
1.2.1 酵母甘露聚糖的提取及精制 将活性干酵母粉用去离子水配制成细胞浓度为15%(w/w)的菌悬液,调节菌悬液pH为6.0,于55 ℃恒温水浴锅中自溶40 h,离心收集菌体,并用去离子水洗涤3次。称取自溶后的酵母细胞湿菌体,配制成15%(w/w)的菌悬液,调节菌悬液pH为7.0,于121 ℃蒸汽灭菌锅内高温抽提4 h。高温抽提结束后,离心,获得不完全透明的上清液,即甘露聚糖提取液。采用Sevage法[15]去除甘露聚糖提取液中游离蛋白。将脱蛋白后甘露聚糖提取液真空浓缩至原体积的1/6,向甘露聚糖浓缩液中加入无水乙醇,调乙醇体积分数为90%进行醇沉(4 ℃、10 h),离心,收集沉淀,分别用乙醚、丙酮洗涤,45 ℃真空干燥得甘露聚糖干粉。经过测定,所制备酵母甘露聚糖样品的甘露聚糖含量95.23%、蛋白含量3.56%,其重均分子量为76.52 kDa。
1.2.2 酵母甘露聚糖的微波降解 称取3.0 g酵母甘露聚糖干粉,用去离子水配制成30 g/L甘露聚糖溶液,在微波功率750 W条件下微波加热15 min。
1.2.3 酵母甘露聚糖的超声波降解 称取3.0 g酵母甘露聚糖干粉,用去离子水配制成30 g/L甘露聚糖溶液,在超声功率800 W、超声温度80 ℃条件下超声处理45 min。
1.2.4 酵母甘露聚糖的H2O2氧化降解 称取3.0 g酵母甘露聚糖干粉,用去离子水和30% H2O2配制成H2O2终浓度为5%、糖浓度为30 g/L的甘露聚糖溶液,置于70 ℃水浴中保温1 h。
1.2.5 酵母甘露聚糖的酶法降解 称取3.0 g酵母甘露聚糖干粉,用去离子水配制成30 g/L甘露聚糖溶液,加入0.5 g甘露聚糖酶,调节糖液pH6.0,然后置于60 ℃水浴中保温5 h。
1.2.6 酵母甘露聚糖H2O2降解的单因素实验
1.2.6.1 温度对甘露聚糖降解的影响 称取3.0 g酵母甘露聚糖干粉,用去离子水和30% H2O2配制成H2O2终浓度为5%、糖浓度为30 g/L的甘露聚糖溶液,分别置于40、50、60、70、80、90、100 ℃水浴中保温1 h。
1.2.6.2 H2O2浓度对甘露聚糖降解的影响 称取3.0 g酵母甘露聚糖干粉,用去离子水和30% H2O2配制30 g/L甘露聚糖溶液,其H2O2终浓度分别控制为3%、5%、7%、9%、11%,置于90 ℃水浴中保温1 h。
1.2.6.3 H2O2处理时间对甘露聚糖降解的影响 称取3.0 g酵母甘露聚糖干粉,用去离子水和30% H2O2配制成H2O2终浓度为9%、糖浓度为30 g/L的甘露聚糖溶液,置于90 ℃水浴中分别保温0.5、1.0、1.5、2.0、2.5、3.0 h。
1.2.6.4 糖浓度对甘露聚糖降解的影响 称取3.0 g酵母甘露聚糖干粉,用去离子水和30% H2O2配制成H2O2终浓度为9%、糖浓度分别为20、30、40、50、60 g/L的甘露聚糖溶液,置于90 ℃水浴中保温2.5 h。
1.2.7 酵母甘露聚糖H2O2降解工艺的优化 在单因素实验结果的基础上,采用L9(34)正交实验设计方法,考察了温度、时间、H2O2浓度和甘露聚糖浓度对甘露聚糖降解的影响。正交实验设计因素水平表见表1。
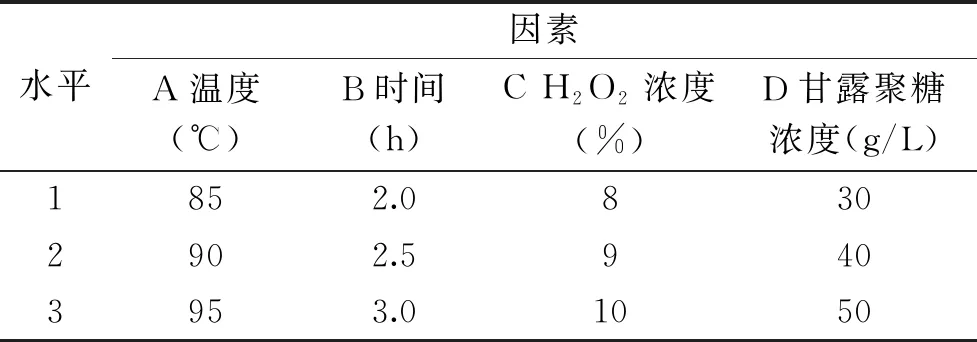
表1 正交实验因素水平设计Table 1 Factors and levels of the orthogonal experiment
1.2.8 甘露聚糖重均分子量(Mw)的测定 采用凝胶渗透色谱法,测定酵母甘露聚糖样品及其降解处理后样品的重均分子量[16]。色谱条件:色谱柱为PL aquagel-OH 8;流动相为超纯水;流速 1.0 mL/min;柱温 30 ℃;进样量 20 μL。以标准葡聚糖分子量的对数lg Mw为纵坐标,保留时间tR为横坐标,绘制“lg Mw-tR”标准曲线,标准曲线方程为:lg Mw=-0.3267tR+8.7935,R2=0.993。
1.2.9 酵母甘露聚糖的体外抗氧化活性
1.2.9.1 羟基自由基清除能力的测定 参照文献[17],配制浓度分别为0.1、0.3、0.5、1.0、1.5、2.0、2.5、3.0、3.5 g/L的酵母甘露聚糖样品溶液。在试管中分别加入1 mL邻二氮菲乙醇溶液(0.75 mmol/L),2 mL磷酸缓冲溶液(0.2 mmol/L,pH7.4),1 mL酵母甘露聚糖水溶液,1 mL硫酸亚铁溶液(0.75 mmol/L),摇匀,最后加入1 mL 0.01% H2O2,37 ℃水浴1 h,于510 nm处测定其吸光值A。以维生素C作为阳性对照。羟基自由基(·OH)清除率计算公式如下:
·OH清除率(%)=(A试样-A1)/(A0-A1)×100
式中:A0为空白的吸光值;A试样为样品的吸光值;A1为背景的吸光值。


式中:A0为空白对照组的吸光值;A1为样品组、阳性对照组的吸光值。
1.3 数据处理
每个试验重复3次,采用SPSS 17.0统计软件对数据进行处理,试验结果以均值±标准偏差(Mean+SD)表示。
2 结果与分析
2.1 不同方法降解甘露聚糖效果的比较
本研究比较了微波降解法、超声波降解法、生物酶法和H2O2降解法四种方法,结果见图1。

图1 不同方法降解酵母甘露聚糖的结果Fig.1 The results of yeast mannan degradation with different methods
从图1可以发现,与未经降解处理的对照相比,微波处理后的甘露聚糖重均分子量几乎没有降低,这表明微波降解法无效。然而,毛江江等[19]研究发现微波处理可以降解壳聚糖;黄永春等[20]报道微波处理可以降解魔芋葡甘聚糖,造成这种现象的原因尚不清楚,可能与酵母甘露聚糖的分子结构有关。采用甘露聚糖酶处理也不能明显降低酵母甘露聚糖重均分子量,其原因是本研究使用的β-甘露聚糖酶,而酵母甘露聚糖的糖苷键是α构型,目前尚未见到商品α-甘露聚糖酶。采用超声波处理后,酵母甘露聚糖的重均分子量由76.52 kDa降低到了70.22 kDa,这说明超声波处理稍有降解酵母甘露聚糖的作用。在所实验的四种方法中,H2O2降解法的效果最好,酵母甘露聚糖的重均分子量由76.52 kDa降低到了56.30 kDa。H2O2氧化降解是一种反应无残毒、无污染、生产成本低、环保清洁的化学降解方法[21]。因此,在后续的研究中采用H2O2降解法。
2.2 酵母甘露聚糖H2O2降解的单因素实验
2.2.1 温度对甘露聚糖降解的影响 温度是多糖H2O2氧化降解工艺中的一个重要因素。如图2所示,在40~90 ℃范围内,随着反应体系温度的升高,酵母甘露聚糖的降解程度快速增加,其重均分子量也快速降低。当温度超过90 ℃时,酵母甘露聚糖的重均分子量几乎不再降低。因此,适宜的反应温度为90 ℃。
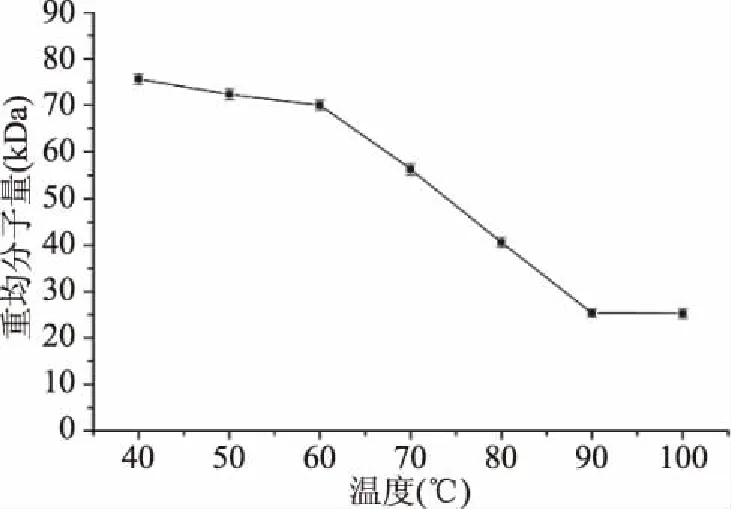
图2 温度对酵母甘露聚糖降解的影响Fig.2 Effect of temperature on yeast mannan degradation

图3 H2O2浓度对酵母甘露聚糖降解的影响Fig.3 Effect of H2O2 concentration on yeast mannan degradation
2.2.3 H2O2处理时间对甘露聚糖降解的影响 如图4所示,当H2O2处理时间在0.5~1.5 h时,随着处理时间的延长,甘露聚糖的重均分子量随之快速降低;当H2O2处理时间为1.5~2.5 h时,甘露聚糖重均分子量缓慢下降;当H2O2处理时间超过2.5 h时,甘露聚糖重均分子量几乎不再下降。因此,适宜的H2O2处理时间为2.5 h。
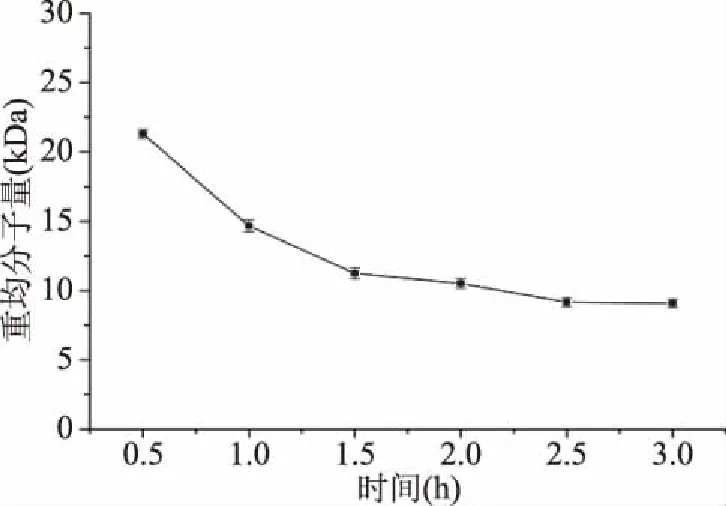
图4 H2O2处理时间对酵母甘露聚糖降解的影响Fig.4 Effect of H2O2 treatment time on yeast mannan degradation

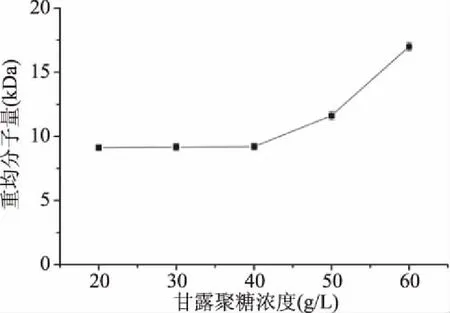
图5 糖浓度对甘露聚糖降解的影响Fig.5 Effect of yeast mannan concentration on its degradation
2.3 酵母甘露聚糖H2O2降解工艺的优化
酵母甘露聚糖H2O2降解工艺的正交优化实验结果见表2。由表2中R值分析,影响酵母甘露聚糖降解的四个R值大小顺序为:RA>RD>RC>RB,即温度的影响最为显著,其次是甘露聚糖浓度,H2O2浓度和反应时间相对较小。依据正交实验结果中K值,确定制备低分子量酵母甘露聚糖的最优工艺组合为:A3B3C3D1,即温度95 ℃、时间3 h、H2O2浓度10%、糖浓度30 g/L。对获得的最优工艺条件进行验证性实验,实验重复三次,重均分子量分别为8.09、8.07、8.06 kDa,平均分子量为8.07 kDa。

表2 正交实验结果Table 2 Results of orthogonal experiment
2.4 低分子量酵母甘露聚糖的体外抗氧化活性
2.4.1 羟基自由基清除能力 羟基自由基一种重要的活性氧,在人体内主要由代谢产生,当体内产生量处于较高水平时,可引起一系列病变[22]。如图6所示,未经降解处理的甘露聚糖(YM,76.52 kDa)、H2O2降解所制备的低分子甘露聚糖(SYM,8.07 kDa)二者的羟基自由基清除率均随着糖浓度的增加而增大,呈浓度依赖型。

图6 酵母甘露聚糖的羟基自由基清除能力Fig.6 The scavenging ability of yeast mannans to hydroxyl radicals
此外,还可发现SYM的·OH清除率明显高于YM。例如,当糖浓度为2.0 g/L时,YM的·OH清除率为45.3%,而SYM的·OH清除率为61.2%,比YM高15.9%。Liu等[8]也发现低分子量灵芝多糖的·OH清除能力强于高分子量的清除能力。尽管SYM具有较好的·OH清除能力,但其·OH清除能力仍明显低于VC。
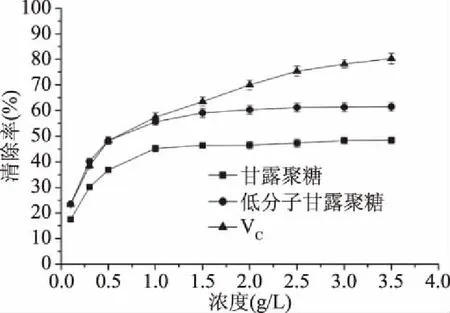
图7 酵母甘露聚糖的超氧阴离子自由基清除能力Fig.7 The scavenging ability of the yeast mannans to superoxide anions
3 结论


