放线菌菌株HJG-5生防剂型的研制及对黄瓜枯萎病的防治效果
李鸿坤,米佳雯,池 明,刘慧芹,王远宏,单慧勇
(1.天津农学院 园艺园林学院,天津 300384;2.天津农学院 技术工程学院,天津 300384)
在现代农业生产中,由于过分追求高产、优质和高效,改变了传统的种植制度,从而导致生态失衡,引发园艺植物土传病害发生加剧[1-2]。黄瓜枯萎病是园艺植物土传病害的重要代表,严重影响黄瓜产量与品质,是导致黄瓜连作障碍的主要因素之一[1]。化学农药是防治土传病害最常用的方法,但是长期使用化学农药导致的环境污染、食品安全、农药残留等问题日益突显。生物防治因其成本低、来源广及对环境友好等特点,成为当前国内外防治植物土传病害的研究热点。筛选和构建具有综合优良性能的拮抗菌株、开展生防菌剂研发已成为植物病害生物防治的重要发展方向[2-3]。
放线菌具有防效好、作用谱广、生物多样性强、产生抗生素种类丰富的特点,已被广泛应用于植物病害防治[4-6]。中国很早就开展了“5406”抗生菌的研究,用来防病、保苗和增产,并得到广泛的应用,以放线菌开发的井冈霉素、多效霉素、农用链霉素等生物农药为农业生产带来巨大的效益[6-8],但大量单一使用抗生素会导致病原物抗性增加,也会对人类造成危害。放线菌的活体制剂能够避免或弱化这些弊端,但放线菌活菌制剂受环境因素影响极大,2000年美国公布的46种生防菌活菌制剂中,只有1种是放线菌,放线菌菌剂的数量非常有限,到目前仍然约有90%的放线菌资源尚未得到有效的开发[9],放线菌活菌制剂的研制仍然是其开发应用中亟待解决的问题 之一。
固体发酵是活菌制剂较为传统的发酵方式,具有生产设备相对简单、生产成本低、产量大及利于保存等特点而受到人们的青睐[10]。放线菌具有一定的耐热和抗干燥特性,经热处理和干燥处理后可大大降低细菌的干扰,获得更多更纯的活菌,适于固体发酵的生产方式。冀媛媛等[11]、梁春浩等[12]、Arora等[13]学者均通过固体发酵提高了放线菌的产量或活性。在发酵生产、制剂加工、储备和实际应用方面,不同的微生物菌剂均有明显差别,但研制的剂型应该能最大限度地发挥生物的功效[11-14]。目前,国内外市场中活菌制剂大多集中在芽孢杆菌中[15],而放线菌则大多集中在抗生素、酶及其代谢物的利用方面[10,16],其活菌制剂的相关研究鲜为报道。内生放线菌HJG-5是一株分离自花椒根部的肉桂栗色链霉菌(Streptomycescinnamocastaneus),对环境适应能力强,有较强的植物根表和根围土壤定殖能力,对多种植物病原真菌具有较强的抑制作用[17],由中国科学院微生物研究所保藏(专利保存号:CGMCC No.14969)。为了进一步提高其发酵效能和挖掘其生防潜力,本试验开展了菌株 HJG-5的固体发酵及菌剂研制,并开展了对黄瓜枯萎病的防效试验,以期为植物病害的田间防治提供理论依据以及菌剂的研制开发提供新的途径。
1 材料与方法
1.1 供试材料
菌株:内生放线菌菌株HJG-5由山西农业大学化保实验室提供,黄瓜枯萎病菌(Fusariumoxysporumsp. cucumebrium)由天津农学院植物病理实验室提供。培养基:马铃薯葡萄糖琼脂培养基:PDA、PDB。黄瓜(CucumissativusL.)品种为‘亮优D18’(天津亿联特科技发展有限公司)。药剂:50%的多菌灵可湿性粉剂(江阴市农药二厂有限公司)、10%苯醚甲环唑水分散粒剂(天津汉邦植物保护剂有限责任公司)。
1.2 种子液制备
从活化好的菌株HJG-5平板上打取2个菌饼(d=5 mm),接种在100 mL PDB培养基中,于28 ℃、180 r/min振荡培养3 d、5 d、7 d后得到不同种子培养液[17],取100 μL涂布在PDA培养基上,测定其活菌数,挑选培养时间最优的种子液进行后续试验。用无菌水将菌液活菌数调至约为106~107cfu/mL[18]。
1.3 菌株 HJG-5的固态发酵条件优化
固态发酵基质的筛选:选取大米粉、玉米粉和小米粉3种基质,分别称取144 g不同基质放入500 mL烧杯中于121 ℃灭菌20 min,等量分装成12小份置于50 mL的灭菌小烧杯中。固体发酵条件:接种量30%,初始含水量达到50%, pH=7,HJG-5种子液与每份固料充分混合,用封口膜封盖,每隔12 h 摇晃1次,置28 ℃恒温培养 7 d,30 ℃烘干后。采用平板菌落计数法,测定不同处理的菌落生长情况[18],下同。每个处理设6次重复。
1.4 碳、氮源筛选
从“1.3”筛选出的最佳基质(大米粉,下同),分别添加葡萄糖、可溶性淀粉、麦芽糖、蔗糖、红糖、乳糖、玉米秸秆、红薯粉和麦麸等碳源及胰蛋白胨、酵母粉、花生粉、黄豆粉、尿素、硫酸铵、硝酸钾、氯化铵、绿豆粉和小米粉等氮源。以不加碳氮源的大米粉为对照。依照10∶1的质量比把基质和各种碳或氮源放置于烧杯中进行混合,121 ℃灭菌20 min,再加入3 mL HJG-5种子液混匀,采用“1.3”方法培养、烘干、稀释、涂布、测定活菌数。设3次重复。
1.5 固态发酵条件优化
通过L16(45)正交表,测定初始pH值(7、 7.5、8、8.5)、接种量(1.0、0.8、0.6、0.4 mg/g)、培养时间(120、144、168、192 h)、碳源(麦芽糖200、150、100、50 mg/g)、氮源(胰蛋白胨100、75、50、25 mg/g)5因素4水平,采用“1.3”处理方法培养并测定固态发酵物的活菌数,设3次重复。
1.6 助剂筛选
将“1.5”中最佳发酵配方所得的固体发酵物在25 ℃鼓风机中干燥,研碎备用。将固态发酵物分别与12种助剂按质量比20∶1分别进行混合,不加助剂为对照。助剂包括:载体(硅藻土、壳聚糖、高岭土、碳酸钙)、分散剂(海藻酸钠、腐植酸钠、糊精、可溶性淀粉)、紫外保护剂(十二烷基硫酸钠、吐温-80、羧甲基纤维素钠、聚四氟乙烯浓缩分散液)。添加载体和分散剂的处理在28 ℃培养箱室温下静置5 d,添加紫外保护剂的处理则在254 nm 紫外灯下距离 40 cm 处照射4 h,在 28 ℃培养箱室温下静置5 d。采用“1.3”方法测定添加助剂后的活菌数。设3次重复。
1.7 粉剂及颗粒剂的制备
参考“1.6”测定的结果,选取壳聚糖、糊精、聚四氟乙烯浓缩分散液3种助剂。采用L9(33)正交试验测定3种助剂3个水平(100、50、20 mg/g)下的活菌数。3种助剂分别与HJG-5固态发酵物充分混匀,烘干后用小型粉碎机磨成菌粉,在28 ℃培养箱室温下静置5 d。采用“1.3”处理方法测定活菌数。3次重复。根据正交试验结果选出的最优组合,按照其配方将固体发酵物与3种助剂混匀、烘干、磨碎后制成粉剂。
将10 mg/g的海藻酸钠以及上述粉剂按质量比4∶3进行混合,再滴入0.028 g/mL的氯化钙,成粒后沥水,室温中自然风干,制成颗粒剂。
1.8 菌剂对枯萎病的温室防效
试验地选择在天津农学院小枣园。于2019-06-26进行黄瓜催芽试验,3 d后选择露白种子种植在花盆中(d=10 cm)。试验共设5个处理。于7月7日将粉剂、颗粒剂采用拌土处理,分别与营养土混匀(质量比1∶100);发酵种子液与营养土混匀(体积与质量比为1 mL∶50 g);用50%的多菌灵可湿性粉剂稀释500倍液和10%苯醚甲环唑水分散粒剂稀释1 500倍液进行灌根。另设清水对照。于7月17日在幼苗的根茎基部用一次性注射器针头轻微刺伤3处,采用灌根法,分别接种10 mL 1×108cfu/mL的枯萎病菌。每处理重复3次,每次重复为20株。接种7 d、14 d和28 d后,记录植株发病情况。按沈萍等[18]方法划分病情级数。病情指数=∑(病级×该病级株数)/(调查总株数×最高病级)×100;防治效果=(对照病情指数-处理病情指数)/对照病情指 数×100%。
1.9 数据分析
运用SPSS 17.0统计软件对试验数据进行分析,采用Duncan’s新复极差法做差异显著性检验。
2 结果与分析
2.1 菌株HJG-5种子液及固态发酵基质的筛选
不同培养时间下种子液中的活菌数呈极显著差异(P<0.01)。培养7 d时种子液的活菌数最多,达1.263×107cfu/mL,明显高于3 d (2.56×103cfu/mL)和5 d(7.18×104cfu/mL)种子液的活菌数。3种发酵基质对菌株HJG-5产孢量也存在极显著差异(P<0.01),活菌数分别为:大米粉1.665×108cfu/g,小米粉1.467×108cfu/g,玉米粉1.270×108cfu/g。可见,大米粉处理下的活菌数优于小米粉和玉米粉,后续试验将菌株 HJG-5固态发酵基质选定为大米粉。
2.2 菌株HJG-5碳源和氮源的筛选
不同碳源和氮源均影响菌株 HJG-5的活菌数(表1)。麦芽糖为碳源时,其活菌数为 16.27×108cfu/g,显著优于其他碳源,而蔗糖效果最差,活菌数只有5.8×108cfu/g,甚至低于对照。将麦芽糖选定为最终碳源;在有机氮源中,胰蛋白胨处理组的活菌数最多,达6.77×109cfu/g,显著高于其他处理,将胰蛋白胨选定为最终氮源。
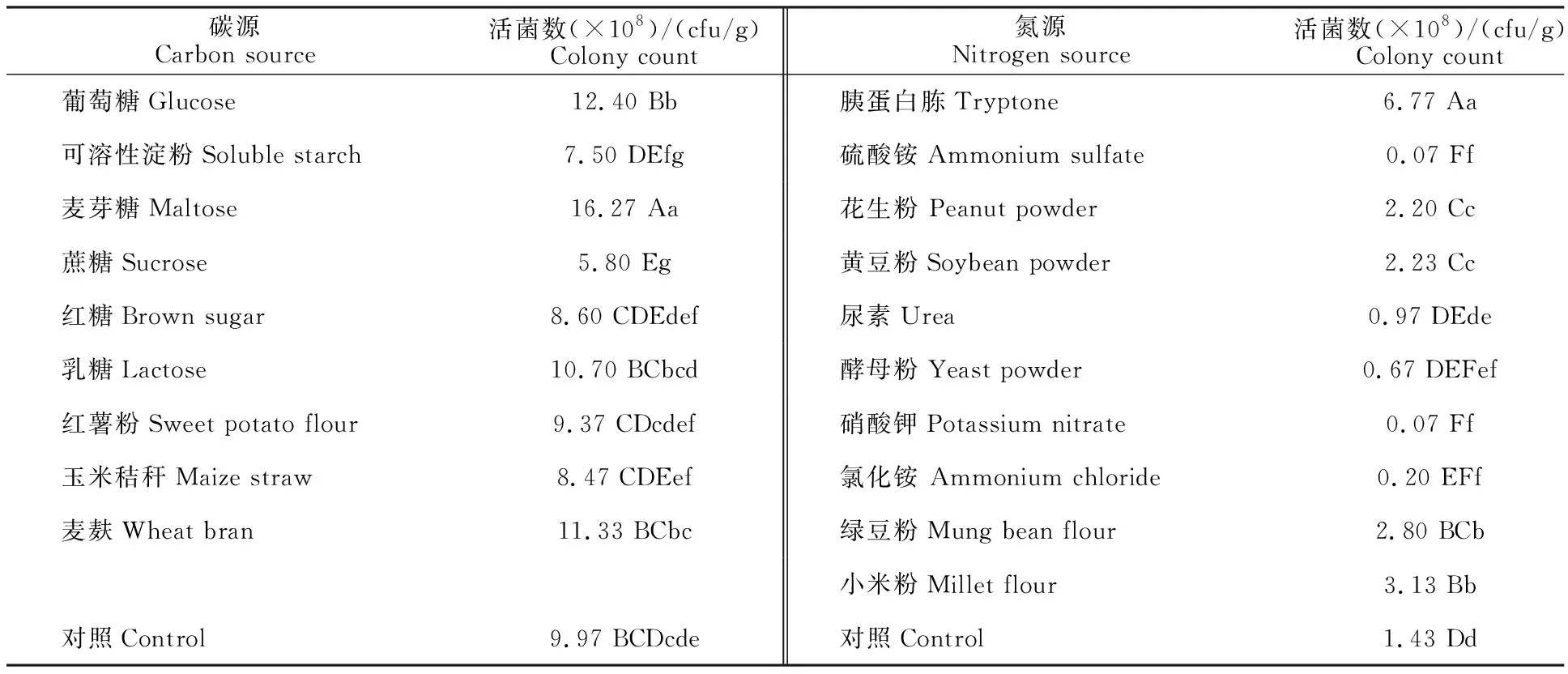
表1 不同碳源和氮源下菌株HJG-5的活菌数Table 1 Colony count of strain HJG-5 under different carbon and nitrogen sources
2.3 菌株HJG-5固态发酵条件的优化
菌株HJG-5固态发酵的正交统计结果如表2所示。在试验的 5个不同因素中,根据直观分析极差R值和F测验结果可知:氮源(胰蛋白胨)(43.50)>初始pH(30.66)>碳源(麦芽糖) (25.84)>培养时间(24.00)>接种量(11.83)。氮源对活菌数的影响最大,而接种量值影响最小。5个因素主效应中,只有接种量的4个水平之间差异不显著,其他4个因素差异均显著。处理组合1和组合6的活菌数最大,但二者之间差异不显著,组合6的活菌数极显著高于其他处理组合,该组合为麦芽糖50 mg/g,胰蛋白胨50 mg/g,接种量0.8 mL/g,培养时间120 h,pH 7.5。直观分析最佳发酵条件应为:麦芽糖50 mg/g,胰蛋白胨50 mg/g,接种量0.8 mL/g,培养时间120 h,pH 7.0。二者只有pH不同,分别为7.5与7.0,但差异不显著。因此本试验采用了组合6作为固态发酵条件。
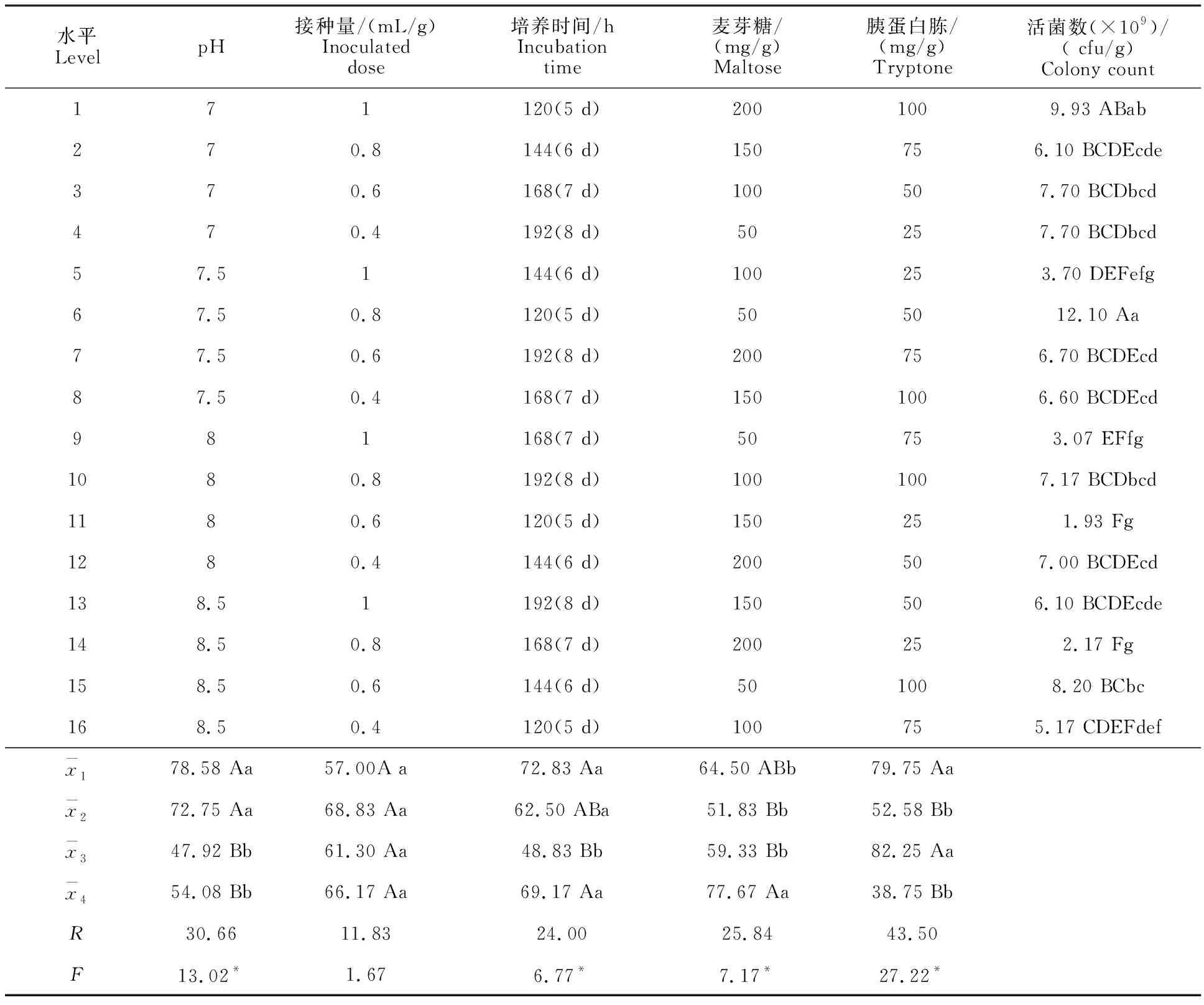
表2 菌株HJG-5固态发酵的正交试验结果 Table 2 Orthogonal test of solid-state fermentation of strain HJG-5
2.4 助剂的筛选及其优化配比
不同助剂对HJG-5原粉活菌数的影响如表3所示。不同的载体、保护剂、分散剂处理后均会改变原粉的活菌数。在载体中,高岭土效果最佳,活菌数达1.66×1010cfu/g;保护剂中海藻酸钠效果最佳,活菌数达1.67×1010cfu/g;分散剂中羧甲基纤维素钠效果最佳,活菌数达1.35×1010cfu/g;而原粉对照活菌数为1.05×1010cfu/g(固态正交发酵组合6活菌数为12.10×109cfu/g)。3种助剂均能极显著提高原粉的活菌数(P< 0.01)。选择这3种助剂开展优化配比的正交 试验。
HJG-5原粉助剂优化配比的正交统计结果如表4所示。根据直观分析极差R值和F测验结果可知:高岭土(67.67)>羧甲基纤维素钠 (21.78)>海藻酸钠(14.33),高岭土(载体)对活菌数的影响最大,海藻酸钠(保护剂)最小。直观分析与多重比较结果一致,均以组合3为最佳配比,即高岭土100 mg/g,羧甲基纤维素钠20 mg/g,羧甲基纤维素钠20 mg/g,HJG-5粉剂活菌数达到1.74×1010cfu/g。主效应中,高岭土和羧甲基纤维素钠的3个水平之间差异显著,而海藻酸钠的差异不显著。采用组合3做为粉剂及颗粒剂制备的助剂配方。

表3 不同助剂下HJG-5原粉活菌数Table 3 Viable count of GSH-5 raw powder under different adjuvants

表4 助剂优化配比的正交试验Table 4 Orthogonal test of optimum proportion of adjuvant
2.5 不同剂型对黄瓜枯萎病的防治效果
菌剂对黄瓜枯萎病的防治效果如表5所示。7 d时,HJG-5发酵液、粉剂、颗粒剂防效均超过60%,均高于多菌灵的58.62%。其中粉剂效果最佳,达68.97%,显著高于多菌灵的(P<0.05),但三者防效又均显著低于苯醚甲环唑的(P< 0.05)。14 d时,发酵液的防效下降较明显,粉剂和颗粒剂的防效仍保持在60%以上,显著高于发酵液和多菌灵的(P<0.05),但仍显著低于苯醚甲环唑的(P<0.05)。28 d时,HJG-5发酵液、粉剂、颗粒剂防效均有所下降,但仍高于多菌灵的,且颗粒剂显著高于发酵液的(P<0.05)。在28 d的防治期内,苯醚甲环唑的防效一直在80%以上,而生防菌剂的防效均高于多菌灵的,且总体上粉剂与颗粒剂的防效又高于发酵液的。
3 讨 论
生防菌的菌体存活力是决定其最终防效的因素之一。菌株在培养中所涉及到的营养成分、培养条件决定了菌株产生活性物质的种类和产量[12]。本试验确定了菌株HJG-5的最佳固体发酵基质为大米粉,这与冀媛媛等[11]对放线菌 SC1-1菌剂研制中所得结果一致。大米粉有利于发酵基质的松散,便于菌体的呼吸,且成本较低,是许多菌株发酵所选的重要基质。但不同的放线菌对淀粉性基质的选择具有多样化,如王婷婷等[8]认为放线菌WZ60最优基质是黄豆粉;梁春浩等[12]认为放线菌PY-1最优基质是玉米粉;王彦等[19]认为放线菌16-3-10最优基质是小米粉。总之,优化培养基和培养条件可获得最佳的生产效率和经济效益。

表5 HJG-5不同制剂对枯萎病的田间防效Table 5 Field control effect of different agents of HJG-5 against Fusarium wilt
在实际生产过程中,除发酵条件外仍有众多因素影响影响生防菌剂的效果,选择适合的载体和助剂是衡量生物农药最佳配方的首要因素[15]。助剂不仅可以增加生物菌剂的活性或保存期,而且可以加强宿主植物机体的抵抗能力,提高体内某些酶的活性,也能够帮助宿主植物吸收氮、磷、钾等元素,提高其对环境的适应能力[20]。在本研究的助剂正交试验中,HJG-5粉剂的活菌数超过1.74×1010cfu/g,即活菌数每克超过100亿。这与冀媛媛等[11]对放线菌SC1-1粉剂助剂的筛选研究其活菌数量达到1.72×1010cfu/g的结果 相近。
菌株HJG-5对黄瓜枯萎病的防效均高于常见药剂多菌灵,但又显著低于新型药剂苯醚甲环唑。从HJG-5不同剂型的防效上看,发酵液是低于制剂的,可能是其原本活菌数较低的缘故。粉剂早期效果好于颗粒剂,但后期颗粒剂效果更好,这与剂型的物理化学性质及稳定性密切相关。将生防菌制备成颗粒剂后,由于其形态较为固定,可以缓慢释放,持效期长,甚至雨水能够充当其与土壤以及寄主生物相融合反应的媒介[15,21]。粉剂与土壤的表面接触面积更大,但是其因释放过快,效果不能持久,反而会减缓防病效果。因此,颗粒剂作为一个缓慢释放生物拮抗菌的剂型,尽管其在初期的效果可能不如粉剂与发酵液,但由于其持效期长,对所含生防菌的利用度高,且不低于常规药剂的防效,因而更适宜用于植物土传病害的防治,目前颗粒剂已成为代表省力化剂型开发的新热点[22-23]。在田间使用菌株HJG-5粉剂和颗粒剂时,建议间隔期不超过14 d,应重复使用,在田间会有更突出和更持久的效果。

