太湖蓝藻碎屑对水质及附着藻和水丝蚓生物量的影响*
夏曼莉,于谨磊,何 虎,关保华,3,陈非洲,3,刘正文,3
(1:暨南大学生态学系水生生物研究所,广州 510632)
(2:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)
(3:中国科学院大学中丹科研教育中心,北京 100049)
富营养化是现今各国面临的主要水环境问题,其中蓝藻水华暴发是全球富营养化水体最常见的现象之一. 外源污染物输入和内源营养盐释放将直接导致水体营养盐浓度升高,促进浮游植物的生长繁殖. 由于蓝藻自身的生理特征,如具有伪空胞(gas vesicle)、能够抵抗高光强和紫外线的干扰等[1-3],常在富营养化水体中发展为浮游植物的优势类群. 蓝藻水华形成后,有害藻类能够释放藻毒素,影响水生生物和人类的健康[4-5]. 蓝藻水华消亡后,将形成大量的蓝藻碎屑,其腐烂分解后将向水体释放氮、磷等营养盐[6-8],增加水体的氮、磷负荷,刺激浮游植物生长. 此外,蓝藻碎屑还可作为水生生物的食物来源[9-10],其对水生生物生物量的影响还尚不清楚. 因此,蓝藻碎屑可从多个方面影响湖泊生态系统的结构与功能.
有关蓝藻碎屑对水域生态系统的影响研究,多关注其对水体水质的影响[11-12],近年来也有学者通过野外调查或历史数据分析等手段探讨蓝藻水华对水生生物的影响[13-14]. 而通过模拟试验探究蓝藻碎屑对水生生物影响的研究相对较少,大多针对单一物种进行[6,15-18]. 本试验从探究蓝藻水华在水体中的影响出发,通过向中宇宙受控系统添加微囊藻碎屑,分析其对水体营养盐和水域生态系统中不同的生物类群生物量(浮游植物、附着藻类、水丝蚓)的影响. 研究结果将为进一步研究蓝藻水华对水生生态系统的影响提供参考,同时为富营养化湖泊管理提供理论依据.
1 材料与方法
1.1 试验设置
微囊藻碎屑制备: 在夏季(8月),用孔径为64 μm的浮游生物网在太湖梅梁湾采集足量的新鲜微囊藻(实验室镜检发现以铜绿微囊藻为主,占总体积的99%): 在实验室,用蒸馏水洗涤采集的新鲜微囊藻并去除藻液中的杂质,随后将微囊藻置于60℃ 烘箱烘至恒重. 最后,用研钵将烘干的微囊藻碎屑研磨成粉,经300 μm筛网过滤后,置于干燥器内备用. 此外,在微囊藻放入烘箱前,我们取样测定了微囊藻单位湿重生物量的叶绿素含量,结合微囊藻藻浆含水率,计算得出1 g(DW)微囊藻碎屑相当于50 μg/L的新鲜微囊藻叶绿素a浓度.
中宇宙试验系统构建: 本试验在位于梅梁湾的湖泊生态系统实验站进行. 为研究微囊藻碎屑对水质及水生生物生物量的影响随时间的变化过程,本试验共设置24个由高密度聚乙烯塑料桶组成的中宇宙试验系统(容积: 130 L; 高: 66 cm;上口直径: 56 cm; 底部直径: 45 cm): 每个试验系统内加入15 cm混匀的太湖梅梁湾沉积物(采自离岸200 m的表层20 cm沉积物,经孔径为0.5 cm的筛网过滤)和90 L经64 μm浮游生物网过滤的湖水. 试验系统置于梅梁湾岸边的水泥池中(规格: 6 m×5 m×2 m),固定试验桶并使其漂浮于池塘水面(图1).
为使试验系统尽可能地接近梅梁湾生态系统,试验开始前,参考太湖现存底栖动物生物量[19-21],向每个中宇宙试验系统加入了河蚬Corbiculafluminea(总数量为3~4个,平均总重量为12 g)、铜锈环棱螺Bellamyaaeruginosa(总数量为6~7个,平均总重量为10 g)、椭圆萝卜螺Radixswinhoei(总数量为4个,平均总重量为1.1 g)、扭蚌Arconaialanceolata(总数量为1~2个,平均总重量为18.6 g)、背角无齿蚌Anodontawoodiana(总数量为1个,平均总重量为26.9 g)和圆顶珠蚌Uniodouglasiae(总数量为1~2个,平均总重量为26.8 g),而水丝蚓则由加入系统中的沉积物孵化而来.
本试验在8-9月份进行,试验期间平均水温为30℃,该试验共持续28天. 试验开始前,系统经过1个月的稳定沉降,试验桶内水体水质指标相对稳定且无显著差异; 总氮(TN)浓度为1.17±0.37 mg/L、总磷(TP)浓度为0.051±0.012 mg/L、叶绿素a(Chl.a)浓度为25.37±4.15 μg/L. 试验开始时,向21个试验系统中添加7 g微囊藻碎屑(相当于新鲜微囊藻Chl.a浓度为350 μg/L),其模拟的蓝藻水华Chl.a浓度在蓝藻水华大面积暴发时的Chl.a浓度范围之间(78.3~978.5 μg/L)[22]; 剩余3个试验系统不添加微囊藻碎屑,作为本试验的初始值(对照组).
1.2 样品采集与分析
在试验开始的第0、1、3、5、9、14、20和28天进行采样. 第0天采集的样品作为试验本底值,随后每次采样,随机采集剩余试验系统中3个桶中的上覆水样、底栖动物和附着藻类. 为了更精确地计算筒壁附着藻类生物量和水丝蚓生物量,每次采样均采取破坏性采样的方式,即采样结束后,试验桶将被清空.
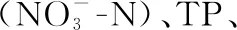
水丝蚓和附着藻类样品在试验系统中的水被虹吸完毕后进行. 水丝蚓样品采集时,用60目尼龙筛网过滤系统内的所有沉积物,在实验室内挑取水丝蚓,用蒸馏水冲洗后置于60℃烘箱中烘至恒重,计算其生物量. 试验系统内壁表面附着藻类采集时,将桶壁附着藻用刷子刷入烧杯中,在实验室用GF/C膜抽滤混匀后的附着藻液,然后将膜置于60℃烘箱中烘至恒重,称量并计算其生物量.
1.3 数据分析
本研究的所有数据统计分析均在SPSS 20.0软件中进行. 采用t检验比较微囊藻碎屑加入后,每次采样中不同形态营养盐、Chl.a、附着藻类生物量和水丝蚓生物量与对照组(第0天的数据)间的差异,从而分析各采样时间点样品与初始样品的差异.
2 结果
2.1 微囊藻碎屑对水体营养盐的影响
2.1.1 水体不同形态氮浓度的变化过程 微囊藻碎屑加入后,水体的TN浓度变化明显. TN浓度在碎屑加入后第1天即迅速上升,平均浓度从初始的1.0 mg/L上升至3.5 mg/L(图2A). 随后,TN浓度略有下降,但第3天(t=4.30,P=0.012)和第5天(t=4.30,P=0.009)的浓度仍显著高于初始浓度(图2A). 随后,TN浓度继续上升,直至第14天时达到最高值,并在剩余的试验期内维持在较高的浓度水平(3.3~3.9 mg/L)(图2A).
图2 微囊藻碎屑加入后水体TN、TDN、NH3-N和浓度的变化趋势(图中实心符号表示该值与对照组(第0天)存在显著性差异)
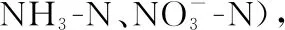
2.1.2 水体不同形态磷浓度的变化过程 微囊藻碎屑加入后,水体TP浓度的变化呈明显的双峰曲线(图3A): TP浓度在碎屑加入后第1天平均浓度达到0.30 mg/L,然后TP浓度逐渐下降,在试验第5天时降至0.19 mg/L,显著高于初始浓度(t=2.78,P=0.005). 随后,TP浓度再次升高,第14天达到最高值,平均浓度为0.36 mg/L. 试验结束时TP平均浓度降至0.12 mg/L (图3A). 试验前20天,TDP、SRP与TP浓度的变化趋势基本一致,在试验前3天浓度显著升高,试验第5天浓度降低至初始水平,试验第5天后浓度继续上升,呈现双峰曲线(图3B、C). 在试验结束时,与对照组(第0天)相比,TP(t=2.78,P=0.023)、TDP(t=2.78,P=0.008)仍显著高于初始值,SRP浓度与初始值均无显著性差异(t=2.78,P=0.123)(图3C).
图3 微囊藻碎屑加入后水体TP、TDP和SRP浓度的变化趋势(图中实心符号表示该值与对照组(第0天)存在显著性差异)
2.2 微囊藻碎屑对水生生物生物量的影响
2.2.1 浮游植物生物量变化过程 试验开始阶段(第0~3天),浮游植物生物量(叶绿素a浓度)未发生显著变化(P> 0. 05)(图4): 随着氮、磷营养盐浓度的快速升高,水体Chl.a浓度也迅速上升,平均浓度在第5天时达到50.4 μg/L,为初始值的2倍. 试验第9天时,Chl.a平均浓度达到试验期间的最高值,为56.0 μg/L. 随后,Chl.a浓度开始逐渐下降,平均浓度在试验第14天降至27.8 μg/L,在第20天出现小幅回升后继续下降. 到试验结束时,Chl.a浓度与初始值无显著性差异(t=2.776,P=0.51),浓度为23.6 μg/L (图4).
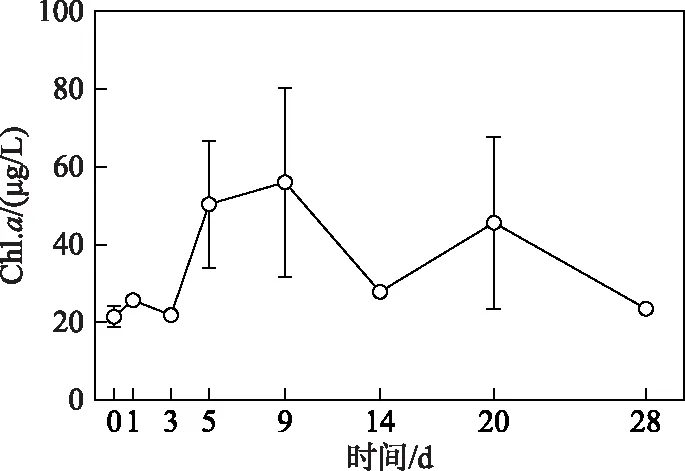
图4 微囊藻碎屑加入后浮游植物生物量(Chl.a浓度)的变化趋势
2.2.2 附着藻类生物量变化过程 微囊藻碎屑加入后的第1、3和5天,附着藻生物量与第0天无显著性差异(图5),其平均生物量在试验第3天降至5.3 g(DW)/m2,第5天重新升至7.9 g(DW)/m2. 随后,附着藻生物量一直呈下降趋势,从试验开始的第20天开始直至结束,附着藻生物量均显著低于第0天的生物量(P< 0.05)(图5).
2.2.3 水丝蚓生物量变化过程 微囊藻碎屑加入后,水丝蚓生物量在试验开始的前14天内变化相对稳定,均与第0天的生物量无显著性差异(P> 0.05)(图6). 而在第20天时,水丝蚓生物量达到本试验的最高值,显著高于初始值(t=4.30,P=0.05),平均为1.15 g(DW)/m2. 试验结束时,水丝蚓生物量下降到 0.37 g(DW)/m2,显著高于试验开始(对照组,第0天)时的生物量(t=2.78,P=0.029).
3 讨论
本研究通过中宇宙试验,探讨微囊藻碎屑对水质及浮游植物、附着藻类和水丝蚓生物量的影响. 微囊藻碎屑加入系统后,水体营养盐在短时间内(第1天)显著上升; 浮游植物(Chl.a)、底栖动物和附着藻类生物量也随之发生显著变化. 因此,微囊藻碎屑在腐烂分解过程中,不但影响水质,而且还直接影响水生生物生物量.
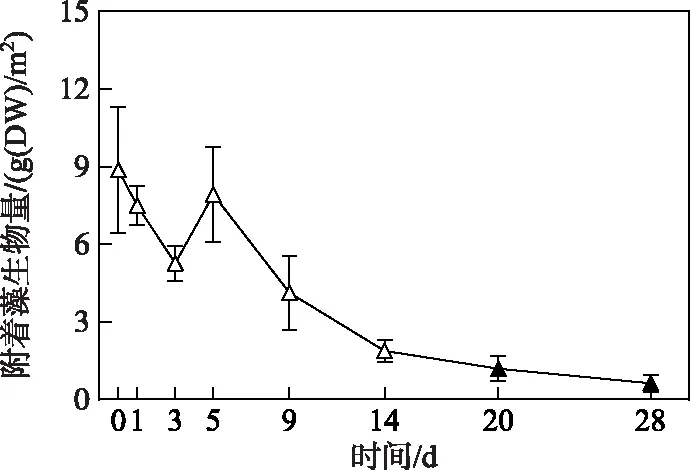
图5 附着藻类生物量的变化趋势(图中实心符号表示该值与对照组(第0天)存在显著性差异)
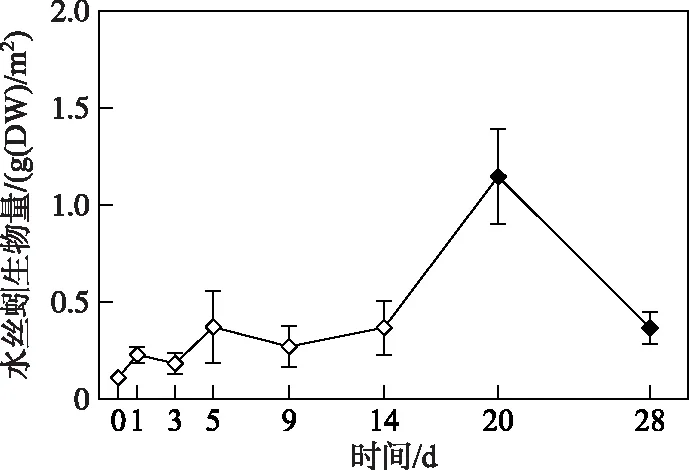
图6 微囊藻碎屑加入后水丝蚓生物量的变化趋势(图中实心符号表示该值与对照组(第0天)存在显著性差异)
已有研究多通过野外调查或历史数据分析的方式研究微囊藻水华对水生生物群落的影响[13-16],即在太湖或巢湖等富营养化较为严重的湖区,微囊藻水华暴发频繁,耐污种(例如水丝蚓)的生物量高于富营养化较轻的湖区. 本研究结果直接证实了微囊藻碎屑对浮游植物生物量和水丝蚓生物量增加的促进作用,这与已有的研究结果一致[9,24]. 水丝蚓是淡水生态系统中常见的底栖动物,生活在底泥表层,以有机颗粒为食. 龚志军等[25]、李艳等[26]的野外调查发现: 水丝蚓密度随湖泊富营养化程度增加而上升,水丝蚓密度的增加与水体营养盐和沉积物有机质含量有关. 而微囊藻碎屑在分解过程中,不仅增加了水体营养盐浓度,而且分解较慢或全分解的残渣,会以有机颗粒的形式沉降到底泥表面,增加了沉积物表面有机质含量,为水丝蚓提供有利的生长环境. 此外,姚思鹏等[9]和Yu等[10]的研究认为水丝蚓可直接利用微囊藻碎屑作为食物. 本试验系统内水丝蚓孵化于太湖梅梁湾的沉积物,而梅梁湾是太湖富营养化最严重的区域之一,频繁暴发蓝藻水华,由于水丝蚓对环境的长期适应,早已形成了稳定的摄食习性,并且姚思鹏等[9]的同位素试验结果表明,在栅藻和微囊藻同时存在的情况下,水丝蚓仅摄食微囊藻,说明水丝蚓对微囊藻碎屑具有一定的摄食偏向. 这就不难解释本试验组微囊藻碎屑加入后,水丝蚓的生物量逐渐增加. 而水丝蚓生物量呈先升后降的变化趋势,与水丝蚓的生活史特征有关. Kennedy[27]发现霍甫水丝蚓(Limnodrilushoffmeister)的繁殖周期为2~3周,而且大多数个体在繁殖后死亡,只有少数个体存活并再次繁殖. 因此,在本研究中,第28天的水丝蚓生物量下降可能与其繁殖后出现大量个体死亡有关.
微囊藻水华暴发后期,大量的微囊藻碎屑腐烂分解,最直接的影响是增加水体的营养盐负荷,微囊藻碎屑能向水体释放大量的营养盐[11]. 本研究结果同样发现,在微囊藻碎屑加入系统后,水体氮、磷浓度迅速升高(图2,图3),其中主要以溶解态形式存在,这将成为水生生物的重要营养来源[9],直接导致本研究中浮游植物生物量的急剧上升. 另外,TN和TDN浓度持续较高,试验期间始终显著高于初始浓度,并且较磷营养盐的持续时间长. 而磷营养盐在试验期间,呈现先升后降最后继续升高的趋势,与磷的地球化学性质分不开. 微囊藻碎屑分解释放大量的磷,使得磷营养盐在试验第1天显著升高,之后由于磷营养盐的沉降作用,出现下降的趋势,在试验第14天,磷营养盐再一次达到峰值,由于浮游植物和附着藻类在第14天生物量呈下降趋势,减少了对系统内磷的吸收; 另外消亡的浮游植物和附着藻细胞腐烂分解,将释放营养盐,引起水体磷浓度的再次上升. 微囊藻碎屑的加入,使得系统内氮、磷营养盐浓度显著上升. 因此,在微囊藻碎屑分解的环境下,条件合适时,有引发微囊藻水华再次暴发的风险. 本研究也发现在微囊藻碎屑加入系统以后,在试验开始的第9天,平均水体Chl.a浓度高达56 μg/L,最高值为105 μg/L,肉眼可见系统表面形成一层薄薄的藻类水华.
营养盐是影响浮游植物生长的关键因子[28],微囊藻碎屑加入后,短期内释放了大量的溶解态营养盐,以NH3-N为主,其作为浮游植物最容易利用的氮源[29],将很快被水体中浮游藻类吸收利用. 在本试验第5~9天,随着氮、磷营养盐的增加,系统内Chl.a平均浓度呈上升趋势. 但在整个试验过程中,Chl.a的平均浓度未发生显著变化,系统内的双壳类底栖动物通过滤食水体中的浮游藻类[30-32],从而抑制了浮游植物的生长,使本试验系统内的浮游植物生物量保持在一个相对稳定的水平.
附着藻作为水体重要的初级生产者之一,其生长与水体营养盐和光照强度密不可分. 研究表明,附着藻生物量随水体氮浓度的升高而增加[1,33]. 本试验在加入微囊藻碎屑后,水体氮营养盐浓度不断增加,而我们发现附着藻生物量却呈逐渐下降的趋势. 本试验中附着藻生物量的下降,可能受水下光照强度变化的影响. 微囊藻碎屑加入后,浮游植物生物量上升,削弱了水下光照强度,从而抑制了附着藻类的生长. 另外,椭圆萝卜螺和铜锈环棱螺也可刮食桶壁附着藻[34-35],因此附着藻的生长繁殖还受到捕食者威胁. 但在试验开始前,系统经过一个月的稳定沉降,试验桶内各生物初始生物量较为稳定,而附着藻生物量的显著下降发生在微囊藻碎屑添加入系统之后,且观察发现试验系统水色呈绿色,浮游植物Chl.a浓度也与此一致. 因此,我们认为浮游植物的遮光作用,是本试验附着藻生物量下降的主要原因.
在近几十年里,太湖频繁的暴发大面积的蓝藻水华[36],且水华的持续时间也越来越长[37],我们的研究结果将对湖泊管理和蓝藻水华管控提供重要的理论依据. 本研究中,微囊藻碎屑不仅通过分解产生大量营养盐刺激初级生产力升高(浮游植物Chl.a); 而且还可促进次级生产力(水丝蚓)的增长. 微囊藻是太湖常见的蓝藻水华种,而之前的研究发现微囊藻碎屑70%的氮源进入了太湖底栖食物网[38]. 而在太湖,风浪对沉积物的扰动作用很强,这不仅加速了沉积物营养盐释放速率[39],而且还可将未分解完全的蓝藻碎屑再次带入水中,在微生物等的作用下,将进一步促进蓝藻碎屑营养盐的释放. 这些蓝藻碎屑分解产生的营养盐,主要以溶解态形式存在,则很容易被蓝藻利用而再次形成蓝藻水华. 蓝藻碎屑通过促进底栖次级生产力增长,不仅影响底栖食物网结构,而且还可能加速了沉积物营养盐向水体释放的速率,因为底栖动物(包括水丝蚓)通过扰动沉积物可显著增加水体营养盐浓度[40-43],这可能反过来加速蓝藻水华的暴发速度(加速营养盐供给).
4 结论
1)微囊藻碎屑可显著增加水体不同形态氮、磷营养盐浓度,其中高浓度氮的持续时间较磷长,且主要以溶解态氮的形式存在.
2)浮游植物生物量(Chl.a浓度)随营养盐浓度的升高而上升,试验期间在水体表面出现大量藻类聚集的现象.
3)微囊藻碎屑的加入,不仅引起较高的浮游初级生产力(Chl.a浓度),而且还引起底栖次级生产力(水丝蚓生物量)的上升. 我们的研究结果证明了微囊藻碎屑的分解对水质及部分水生生物生物的影响: 微囊藻分解不仅直接影响水质,增加水体氮磷营养盐,还能直接或间接影响浮游植物、附着藻和底栖生物的生物量.
致谢: 感谢李柯、周德勇、刘旭博、姚思鹏、章铭、姬娅婵对受控试验和实验室工作的支持.

