水浸煤二次氧化自燃危险性实验研究
文 虎,陆彦博,刘文永
(1.西安科技大学 安全科学与工程学院,陕西 西安 710054; 2.国家矿山应急救援西安研究中心,陕西 西安 710054;3.陕西省煤火灾害防治重点实验室,陕西 西安 710054)
近年来,为提高资源利用率,有关煤矿进行了火区启封和工作面复采,由此导致的遗煤二次氧化自燃事故越来越多。国内有关专家学者使用过不同方法对此进行研究,文虎等[1]通过程序升温实验对高硫煤初次及二次氧化自燃特性参数进行了对比研究;邓军等[2-3]通过程序升温、物理吸附和红外光谱等实验对不同含水率和不同变质程度的煤样进行了宏观、微观分析;张辛亥等[4]将热重和红外光谱联用对原煤和不同预氧化程度的煤样进行了对比研究。
目前大部分研究都是针对煤初次或二次氧化升温过程,而对降温过程的研究较少。火区启封和工作面复采时老空区遗煤往往由于长时间水的浸泡形成水浸煤,遗煤温度上升时会采取措施进行降温,所以研究水浸煤二次氧化升温及其在降温过程中的自燃特性具有重要意义。因此,笔者利用程序升温实验台对原煤、水浸煤初次及二次氧化升温,以及2次降温全过程进行实验,研究其自燃特性参数的变化规律,并计算表观活化能,分析其自燃危险性,为火区启封、工作面复采及遗煤降温过程中防止煤二次氧化自燃提供理论依据。
1 实验装置及条件
实验采用自主研发的程序升温实验装置,其主要由空气泵、实验罐、程序控温箱、气相色谱仪四部分构成[5],如图1所示。
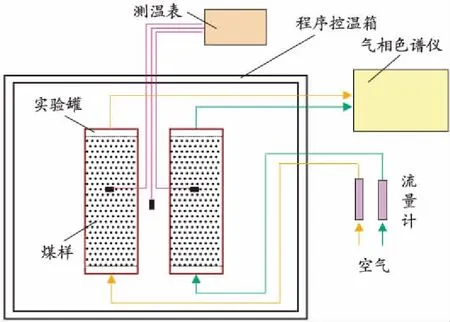
图1 程序升温实验装置示意图
从唐家会煤矿取煤样,将其密封好并运送至实验室,使用破碎机将煤样破碎成0~0.9、0.9~3.0、3.0~5.0、5.0~7.0、7.0~10.0 mm 5种粒径,然后取各种粒径煤样200 g均匀混合,制作成1、2号混合煤样(各1 000 g)。1号混合煤样不做任何处理密封保存待用,将2号混合煤样放入水中浸泡24 h,然后放在空气中凉干72 h保存待用。将1号、2号2组煤样分别装入2个实验罐并放置在程序控温箱中,打开空气泵、调节流量计,将预热后的空气以 120 mL/min 的流量送入,设定升温速率为 0.3 ℃/min。煤温每上升 10 ℃ 用取气管取气样并保存,当温度达到170 ℃时停止升温;保持通气,温度每下降 10 ℃ 取一次气样,当温度降至室温后停止抽气;保持相同条件进行二次氧化升温及降温实验,最后使用气相色谱仪分析取出气体的成分并做好记录。
2 实验结果及分析
2.1 耗氧速率
空气泵将新鲜风流送入实验罐,煤会与其中氧气发生反应消耗风流中的氧,然后根据实验罐进出口处氧气浓度差计算耗氧速率,计算公式为[6]:
(1)

根据式(1)计算出煤样耗氧速率vO2,然后可以得到其随煤温的变化曲线,如图2、图3所示。
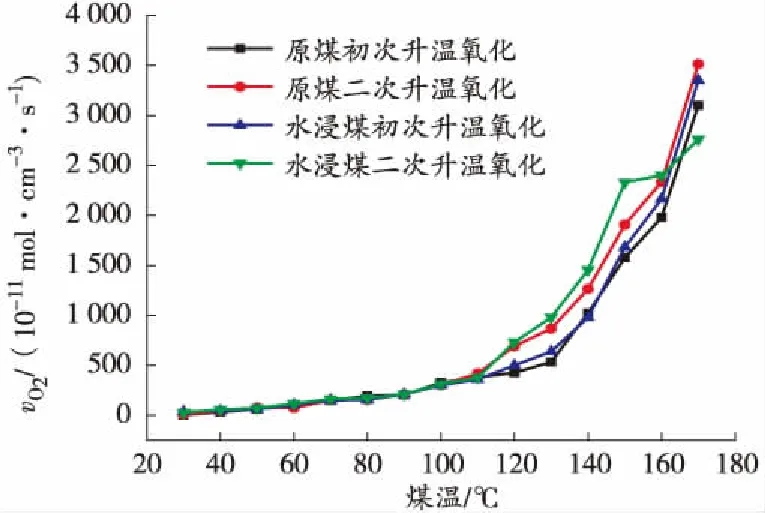
图2 升温过程中耗氧速率与煤温的关系曲线
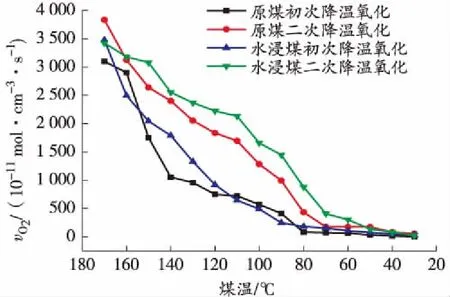
图3 降温过程中耗氧速率与煤温的关系曲线
从图2可以看出,煤样耗氧速率随着煤温的上升不断增大,但在110 ℃时发生了明显的变化,在110 ℃之前增速非常缓慢,110 ℃以后迅速增大。在整个升温过程中,110 ℃以前原煤和水浸煤初次及二次氧化耗氧速率差别不大,110~160 ℃范围水浸煤大于原煤、二次氧化大于初次氧化。
从图3可以看出,在降温过程中煤样仍然会消耗大量氧气,耗氧速率随着煤温的降低不断减小,降温初始阶段原煤和水浸煤初次及二次降温的耗氧速率差别不大,但随着煤温的降低,原煤比水浸煤、初次降温比二次降温的下降速度明显更快。
2.2 CO、CO2产生率
煤样与流经实验罐的新鲜风流中的氧气反应生成大量的CO和CO2,假设实验罐内某一点的煤样对氧的消耗速率与CO、CO2产生率成正比,则可推导出CO、CO2产生率的计算式为[7]:
(2)
(3)
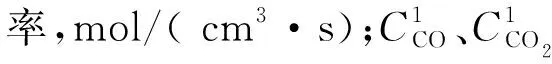
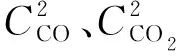
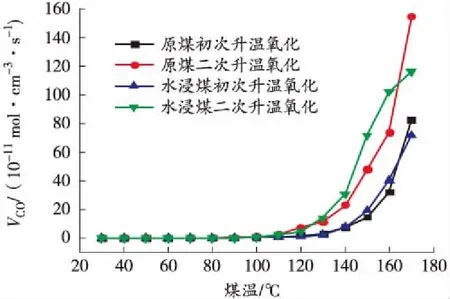
图4 升温过程中CO产生率与煤温的关系曲线

图5 降温过程中CO产生率与煤温的关系曲线

图6 升温过程中CO2产生率与煤温的关系曲线
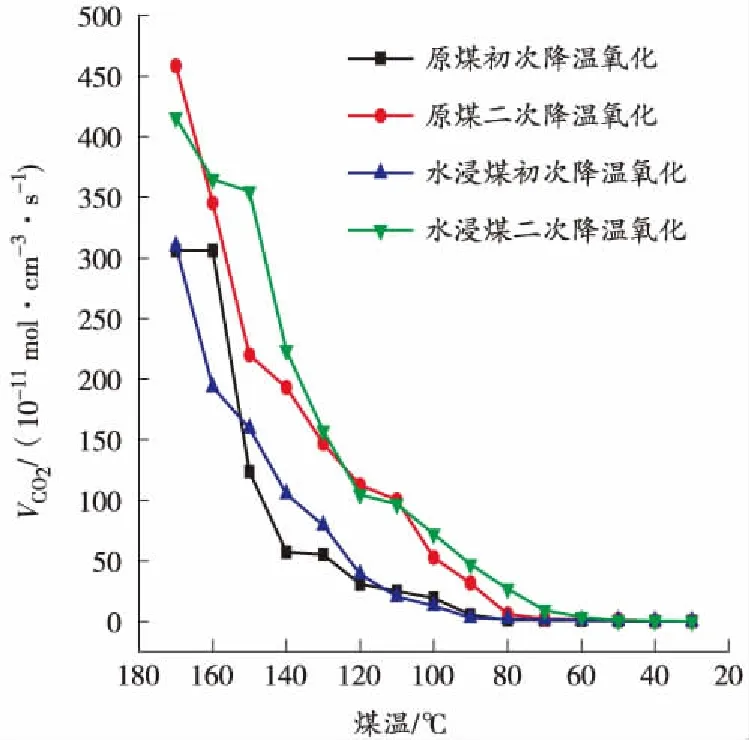
图7 降温过程中CO2产生率与煤温的关系曲线
从图4和图6可以看出,CO和CO2产生率随着煤温的上升不断增大,70 ℃和110 ℃是2个分水岭,在70 ℃之前变化较小,从70 ℃开始逐渐增加,当温度到达110 ℃时呈指数型增长。整个升温过程中110 ℃之前水浸煤和原煤初次及二次氧化CO、CO2产生率差别较小,在110 ℃之后水浸煤大于原煤、二次氧化大于初次氧化。
从图5和图7可以看出,随着煤温的下降,CO和CO2的产生率不断减小,但在整个降温过程中基本符合水浸煤大于原煤、二次降温大于初次降温的规律。
2.3 极限放热强度
化学吸附热和反应热构成了煤和氧气复合反应的主要热量,可以用键能估算法进行计算,从而得到煤的下限和上限放热强度,用于衡量煤的放热性能。极限放热强度计算公式如下[6-9]:
qmin=ΔHx(vO2-VCO-VCO2)+ΔHCOVCO+ΔHCO2VCO2
(4)
(5)
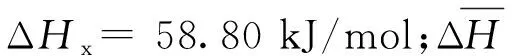
根据式(4)、式(5),可以计算得到不同煤温对应的极限放热强度,如图8~11所示。
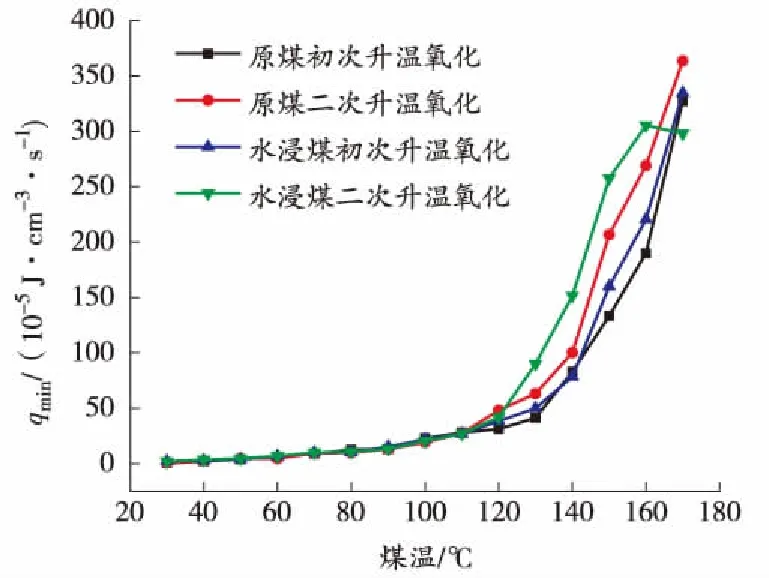
图8 升温过程中煤的下限放热强度与煤温的关系曲线
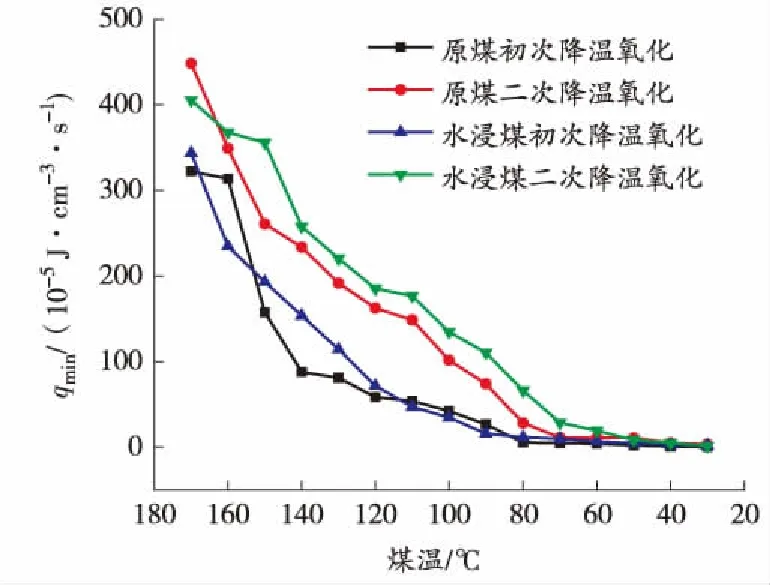
图9 降温过程中煤的下限放热强度与煤温的关系曲线
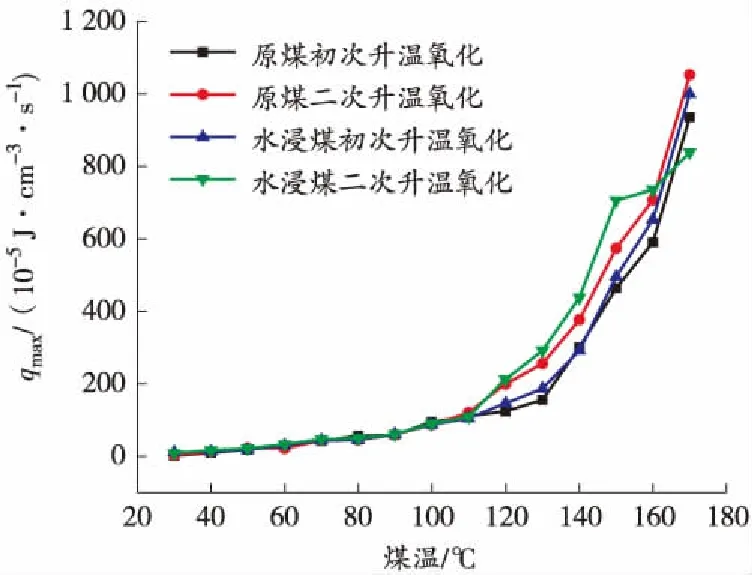
图10 升温过程中煤的上限放热强度与煤温的关系曲线

图11 降温过程中煤的上限放热强度与煤温的关系曲线
从图8和图10可以看出,随着煤温的上升,煤的极限放热强度不断增加,在110 ℃之前增长缓慢,110 ℃后呈指数型增加。110 ℃之前极限放热强度无明显差别,110 ℃之后水浸煤比原煤、二次升温比初次升温增长快。
从图9和图11可以看出,极限放热强度随着煤温的降低不断减小,原煤比水浸煤、初次降温比二次降温下降快,所以在降温过程中极限放热强度符合水浸煤大于原煤、二次降温大于初次降温的规律。
2.4 实验结果分析
从上述分析中发现,70 ℃和110 ℃是升温过程中煤自燃特性参数的2个突变点,所以煤在低温氧化阶段的临界温度和干裂温度分别在70 ℃和110 ℃左右;煤样的耗氧速率、特征气体产生率和极限放热强度在煤温上升的过程中规律相似,都随着煤温的升高逐渐增大,在临界温度之前增长缓慢,临界温度到干裂温度之间开始逐渐增长,在干裂温度之后呈指数型增长,原煤和水浸煤的初次及二次氧化升温在干裂温度之前差别不大,干裂温度之后符合水浸煤大于原煤、二次氧化大于初次氧化的规律。降温过程中煤自燃特性参数都随着煤温的下降逐渐减小,但没有明显的突变温度,在整个降温过程中基本符合原煤低于水浸煤、初次降温低于二次降温的规律。
3 表观活化能
3.1 计算模型
在煤与氧气发生反应蓄热升温自燃的过程中,煤表面的活性分子与氧分子反应生成CO、CO2和其他产物[10]:
煤+O2→mCO+gCO2+其他产物
(6)
结合反应速率的计算方法和Arrhenius公式,可以推导出煤和氧气不同温度下的反应速率计算公式:
(7)
式中:A为指前因子;CO2为气体中的氧气浓度,mol/cm3;n为反应级数;E为表观活化能,J/mol;R为摩尔气体常数,R=8.314 J/(mol·K);T为煤温,K。
将式(1)与式(7)结合,可以得到煤样耗氧速率与活化能之间的关系:
(8)
将式(8)进一步化简,即两边取对数:
(9)
整理得:
(10)
3.2 结果分析
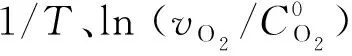
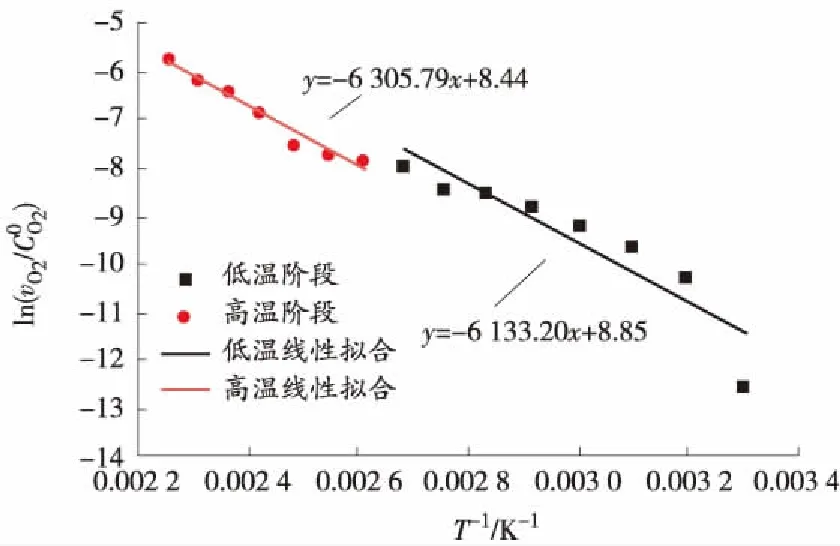
(a)原煤初次升温

(a)水浸煤初次升温


表1 煤样的表观活化能
煤的表观活化能是煤与氧气发生复合反应时所需要的最小能量,可以用来判断煤自然发火倾向性的大小。表观活化能的大小与煤的自然发火倾向性成反比,即活化能小,则煤自然发火倾向性大,易自燃;相反,活化能大,则自然发火倾向性小,煤不易自燃[11-15]。
从表1可以发现,低温阶段水浸煤在初次及二次氧化升温的表观活化能明显低于原煤,高温阶段表观活化相差不大,说明煤样经过水浸泡后相比于原煤,低温情况下更容易与氧气发生反应,自然发火倾向性更大;水浸煤初次及二次氧化降温全过程中的表观活化能明显低于原煤,说明煤样经过水浸泡后降温过程中自燃倾向性变大,更容易出现氧化升温复燃现象。
无论是原煤还是水浸煤,二次氧化升温和降温全过程的表观活化能明显低于对应的初次氧化升温和降温,说明二次氧化升温比初次氧化升温所需的能量更少,蓄热环境较差的情况下也能与氧气以更快的速度反应后升温自燃,二次氧化降温过程中发生复燃的可能性也明显高于对应过程的初次氧化降温。
4 结论
1)无论是氧化升温还是降温,水浸煤比原煤、二次氧化比初次氧化在相同条件下都更容易与氧气结合发生反应产生大量气体,放出更多的热量。
2)水浸煤无论是升温还是降温,表观活化能都低于相同状态下的原煤,自然发火倾向性更大。
3)无论是原煤还是水浸煤,二次氧化升温和降温过程中表观活化能都对应低于初次氧化升温和降温,自然发火倾向性更大,降温过程中出现复燃的概率更大。
4)在火区启封、工作面复采,以及在采取注氮、灌浆等措施对遗煤进行降温的过程中要加强监控,防止遗煤氧化自燃、复燃等情况发生。

