含有金属水链的3,5-吡唑二甲酸铜配位聚合物的合成及热稳定性
苏丽娟, 张晓宇, 周瑞莎
(中北大学 理学院化学系, 太原 030051)
由于配位化合物的结构多变, 且其在催化、 气体吸附、 分离、 传感和膜科学等领域具有潜在应用价值[1-4], 因此, 对配位化合物的设计、 合成及性能研究已引起人们广泛关注. 化学反应过程中的热力学参数和动力学参数对配位化合物的合成均产生较大影响[5], 合成新的目标化合物需选择有机连接体. 目前, 常用的有机连接体有羧酸、 氮杂环羧酸和氮杂环硫醇等. 3,5-吡唑二甲酸(H3pdc)是一种氮杂环配体, 在构筑配位化合物时具有如下优势: 1) 其含有3种不同形式的氢(2个COOH和1个NH), 这3种氢可部分或全部解离形成pdc3-,Hpdc2-和H2pdc-, 从而形成多种有机连接体的配位模式; 2) 含有4个氧原子和2个氮原子, 这些原子均具有较强的配位能力, 可与过渡金属或稀土金属离子形成配位化合物, 并且这些原子可作为氢键受体组装形成超分子网络; 3) 氮氧原子与金属离子的配位能力存在差异, 对组装多金属配合物提供了保障.
目前, 3,5-吡唑二甲酸基配位化合物的构筑主要分为如下4类:
1) 3,5-吡唑二甲酸与过渡金属离子在水热或溶剂热条件下反应, 如Barman等[6]利用二价铜与3,5-吡唑二甲酸在DMF溶剂热条件下反应得到了三维MOF-647A和MOF-648, 这两个化合物的金属中心配位点被DMF分子占据, 通过活化得到具有缺位活性的金属中心, MOF-647A和MOF-648均显示了良好的气体吸附性能. 文献[7]利用该方法合成了3,5-吡唑二甲酸钴、 镍、 锰等配位化合物.
2) 3,5-吡唑二甲酸、 中性有机胺与过渡金属离子反应组装得到系列高维数、 结构新颖的配位化合物[8-9], 如3,5-吡唑二甲酸、 Cu2+与4,4′-联吡啶-N,N′-二氧化物在水热条件下反应得到一维链状化合物[Cu2(Hpdc)2][4,4′-dpdo], 该化合物具有反铁-铁磁耦合作用[10]; 3,5-吡唑二甲酸、 硝酸铜和咪唑在溶剂热条件下反应生成了零维四核铜化合物[Cu4(μ4-pdc)4(Im)4]·4DMF·9H2O[11], 该化合物具有弱的反铁磁性相互作用; Stylianou等[12]通过3,5-吡唑二甲酸、 腺嘌呤和Ni2+反应生成了带有一维微孔结构的金属有机骨架[Ni3(pzdc)2(Hade)2(H2O)4]·(H2O)2.18, 该化合物对CO2具有良好的选择性吸附.
3) 3,5-吡唑二甲酸含有两种配位元素N和O, 可用于组装二元或三元杂金属配位化合物, 如用3,5-吡唑二甲酸构筑杂金属3d~4f配位化合物[CuLn(pdc)(ipdc)(H2O)4]·H3O+[Ln=Ho(1),Er(2),Yb(3)]; Zhou等[13]通过3,5-吡唑二甲酸、 碳酸钠、 硝酸铜和稀土盐反应生成了一系列杂金属配位聚合物{[Na(H2O)4]2[Cu(pdc)2Ln(H2O)5]2·3H2O}n[Ln=La(1);Sm(2);Pr(3);Nd(4)].
4) 利用3,5-吡唑二甲酸衍生物(卤代、 酯或酰胺)与金属离子反应得到结构新颖、 性能优异的配位化合物[14], Driessen等[15]通过酰胺与二价铜反应, 酰胺原位水解生成3,5-吡唑二甲酸, 从而得到两个线性三核铜化合物, 该化合物具有弱的反铁磁性耦合作用. 但目前的研究多集中在中性有机胺辅助合成目标化合物, 而对3,5-吡唑二甲酸与二价铜离子构筑配位化合物的研究目前文献报道较少.
本文合成3,5-吡唑二甲酸铜配位聚合物{[Cu3(pdc)2(H2O)7]·2H2O}n, 其分子中3个Cu2+与2个pdc3-相互作用形成1个三核铜中性分子, 该中性分子被1个水分子通过铜氧配位键连接形成1个折叠状的一维链. 通过氢键作用, 一维链被连接形成三维超分子网络, 并且Cu2+的配位水分子和晶格水分子通过氢键作用形成了一维金属水链.
1 实 验
1.1 主要仪器、 试剂及方法
用Bruker SMARt CCD型衍射仪(德国Bruker公司)测量单晶X射线衍射数据, Mo-Kα射线, 石墨单色器辐射波长为0.071 073 nm, 用SHEKXTL-97(Version 5.1)程序对晶体结构进行解析和精修; 用Perkin-Elmer 240型元素分析仪(美国PE公司)进行元素分析(C,H,N); 通过KBr压片用IR-8400S型红外光谱仪(日本岛津公司)测得红外光谱; 在空气氛中, 用TAQ 50型热重分析仪(美国TA公司)进行热重分析, 升温速率为10 ℃/min, 温度范围为室温~700 ℃; 用RIGAKU-DMAX2500型X射线衍射仪(日本Rigaku公司)测量粉末X射线衍射谱, Cu-Kα射线(λ=0.154 2 nm), 扫速为10°/min.
所用试剂均为国产分析纯试剂.
1.2 {[Cu3(pdc)2(H2O)7]·2H2O}n的合成
准确称量3,5-吡唑二甲酸17.4 mg(0.1 mmol), 溶解于4 mL乙腈中, 加入20 μL三乙胺(1 mol/L)溶液调成清液; 称量Cu(NO3)2·3H2O 48.4 mg(0.2 mmol)溶解于2 mL水中. 先将两种溶液混合, 室温搅拌10 min, 再将混合物转移至20 mL聚四氟乙烯内衬的反应釜中, 于120 ℃反应72 h. 反应完成后, 慢慢冷却至室温, 过滤, 用蒸馏水洗涤, 得到蓝色块状晶体, 产率(基于H3pdc)为56%. 元素分析(理论值, %): C 18.25(18.21), H 3.31(3.35), N 8.53(8.50).
1.3 {[Cu3(pdc)2(H2O)7]·2H2O}n的晶体结构
用Bruker SMART CCD型X射线单晶衍射仪(德国Bruker公司)测得单晶衍射数据, 收集条件: 298 K,λ=0.071 073 nm的Mo-Kα射线, 石墨单色器和ω变换扫描方式. 用SHELXTL-97程序对单晶结构进行精修, 通过直接法解析, 用全矩阵最小二乘法修正, 用各向异性对非氢原子进行精修, 利用Fourier参峰确定水上的氢原子, 用命令DFIX限定O—H键键长为0.085 nm. 化合物的晶体学数据列于表1, CCDC编号为1975580.

表1 化合物的晶体学数据
2 结果讨论
2.1 化合物的晶体结构
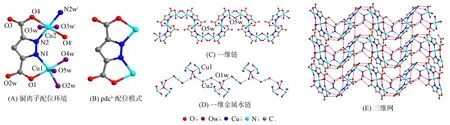
图1 化合物{[Cu3(pdc)2(H2O)7]·2H2O}n的结构
单晶结构解析显示化合物{[Cu3(pdc)2(H2O)7]·2H2O}n为单斜晶系,C2/c空间群, 其结构如图1所示. 在化合物的不对称单元中含有1.5个Cu2+, 1个pdc3-, 3.5个配位水和1个晶格水(图1(A)). 有两种Cu2+(Cu1和Cu2): Cu1为四方锥几何构型, N1,O1,O2w和O4w构成四方锥的底部, O5w在四方锥的顶部; Cu2为八面体几何构型, 占有率为50%, 由O3w,O3wi,O4和O4i构成八面体的赤道面(对称码i: 1-x,1-y,1-z), 八面体的两端被N2和N2i占据. Cu—O/N的键长为0.196 4(3)~0.238 3 nm, 相应的N/O—Cu—O/N键角为81.79(14)°~180.00(1)°.
配体pdc3-采用双螯合配位模式与2个Cu2+相连(图1(B)), 2个pdc3-与3个Cu2+相互作用形成了1个中性Cu3(pdc)2分子. Cu3(pdc)2分子两端被2个水分子桥联形成一维折叠链(图1(C)), 这种以水分子做桥组装形成的一维金属有机骨架链结构新颖. Cu2+的配位水分子与晶格水分子通过氢键作用形成了1个一维金属水链(图1(D)). 一维链通过水分子间和水分子与羧基氧氢键进一步组装形成二维超分子层, 二维超分子层通过水分子与羧基氧氢键构筑形成1个三维超分子网(图1(E)).
2.2 化合物的红外光谱
化合物和配体H3pdc的红外光谱如图2所示. 由图2可见, 在H3pdc的红外谱中, 位于3 440,3 540 cm-1处存在明显的锐峰, 归属于N—H和O—H的伸缩振动峰, 在化合物的红外光谱中, 这两个锐峰消失, 这是由于H3pdc配体与Cu2+发生配位, 使N—H和O—H中的氢离去所致; 在3 100~3 600 cm-1处出现一个宽红外吸收峰, 归属于水的O—H伸缩振动峰; 1 589,1 386 cm-1处的峰归属于C—C和C—N键的对称和不对称振动峰, 778 cm-1处的峰归属于芳香环C—H的振动吸收峰.
2.3 化合物的X射线粉末衍射
化合物的理论模拟及实验测定的XRD谱如图3所示. 由图3可见, 化合物测得的XRD峰位值与理论模拟的XRD谱基本相符, 表明目标化合物为纯相.
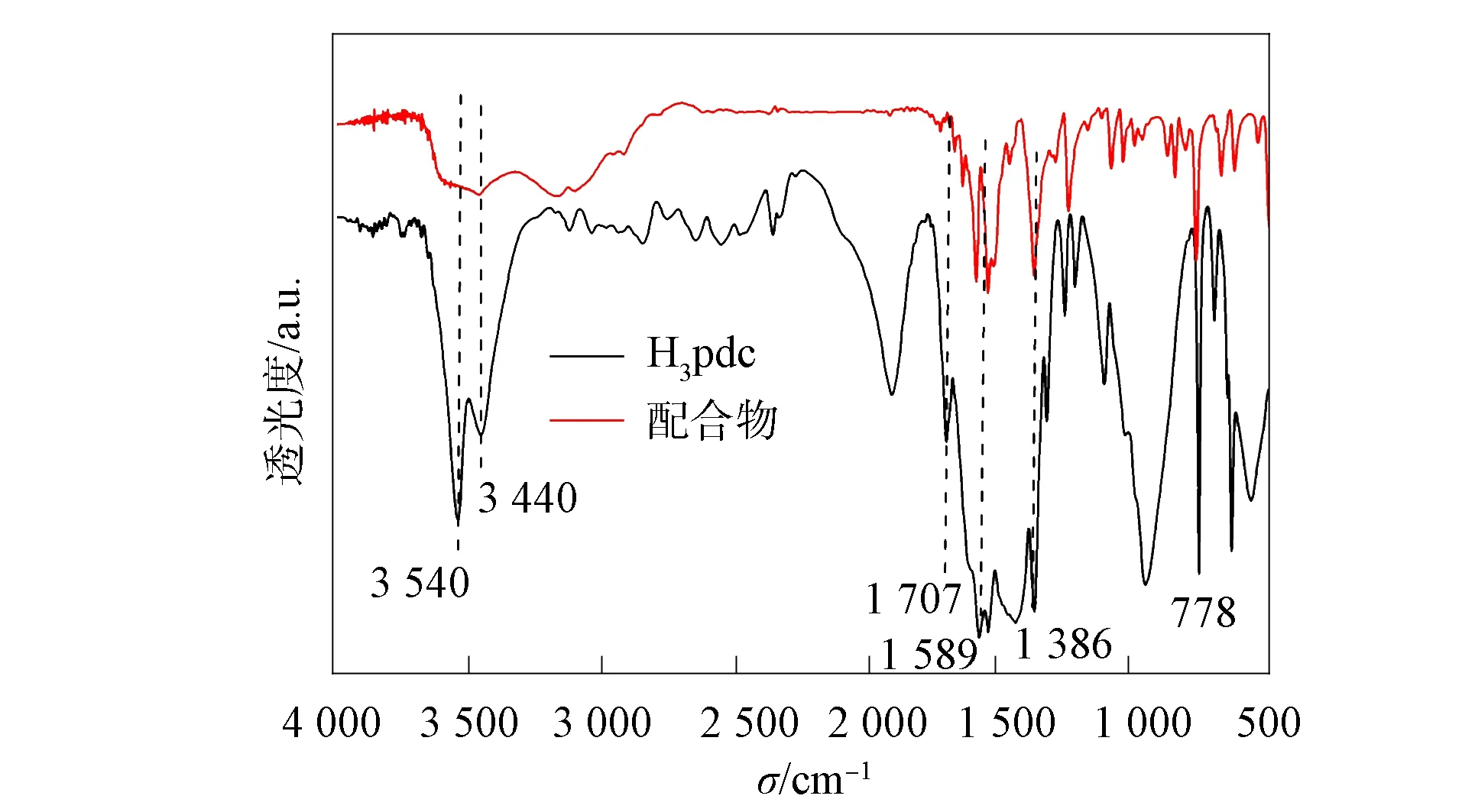
图2 H3pdc和化合物的红外光谱

图3 化合物的模拟及实验XRD谱
2.4 化合物的热重分析

图4 化合物的热重曲线
化合物的热重曲线如图4所示. 由图4可见, 化合物从室温到262 ℃共失重23.41%, 这是由于化合物失去晶格水和配位水所致(理论值: 24.58%). 从262 ℃到360 ℃共失重38.72%, 这是由于有机配体pdc3-分解所致(理论值: 39%). 剩余质量所占百分数为37.87%, 对应产物CuO(理论值: 36.42%).
综上所述, 本文利用硝酸铜和3,5-吡唑二甲酸(H3pdc)在乙腈和水的混合体系反应生成了一个新的配位聚合物, 并通过元素分析、 红外光谱、 粉末X射线衍射及单晶X射线衍射对该化合物的结构进行了表征, 研究了化合物的热稳定性. 结果表明, 该化合物为一个一维折叠链化合物, 其中配位水为桥联配体.

