硫酸茯苓多糖抗抑郁作用机制的探讨
周鸿铭,李铁臣
(皖南医学院 基础医学院,安徽 芜湖 241002)
近年来有研究发现α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体在抑郁症的发病机制中起着重要的作用[1-2]。AMPA受体是一种离子型谷氨酸受体,有4种亚型(GluR1、GluR2、GluR3、GluR4),在海马神经元突触发生及突触可塑性等方面起着重要作用[3]。临床研究发现在抑郁症患者大脑前叶皮层及海马中GluR1表达水平明显降低,同时在抑郁症动物模型中也发现海马GIuR1的表达水平明显降低[4-6]。而研究发现TAK-653作为一种AMPA受体调节剂,通过减缓海马AMPA受体脱敏或失活来增强受体功能而缓解抑郁症的症状,但这种调节剂由于其毒性较大,目前仍处于Ⅰ期临床试验阶段[7-8]。以上结果表明AMPA功能下调与抑郁症发病密切相关,而调控AMPA受体有望治疗抑郁症。
茯苓多糖(pachymaran)是传统中药茯苓的有效成分之一,具有抗炎、提高免疫力及神经保护等作用[9-10]。近期研究发现茯苓多糖对记忆障碍小鼠空间学习记忆能力具有明显改善作用[11]。另有研究发现某些中药的有效成分(如虫草素、香菇多糖等)具有明显的抗抑郁疗效,其机制可能与其影响海马AMPA受体p-GluR1水平并上调GluR1的表达有关[12-13]。基于以上的研究背景,本实验采用双侧卵巢摘除加慢性不可预知性温和应激抑郁症大鼠模型,以AMPA受体为切入点,探讨茯苓多糖的抗抑郁作用及机制,为其临床应用提供理论依据。
1 材料和方法
1.1 动物 SD大鼠(清洁级,雌性,12月,体质量 500~550 g),购自南京市江宁区青龙山动物试验中心,许可证号SCXK(苏)2017-0001。
1.2 药物及主要试剂 硫酸茯苓多糖(sulfated pachymaran,SP)(纯度95%),由陕西金润生物科技有限公司提供(批号180308-1)。尼氏染色试剂盒(上海碧云天)。GYKI 52466(美国Abcam)。抗IL-1β、IL-6、TNF-α及GAPDH抗体(美国Santa Cruz公司)。抗GluR1、p-GluR1、PKA、p-PKA、TrkB、p-TrkB、AKT、p-AKT、mTOR、p-mTOR抗体(美国Abcam公司)。抗PI3K、p-PI3K抗体(美国CST公司)。Luminata Crescendo Western HRP Substrate(美国Millipore公司)。
1.3 方法
1.3.1 抑郁症大鼠模型的制备及实验分组 根据文献[14]采用双侧卵巢摘除与慢性不可预知性温和应激实验(CUMS)两步法复制抑郁症动物模型。本研究设抑郁症模型组(Model组),SP(25、50、100 mg/kg)剂量组(SP25组、SP50组、SP100组)及SP(100 mg/kg)+ GYKI 52466(3 mg/kg)剂量组(GYKI抑剂组),另设假手术组(Sham组),每组12只。假手术组除不切除双侧卵巢外,其余手术方法与模型组相同。SP和GYKI 52466分别采用灌胃和腹腔注射给药。共计给药21 d。在21 d实验期间模型组及各给药物组大鼠给予的应激刺激包括:3次电击(平均电流1 mA,持续 10 s,每隔 1 min刺激 1 次);3次24 h禁食;3次夹尾(每次1 min,每隔 5 min夹尾 1 次);3次4℃冰水游泳5 min;3次40℃环境中5 min;两次昼夜循环颠倒;两次居住环境改变(24 h转移至另一房间中的新笼中);两次高速水平震荡30 min。各种应激刺激随机应用,每日给予1种刺激。
1.3.2 强迫游泳实验 末次应激刺激后24~48 h内进行强迫游泳实验,具体方法详见文献[15]。大鼠游泳6 min,观察记录后4 min 内大鼠累计不动时间。
1.3.3 敞箱实验 末次应激刺激后24~48 h内进行敞箱实验,具体方法详见文献[15]。记录6 min内动物在旷场内垂直运动(记录大鼠站立次数,双前足离地1 次为1 分)和水平运动(3 或4 只足同在一个格内计1 分或穿越1 格计1 分)得分。
1.3.4 糖水消耗试验 应激刺激开始的前1天和结束后1天各进行一次糖水消耗试验,具体方法详见文献[16]。分别计算2次大鼠的淡水、糖水和总水消耗量、糖水偏爱百分比(糖水消耗量/总水消耗量× 100%)。
1.3.5 Morris水迷宫实验 给药后第15天开始对各组大鼠进行5天的游泳训练,第20 天进行正式实验,具体方法详见文献[15]。
1.3.6 海马病理检测 3%戊巴比妥钠麻醉大鼠,腹主动脉放血处死大鼠,开颅取脑,参照《大鼠脑读片提要及图谱》分离海马组织。固定、包埋、切片后,按尼氏染色步骤进行染色,光镜下观察病理变化。
1.3.7 Western blot检测大鼠海马AMPA受体GluR1及其相关信号蛋白的表达 低温条件下提取总蛋白,BCA法测定蛋白浓度。Western blot具体操作方法详见我们前期研究成果[17]。相关蛋白一抗浓度分别为GluR1(1∶1000)、p-GluR1(1∶1000),相应二抗浓度(1∶2000~1∶5000)。将目的蛋白与内参蛋白(GAPDH)灰度值比值作为目的蛋白的相对表达量。
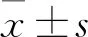
2 结果
2.1 SP对抑郁症大鼠强迫游泳不动时间的影响 与假手术组相比,模型组大鼠强迫游泳不动时间增加(P<0.05);与模型组相比,SP50组、SP100组大鼠强迫游泳不动时间均减少(P<0.05);与SP100组相比,GYKI抑剂组大鼠强迫游泳不动时间增加(P<0.05)。见表1。
2.2 SP对抑郁症大鼠自发活动的影响 与假手术组相比,模型组大鼠垂直运动与水平运动减少(P<0.05);与模型组相比,SP25组、SP50组、SP100组大鼠垂直运动与水平运动增加(P<0.05);与SP 100组相比GYKI抑剂组大鼠垂直运动与水平运动减少(P<0.05)。见表1。
2.3 SP对抑郁症大鼠糖水偏爱度的影响 结果显示,给药前各组大鼠总水、糖水、淡水消耗量和糖水偏爱百分比差异无统计学意义(P>0.05),给药后各组大鼠总水消耗量差异仍无统计学意义(P>0.05)。与假手术组相比,给药后模型组大鼠淡水消耗量增加而糖水消耗量及糖水偏爱百分比降低(P<0.05);与模型组相比,给药后SP25组、SP50组、SP100组淡水消耗量降低而糖水消耗量及糖水偏爱百分比均升高(P<0.05);与SP100组相比,GYKI抑剂组淡水消耗量增加而糖水消耗量及糖水偏爱百分比降低(P<0.05)。见表2。

表1 SP对抑郁症大鼠强迫游泳不动时间、水平及垂直运动的影响

表2 各组大鼠糖水消耗量、淡水消耗量、总液体消耗量、糖水偏爱百分比
2.4 SP对抑郁症大鼠空间学习与记忆能力的影响 与假手术组相比,模型组大鼠逃避潜伏期延长而穿越平台次数减少(P<0.05);与模型组相比,SP25组、SP50组、SP100组大鼠逃避潜伏期均降低而穿越平台次数增加(P<0.05);与SP100组相比,GYKI抑剂组大鼠逃避潜伏期延长而穿越平台次数减少(P<0.05)。见表3。
2.5 SP对抑郁症大鼠海马神经元病理变化的影响 尼氏染色结果显示假手术组海马神经元分层明显,排列规则,胞膜结构完整,胞质丰富,胞核明显。而模型组海马神经元分层不清楚,排列紊乱,胞膜皱缩,染色质聚集、胞核不清楚。给予不同剂量SP 21 d后,上述病理损伤减轻。但与SP100剂量组相比,GYKI 52466能够减弱SP对海马神经元的保护作用。见图1。
2.6 SP对抑郁症大鼠海马AMPA受体GluR1表达的影响 与假手术组相比,模型组大鼠海马AMPA受体GluR1及p-GluR1蛋白表达水平均降低(P<0.05);与模型组相比,SP50组、SP100组大鼠GluR1及p-GluR1蛋白表达水平均升高(P<0.05);与SP100组相比,GYKI抑剂组海马GluR1及p-GluR1蛋白表达水平降低(P<0.05)。见表4和图2。
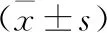
表3 SP对抑郁症大鼠空间学习与记忆能力的影响

图1 各组大鼠海马神经元病理形态学变化(×400)
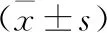
表4 SP对抑郁症大鼠海马GluR1及p-GluR1蛋白表达的影响

图2 SP对抑郁症大鼠海马GluR1及p-GluR1蛋白表达的影响
3 讨论
抑郁症是一类临床上常见的精神障碍,以持续的心境低落、思维迟缓和意志活动减退为主要临床症状,常伴有睡眠障碍、食欲减退、体质量减轻等表现[18]。目前抑郁症的病因和发病机制尚不明确,其治疗主要依靠药物和心理治疗,治疗药物主要是一些单胺类神经递质的选择性再摄取抑制剂,而这些抗抑郁药物都存在起效慢、副作用大等缺点,因此研究起效快且副作用小的抗抑郁药显得尤为重要。大量研究表明中药柴胡、人参、黄芪、银杏、贯叶金丝桃等及其有效成分在治疗抑郁症方面具有不良反应少、疗效稳定且患者易于接受、依从性好等优点[19]。茯苓多糖是从传统中药茯苓中提取的有效成分,具有抗炎、调节免疫力、神经保护等作用[9-10]。进一步研究发现茯苓多糖对记忆障碍小鼠空间学习记忆能力具有明显改善作用[11]。而本研究发现,给予SP 21 d后抑郁症大鼠强迫游泳不动时间减少而自发活动增加,同时糖水摄入量及糖水偏爱百分比升高,空间学习与记忆能力增强。这些研究结果表明SP具有很好的抗抑郁作用。
抑郁症的发病机制目前尚不清楚,其中相关的神经元性假说成为今年的研究热点[20]。研究发现慢性应激状态下可以引起炎症因子如IL-1β、IL-6及TNF-α的表达明显增加,进而导致与情绪密切相关的边缘系统尤其是海马结构损害。同时还发现抑郁症可以引起海马萎缩,影响神经元再生,导致海马体积变小[21]。谷氨酸(Glu)是海马中主要的兴奋性神经递质,其受体分为离子型(iGluR)和代谢型(mG1uR)两大类。而Glu受体又分为AMPA受体、N-甲基-D-天冬氨酸(NMDA)受体和海人藻酸(KA)受体。AMPA受体主要介导脑内兴奋性突触传递,近年来研究发现AMPA受体功能失调与抑郁症的发生密切相关[22]。有研究表明,促炎因子如IL-1β可降低海马脑区AMPA受体的膜表达水平,抑制突触后膜长时程增强(long-term potentiation,LTP),而通过抗炎、抑制炎症因子IL-1β的水平可增强AMPA受体介导的突触后膜LTP,起到抗抑郁作用[23]。另外单独使用AMPA受体激动LY 392098也可产生抗抑郁样效果,而氟西汀的抗抑郁作用与其增加抑郁症大鼠海马AMPA受体的表达有关[24]。而最新的研究发现氯胺酮的抗抑郁作用可能也是通过激活AMPA受体而实现[25]。同时一些中药的有效成分如虫草素、香菇多糖抗抑郁效果与调节海马AMPA受体介导的神经突触可塑性相关[12-13]。本研究结果发现SP给药21 d后,海马神经元损伤减轻,AMPA受体GluR1和p-GluR1表达水平均升高,而AMPA受体抑制剂GYKI 52466完全抑制SP的抗炎、上调AMPA受体的作用。这些结果表明SP抗抑郁效果可能是通过抗炎、调节AMPA受体GluR1表达而实现的,但具体机制有待进一步研究。

