塑造低碳经济的第三代固碳生物炼制
史硕博,孟琼宇,乔玮博,赵惠民
(1 北京化工大学北京软物质科学与工程高精尖创新中心,北京100029; 2 北京化工大学秦皇岛环渤海生物产业研究院,河北 秦皇岛066000; 3 美国伊利诺伊大学香槟分校化学与生物分子工程系,伊利诺伊州厄巴纳-香槟市IL61801)
人类现代文明的快速发展主要依靠化石资源(煤、石油、天然气)的开发与利用[1]。但是化石资源属于不可再生资源,消耗速度远远超过再生速度,其供给不足会造成能源危机[2]。此外,化石资源的大量使用导致二氧化碳过量排放,使其在大气中的浓度急剧上升(图1),在2019 年5 月突破415μL/L[3]。大气中过高的二氧化碳浓度已经引起温室效应以及水资源压力等环境问题,全球温度持续上升(图1),刚刚过去的2020年1月份是自1880年有气象记录以来的最热1月份。如果不采取措施,一旦升温突破1.5°C 的临界点,将对环境带来不可逆转的影响[4]。根据2019 年联合国环境署的报告[5],全球碳排放量在未来10 年须每年下降7.6%才能实现1.5℃温控目标。发展和建立以低能耗、低污染、低排放为基础的低碳经济模式已成为全球共识,各国都把减少碳排放、发展可再生能源、保护人类共同的地球作为首要任务[4]。
通过构建高效的细胞工厂,生物炼制可将生物质转化成为人类所需的各种化学品及燃料,实现了很多以前只能通过化石资源炼制生产化学品及燃料的生物制造,是减少碳排放、缓解温室效应的有效途径[6]。生物炼制利用广泛的、可再生的生物质资源作为碳源,根据所使用的原料以及过程的不同,可将生物炼制分为三代[7-8]。第一代生物炼制的原料主要是油料、淀粉和糖料作物,也是当前生物制造领域的主要原料,但是这些原料供给方式对人类食物供应造成了冲击。随着代谢工程以及合成生物学的出现,第二代生物炼制使用纤维素、半纤维素等“非食用”生物质作为生物制造的原料。这些原料来源于农业、工业、林业的副产物或废弃物,不存在与粮食供应的竞争问题。第三代生物炼制进一步拓展原料范围,可使用微生物细胞工厂来利用大气中的二氧化碳来进行生物生产。通过固定二氧化碳不仅可以降低碳排放,同时还可实现绿色燃料、材料和化学品的可持续生产。另外,第三代生物炼制的能量来源主要有光能、化学能和电能等,能量转换方式为“光能-产物”、“化学能-产物”或“光能-电能-产物”,能量转化率分别为1%~3%、7%、9%~10%[8-9]。相比较第一、二代生物炼制“光能-生物质-产物”0.2%的转换效率而言,第三代生物炼制在能量利用率方面更具有优势。
二氧化碳是地球上最丰富的碳源,每年人为产生的二氧化碳排放量约为330 亿吨[10]。与第一代和第二代生物炼制相比,第三代固碳生物炼制不仅对粮食和水的供应安全威胁要小得多,还可直接实现温室气体二氧化碳的消耗[11]。目前已有几家公司实现了基于二氧化碳的商业化生物制造。例如,Algenol 和LanzaTech 分别利用微藻和梭菌将二氧化碳转化为生物燃料[12-13]。与此同时,包括中国、美国、欧盟在内的诸多政府机构也发布了相关政策,支持和鼓励基于二氧化碳的第三代固碳生物炼制[14]。然而第三代固碳生物炼制的发展仍然远远落后于传统的生物工艺,对该过程中涉及的各个步骤需要进行深入理解和优化,包括确定和改进特定的途径、能量供应方式、宿主和操作模式,进而构建高效的固碳细胞工厂用于生物炼制操作模式[7,15-23]。合成生物学作为一种核心平台技术,增强了对生物系统的操控和设计能力,取得了令人瞩目的研究成果[24-26],支撑和带动了生物产业和生物经济的发展。利用合成生物学改造和拓展微生物代谢网络,甚至合成全新的人工生物系统,正在成为第三代固碳生物炼制的核心技术。虽然不同的生物已经进化出来多样的二氧化碳固定途径,但目前二氧化碳的固定效率还无法满足工业生物制造的要求,相关途径和网络还需要进一步优化,同时固碳反应的能量供应方式以及能量的转换效率仍需进一步提高。本文作者将介绍这些固碳途径以及利用合成生物学如何构建和优化固碳细胞工厂,人工设计固碳能量供应方式,提高微生物固定二氧化碳转化合成相应生物制品的能力,进而建立基于二氧化碳的第三代固碳生物炼制产业。首先将介绍自然界中固定二氧化碳的天然途径以及预测的人工合成途径;基于这些途径的认识利用合成生物学对相关生命系统进行改造或设计,实现基于二氧化碳的生物制造;最后结合现阶段的机遇和挑战,对第三代固碳生物炼制的发展趋势和潜力进行展望和评述。
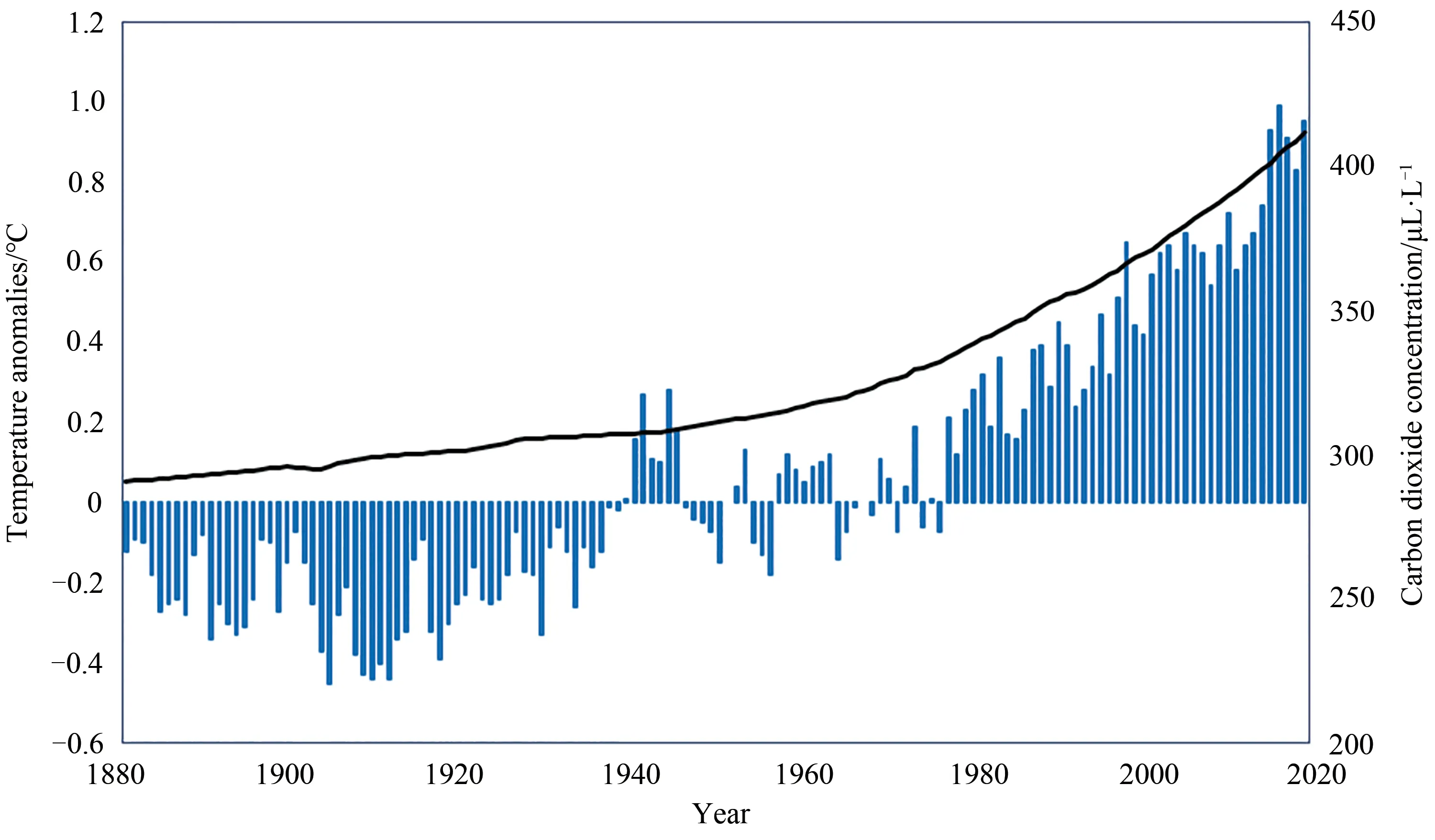
图1 大气中二氧化碳浓度和温度变化(1880—2020年)(柱状图表示当年的全球平均温度,曲线表示当年大气中的二氧化碳浓度。数据来源于美国国家海洋和大气管理局[3])Fig.1 The global average concentration of carbon dioxide and temperature in the atmosphere(1880—2020)(The histogram shows the global average temperature of the year,and the curve shows the concentration of carbon dioxide in the atmosphere.The data came from the National Oceanic and Atmospheric Administration of USA [3])
1 二氧化碳利用途径及固碳供能方式
1.1 二氧化碳天然利用途径
当前已知的固定二氧化碳天然途径如图2 所示[16,27]。根据其特点可分为以下四类:
第一类途径为通过戊糖磷酸途径固定二氧化碳 的Calvin-Benson-Bassham 循 环(CBB 循 环,CBB cycle,又称卡尔文循环或还原性戊糖磷酸循环)[28]。CBB循环是广泛存在于自养生物的固碳途径,既存在于光能自养生物中,也存在于化能自养生物中,其关键酶(1,5-二磷酸核酮糖羧化酶/加氧酶,RuBisCO)催化CBB 循环中的第一步反应。但是由于RuBisCO 酶是一种惰性酶,存在活性效率极低、专一性差且难以改造等缺点[29]。目前已有很多工作致力于优化RuBisCO 酶[21],包括筛选新酶[30]、蛋白质工程[31]和计算机模拟建模[32]等策略。
第二类途径为利用甲酸酯的还原性乙酰辅酶A通路(Wood-Ljungdahl pathway)。第二类途径具有更高的能源效率和生物量产率[33],缺点是反应需要金属配合物、辅因子和伴侣蛋白的参与。还原性乙酰辅酶A合成通路主要被化能自养微生物在厌氧条件下用以固定二氧化碳,如产甲烷菌和产乙酸菌[27,34],其中产甲烷菌利用金属还原剂提供还原力,而产乙酸菌采取NADPH提供还原力。该通路的关键酶包括一氧化碳脱氢酶(CO dehydrogenase)、甲酸脱氢酶(formate dehydrogenase)和亚甲基呋喃脱氢酶(formylmethanofuran dehydrogenase)[35]。
第三类途径利用乙酰CoA 和琥珀酰CoA 之间的循环进行固碳,包括还原性三羧酸循环(reductive TCA cycle) 和二羧酸/4- 羟基丁酸(dicarboxylate/4-hydroxybutyrate)循环(DC/HB 循环,DC/HB cycle),主要存在于化能自养生物中。还原性三羧酸循环通过逆转三羧酸循环实现二氧化碳的固定,关键酶包括柠檬酸合成酶和对氧敏感的2-酮戊二酸合成酶[18-19]。长期以来,柠檬酸合成酶被认为催化不可逆反应,因此该步反应由柠檬酸-CoA 合成酶(citryl-CoA synthetase)和柠檬酰-CoA裂解酶(citryl-CoA lyase)催化的两步反应来代替[36]。直至2018 年才发现了具有可逆活性的柠檬酸合成酶[37-38]。DC/HB 循环通过丙酮酸合成酶(pyruvate synthase)固定二氧化碳,还可利用磷酸烯醇丙酮酸羧化酶(phosphoenolpyruvate carboxylase)固定等物质的量的碳酸氢根。DC/HB循环需要各种铁硫蛋白和硫酯参与才能发挥活性,其关键酶是4-羟基丁酰辅酶A 脱水酶(4-hydroxybutyryl-CoA dehydratase),具有一个氧不稳定的铁硫中心[19]。目前在厌氧菌和兼性需氧菌中都发现了DC/HB循环[39-41]。
第四类途径也是利用乙酰CoA 和琥珀酰CoA之间的循环进行固碳,但是只能通过吸收碳酸氢根来实现对二氧化碳的间接固定,包括3-羟基丙酸(3-hydroxypropionate, 3-HPA)循环(3-HPA bicycle) 和 3- 羟基丙酸/4- 羟基丁酸(3-hydroxypropionate/4-hydroxybutyrate, HP/HB)循环(HP/HB cycle)。由于溶解度差异,细胞内碳酸氢根的浓度远高于细胞内二氧化碳,所以利用碳酸氢根对二氧化碳的间接固定成为第四类途径的显著优势,但是该途径固碳消耗能量较大[42]。3-羟基丙酸循环主要存在于绿色非硫细菌(green nonsulphur bacteria)以及其他光能自养生物[35],关键酶包括丙二酰CoA 还原酶(malonyl-CoA reductase)[43]和丙酰CoA 合成酶(propionyl-CoA synthase)[44]。3-羟基丙酸/4-羟基丁酸循环的关键酶是4-羟基丁酰辅酶A 脱水酶(4-hydroxybutyryl-CoA dehydratase)[19],主要存在于有氧泉古菌等化能自养生物[35]。
二氧化碳主要通过两种机制进入生物圈:一种是通过羧化反应(carboxylation)将二氧化碳附着在生物体内已有的底物上;另一种是在进一步同化前通过还原反应(reduction)先将二氧化碳转化成甲酸盐或一氧化碳。其中,卡尔文循环、还原性三羧酸循环、3-羟基丙酸循环、3-羟基丙酸/4-羟基丁酸循环或二羧酸/4-羟基丁酸酯循环中的关键固碳酶均为羧化酶,属于羧化反应;还原性乙酰辅酶A 通路为还原反应。通过对许多自养微生物进行基因组分析,发现在诸如Ferroplasma acidiphilum和Pyrobaculum arsenaticum等自养微生物中未找到上述已知的天然固碳途径相关基因[17],表明自然界中还存在其他未知的天然二氧化碳固定途径,值得研究人员对相应菌株进行详细的生物信息学分析和生化网络重建。例如,最近在一株亚磷酸盐氧化细菌中发现还原性甘氨酸通路(reductive glycine pathway)(图2),推测是一个潜在的天然固碳途径[41],途径功能已得到部分验证[45-47],目前尚未确定其是否以二氧化碳作为唯一碳源。
1.2 二氧化碳人工设计途径
在人工二氧化碳固定途径的从头设计方面,Bar-Even 等[48]使用基于约束的建模方法(constraintbased modeling,CBM)综合分析了5000种已知代谢酶中可能存在的固碳循环途径组合,提出了丙二酰CoA-草酰乙酸-乙醛酸(malonyl-CoA-oxaloacetateglyoxylate,MOG)固碳循环[图3(a)和(b)]。与CBB循环相比,MOG循环理论上具有更好的热力学可行性、更高的能量利用效率。
在对天然固碳途径挖掘和解析的基础上,近年来研究人员完成了一些人工二氧化碳固定途径的改造。例如,Bar-Even等对3-羟基丙酸循环进行了相应改造[图3(c)],利用较短的通路替代了之前乙酰CoA 和苹果酸之间的通路[16]。类似地,Bouzon 等提出了另一种称为4-羟基-2-氧代丁酸(4-hydroxy-2-oxobutanoic acid, HOB)循环的固碳途径[图3(d)],该途径以丙酮酸和HOB 作为中间体,将二氧化碳还原为甲醛[49]。

图2 天然二氧化碳固定途径[黑色表示CBB循环(CBB cycle),是自然界中普遍的固碳途径;红色表示还原性甘氨酸通路(reductive glycine pathway),可以利用CO2和甲酸盐合成甘氨酸,是一个最新发现的潜在天然固碳途径;棕色表示还原性乙酰辅酶A通路(Wood-Ljungdahl pathway),可被产甲烷菌和产乙酸菌使用;其他几条途径虽然是分别在不同物种中独立进化得到的,但均使用乙酰CoA/琥珀酰CoA之间的循环进行固碳,且共享一些反应和中间代谢物,包括:浅蓝色表示的还原性三羧酸循环(reductive TCA cycle)、绿色表示的二羧酸/4-羟基丁酸循环(DC/HB cycle)、橙色表示的3-羟基丙酸/4-羟基丁酸循环(HP/HB cycle)和紫色表示的3-羟基丙酸循环(3-HPA bicycle)]Fig.2 Natural carbon dioxide fixation pathways identified[The black color indicates the CBB cycle,which is a universal carbon fixation pathway in nature.The red indicates the reductive Glycine pathway that can utilize CO2 and formate to synthesize glycine,which is a newly discovered potential natural carbon fixation pathway.The brown color indicates the reduced acetyl-CoA pathway(Wood-Ljungdahl pathway),which can be used by methanogens and acetogens.Moreover,the reductive TCA cycle(in light blue),the DC/HB cycle(in green),the HP/HB cycle(in orange)and the 3-HPA bicycle(in purple)all use the cycle between acetyl CoA/succinyl CoA to fix carbon and share some reactions and intermediate metabolites,although evolved independently in different ecological niches]
与此同时,由于体外多酶体系可以在体外完成特定途径的反应,具有可操作性强、反应速度快、反应路径明确、背景清晰等优点,被用来验证和鉴定人工设计的二氧化碳固定途径。例如,Schwander等[50]利用体外多酶体系设计和验证了一个新的二氧化碳固定途径[图3(e)],称为巴豆酰CoA/乙基丙二酰CoA/羟基丁酰CoA (crotonylCoA/ethylmalonyl-CoA/hydroxybutyryl-CoA,CETCH)循环,固碳效率经过优化可达5 nmol/(min·mg蛋白),较CBB循环高出十多倍。CETCH 循环由17个酶组成,这17个酶分别来源于古菌域、真细菌域和真核域,这一通路在自然界中并不存在,完全是人工设计的,充分体现了合成生物学的设计理念和应用潜力。
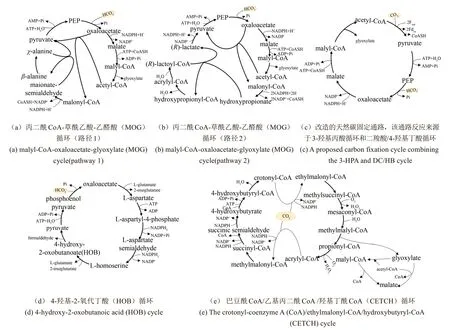
图3 人工设计二氧化碳固定途径Fig.3 Artificially designed carbon dioxide fixation pathways
1.3 固碳供能方式
将二氧化碳固定为化学品或燃料等生物产品本身是一个大量耗能的过程。光能自养生物可以吸收光能并裂解水来产生ATP 和NADPH 作为能量和还原力,通过卡尔文循环、还原性三羧酸循环或3-羟基丙酸循环等固碳途径将二氧化碳转化为有机物。不同类型的光合作用吸收光的波长不同,如产氧光合作用吸收的是短波长光谱,无氧光合作用吸收的是长波长光谱[51]。通过对光能自养微生物的改造,提高光捕获效率或减少能量传递过程中的消耗,可以提高光合作用效率进而提高产物得率。例如,Kirst等[52]通过减小藻胆体光系统捕光天线尺寸将工程蓝藻菌的产量提高了57% 。Zhou 等将一个额外的NADPH 消耗模块引入到蓝藻中,以平衡光合作用产生的ATP 和NADPH,明显提高了光合效率,使得工程蓝藻的生物量提高了39%,最终使异丙醇的产量达到226.9mg/L[53]。此外,Martinez 等在大肠杆菌中构建了变形菌视紫质光系统[54],以及Guo 等构建了可以收集光能产生的电子来进行细胞生长和生产的半导体纳米颗粒-酿酒酵母复合体平台,使得在异养生物中进行光能自养合成成为了可能[55]。
化能自养生物可以氧化环境中的电子供体获得能量,包括氨、氢、还原性碳(CO 和甲酸盐)、硫(S 和H2S)、磷和铁等。化能自养的固碳途径有卡尔文循环、还原性三羧酸循环、还原性乙酰辅酶A 通路、3-羟基丙酸/4-羟基丁酸循环或二羧酸/4-羟基丁酸循环等。在一些化能自养微生物中,在氢化酶(SH)的作用下吸收氢产生ATP 和(或)NADH,如真氧产碱杆菌(Ralstonia eutropha)就是一种典型的由氢产生ATP 和NADH 的微生物。Lamont 等[56]将来源于R. eutropha的氢化酶引入大肠杆菌中并检测到了胞内NADH 的升高,为在大肠杆菌中利用氢自养固定二氧化碳提供了可能。此外,微生物也可以利用电能作为固定碳的能源。电能自养生物的固碳途径有卡尔文循环或还原性乙酰辅酶A 通路。微生物可以直接消耗电子将二氧化碳转化为有机化合物,或者利用电能生产能量载体,如甲酸盐、氢、一氧化碳和甲醇等,以支持细胞生长。2012 年,Li 等报道了以甲酸盐作为生物电化学中间体,在R.eutrophaH16中利用电能作为唯一的能源来源以及二氧化碳为唯一碳源生产高级醇[57]。
2 应用合成生物学改造和设计微生物
2.1 改造可天然利用二氧化碳的微生物
自养微生物可以利用二氧化碳作为主要或唯一的碳源,通过光合作用或化能合成作用获得能量,包括微藻、蓝细菌、古细菌、泉古菌门微生物、变型菌纲微生物等。目前采用一些经过合成生物学改造的光能或化能自养微生物,已经可以实现从二氧化碳合成生产一些燃料和化学品[20]。表1总结了最近合成生物学在改造和设计固碳途径方面的一些重要应用。
2.1.1 微藻
相对于植物,微藻具有更高的光合固碳效率,据报道,1t微藻能够固定高达1.83t的二氧化碳[70]。此外,微藻还具有生长速度快、环境适应性强、油脂含量多等特点,早在20 世纪70 年代就提出利用微藻生产油脂类产品,并得到不断发展。例如,微拟球藻(Nannochloropsissp.)等富油微藻被作为油脂原料通过转酯反应生产生物柴油[71];紫球藻 (Porphyridium cruentum) 和四鞭片藻(Tetraselmis suecica)等微藻作为碳水化合物原料合成乙醇[72-73]; 莱茵衣藻(Chlamydomonas reinhardtii)和普通小球藻(Chlorella vulgaris)等放氢微藻将二氧化碳和光能转换成化学生物氢[74-75];小球藻(Chlorella sorokiniana)等产叶黄素[76],杜氏盐藻(Dunaliella salina)产胡萝卜素[77]等有机色素[78]。近年来合成生物学拓展了微藻合成产品范围。例如,Radakovits 等对三角褐指藻(Phaeodactylum tricornutum)油脂中的脂肪酸组分进行理性设计,提升其转酯后生成的生物柴油的品质[79]。Xin等通过人为设计不同二酰甘油酰基转移酶编码基因(DGAT2)的表达水平,提高了微拟球藻的不饱和脂肪酸的含量,使其更适合作为保健品或食品[80]。Pourmir 等将粗糙脉孢菌(Neurospora crassa)的木糖还原酶导入莱茵衣藻,实现了木糖醇的生产[81]。Lauersen 等组合表达了来源于植物、细菌和酵母的催化酶合成倍半萜化合物[82]。此外,利用合成生物学技术,微藻还用于蛋白类产品生产,如抗体83K7C[83]、疟疾疫苗[84]等重组蛋白。
近年来,合成生物学对微藻自身代谢进行工程化设计优化能源和碳的利用,对固碳效率的研究主要集中在CBB 循环的RuBisCO 酶。例如,Wei 等发现一个可调控RuBisCO 酶的调控因子nRCA,其在微拟球藻中表达可改善其光合效率,显著提高了微拟球藻46%的生物量和32%的生长速率[58]。光系统是由叶绿素、类胡萝卜素、脂和蛋白质组成的复合物,目前光系统对光能利用能力的改善主要集中在对捕光天线蛋白的改造。例如,De Mooij 等[59]和Shin 等[60]分别通过减小莱茵衣藻和普通小球藻捕光天线蛋白提高了10%和65%的光能利用率;Wang 等解析了捕光天线蛋白的结构[85],为人工模拟、改造光系统提供了新的理论依据。

表1 合成生物学在改造和设计固碳途径方面的应用Tab.1 Synthetic biology strategies in designing and engineering CO2-fixation pathways
2.1.2 蓝细菌
蓝细菌是另一种极具潜力的光能自养底盘微生物,具有快速生长、营养需求低、易于改造等特点[86-87]。基于羧酶体的二氧化碳浓缩机制,蓝细菌利用羧酶体可增加RuBisCO 酶周围的二氧化碳浓度(胞内的浓度与胞外比值高达1000倍),进而提高CBB 循环的固碳效率[86]。蓝细菌可以合成许多内源或外源代谢产物,包括氨基酸、脂肪酸和酰胺类化合物。例如,Yunus 等在Synechocystissp.PCC 6803 中过表达了脂肪酸光脱羧酶实现了烷烃和烯烃的高效合成[23]。Xiong 等在Synechocystissp.PCC 6803 中引入了来源于Pseudomonas的乙烯合成酶(ethyleneforming enzyme, EFE),固定了10%的二氧化碳用于合成乙烯[88]。Lee等通过引入乙醇合成途径以及蜡酯合成酶,在Synechococcus elongatusPCC 7942首次实现了异源合成脂肪酸乙酯(fatty acid ethyl esters)[89]。Oliver 等在S. elongatusPCC 7942中建立了从丙酮酸开始的2,3-丁二醇合成新途径,产量达到了2.38g/L[90]。Lai 等将Clostridium的CoA 途径引入S. elongatusPCC 7942实现了丁酸的高效合成[91]。上海交通大学许平团队建立了“蓝细菌内核”概念,利用S. elongatus以二氧化碳为碳源合成了六种不同的天然产物[92]和一系列C3平台化学品[93];该团队最近还在S.elongatus中引入苯乙醇合成途径和人工解反馈抑制模块,实现了苯乙醇的高效合成[94]。
除了直接针对目标产物途径,许多改造蓝细菌以提升其内源代谢物产量的方法主要集中于改善对光能的有效利用、增强二氧化碳固定效率以及优化其抗逆性。在光能利用方面,Nürnberg 等研究了远红外线存在下生长的蓝细菌光系统复合物,确定了相应的叶绿素f,为未来蓝细菌拓展光能利用范围奠定了基础[95]。为提升固碳效率,Liang 等确定了Synechocystissp. PCC 6803 中CBB循环关键酶是RuBisCO 酶、景天庚酮糖-1,7-二磷酸酶(sedoheptulose 1,7-biphosphatase, SBPase)、果糖二磷酸醛缩酶(fructose-bisphosphate aldolase, FBA)和酮糖移转酶(transketolase,TK)四种酶,增强这些酶的表达可以提升52%的生物量积累[61];随后,Liang 等引入乙醇合成途径,在FBA 过表达的菌株中,乙醇产量提升了69%[96]。此外,Durão 等通过蛋白质工程改造了RuBisCO 酶,提高了Synechocystissp.PCC 6803 的光合效率[31];De Porcellinis 等发现SBPase 可影响固碳效率,并探寻了相关机理[97]。与此同时,针对规模化培养或者产物累积造成的不利因素,研究人员主要通过强化内源抗逆机制或者引入相关外源抗逆元件实现其抗逆性的优化。Su 等在S.elongatusPCC 7942 中过表达了压力相关基因hspA和osmotin,该操作显著提高了其对高温、高光、高盐等多种环境压力的耐受能力,使其可以在户外海水中直接培养[98]。丝氨酸羟甲基转移酶和细胞的耐盐性直接相关[99],Waditee-Sirisattha 等将Aphanothece halophytica的丝氨酸羟甲基转移酶引入到S. elongatusPCC 7942 中,在0.3mol/L NaCl存在下,工程菌株的生物量比野生菌株提高了大约1 倍[100]。未来通过揭示更多的代谢机制和挖掘相应的生物元件,进一步结合合成生物学,可实现相应元件的特定时空表达,提升抗逆性、优化固碳效率。
2.1.3 梭菌
梭菌是一种常用的化能自养微生物,通过还原性乙酰辅酶A通路固碳,已成为第三代固碳生物炼制的良好宿主之一。利用梭菌合成的常见产物有丁醇、丁酸、2-氧代丁酸酯和2,3-丁二醇等[20]。例如,Cheng 等在食气梭菌(Clostridium carboxidivorans)过表达了adhE2和fnr两个基因,使丁醇产量提高了约22%[101];Huang等将一个异源丁酸合成基因簇引入到杨氏梭菌(C. ljungdahlii)基因组中整合表达,可稳定高产1.01g/L丁酸[102]。
化能自养生物一般通过环境中的电子供体(如氨、氢、硫、硫化氢、亚铁)来提供能量[103]。最近,利用电能协助梭菌的发酵生产过程,包括生产乙醇[0.18g/(L·d)][104]、异丙醇[0.157g/(L·d)][105]、丁醇/异丁醇[0.013g/(L·d)][106]、乙酸[18.72g/(L·d)][107]、丁酸[0.21g/(L·d)][108]和己酸[0.95g/(L·d)][109]等产品。但是研究人员也发现,电解槽中的二氧化碳浓度非常低,为此Haas 等[110]报道了一种气体扩散电极,可增强与二氧化碳的相互作用,使得梭菌以接近100%的法拉第效率合成丁醇和己醇。
不同产品的合成展现了梭菌作为平台细胞工厂的巨大潜力,LanzaTech 和INEOS 等几家公司利用梭菌开发的部分产品已实现商业化[15]。例如,LanzaTech 与首钢集团京唐钢铁厂合作,利用梭菌将其钢厂废气应用于商业化合成乙醇(年产4.6 万吨)及蛋白饲料(年产5000t)[111]。
2.1.4 古细菌
古细菌通过多种途径利用化能实现二氧化碳固定,除了3-羟基丙酸循环之外,本文中提到的其他固碳途径在古细菌中都有发现[112]。古细菌通过自养利用二氧化碳和氢气生成甲烷是一个古老的代谢反应。利用此特性,有报道嗜热自养甲烷杆菌(Methanothermobacter thermoautotrophicus)利用二氧化碳和氢气生产甲烷[113-114]。古细菌能够在高温高盐等极端环境下存活,具有与普通细菌和真核生物不同的代谢多样性。最近还有一些报道利用嗜热古细菌(Pyrococcus furiosus)在高温下合成乳酸[115]、乙醇[116]、丁醇[117]等目标化合物,但是利用的非自养途径。为了使其完成二氧化碳固定,Keller 等将瑟杜生金属球菌(Metallosphaera sedula)的HP/HB循环引入嗜热古细菌,可在70℃高温下将二氧化碳转化为3-羟基丙酸[62]。越来越多的古细菌代谢途径被解析,将为第三代固碳生物炼制细胞工厂提供宝贵的补充。
2.1.5 其他
罗尔斯通菌(Ralstonia eutropha)又名钩虫贪铜菌(Cupriavidus necator),在化能自养模式下,以二氧化碳作为碳源、以氢气作为能源生长,无需光照即可通过CBB 循环进行碳固定[118]。与大多数RuBisCO 酶不同,罗尔斯通菌的RuBisCO 酶具有较高的二氧化碳固定速率,而且专一性较好[119]。因此,对该酶的深入解析可以帮助我们更好地改造RuBisCO 酶的特性。由于罗尔斯通菌可天然在胞内累积大量的聚羟基链烷酸酯(polyhydroxyalkanoate,PHA),因此PHA为代表的聚酯类聚合物成为其重要产物[86,120]。除此之外,罗尔斯通菌还被用来合成其他化合物,包括从二氧化碳和氢气合成甲基酮[121]、异丙醇[122]、游离脂肪酸[123]、烷烃[124]和饲料蛋白[125]等产品,还可利用同位素标记的二氧化碳生产同位素标记的氨基酸[126]。与此同时,为了增强其对产物的抗逆性,Marc 等[127]通过表达GroESL 分子伴侣基因增强了对异丙醇的耐受性,进而提高了异丙醇的最终产量。
此外,还可以利用电能以协助罗尔斯通菌的发酵生产过程。例如Li 等[57]利用电化学系统从二氧化碳合成甲酸,然后再利用甲酸替代氢气辅助二氧化碳在罗尔斯通工程菌中的固定,最后实现利用二氧化碳作为唯一碳源和电能作为唯一能量输入生产异丁醇和3-甲基-1-丁醇。
2.2 在异养模式细胞中引入利用二氧化碳代谢途径
大肠杆菌(Escherichia coli)、 酿酒酵母(Saccharomyces cerevisiae)、毕赤酵母(Pichia pastoris)等菌株作为重要的工业模式微生物,目前在生物炼制领域得到了广泛应用,用以商业化生产化学品、天然产物、蛋白质等产品[6]。相对于可以天然固定二氧化碳的微生物,这些工业模式微生物具有许多优势。例如大肠杆菌生长速度比蓝细菌快5倍,且具有高效的分子及合成生物学工具、成熟的不同产品合成路线和发酵工艺等[128]。随着代谢工程与合成生物学的发展,研究人员希望把诸如大肠杆菌等模式工业微生物的碳源从有机碳转化为二氧化碳,从而拓展这些微生物应用于第三代固碳生物炼制。因此,在异养模式工业微生物中科学家们设计表达了不同的固碳途径(表1)。例如,Mattozzi 等[63]成功将3-羟基丙酸循环在大肠杆菌表达,并验证其部分活性;Guo 等[64]在大肠杆菌表达了还原性三羧酸循环以增强马来酸的产量;Yishai等在大肠杆菌表达了还原性乙酰辅酶A 通路实现了从甲酸和二氧化碳合成甘氨酸和丝氨酸[47];Guadalupe-Medina 等和Li等分别在酿酒酵母中重建CBB 循环部分途径,使二氧化碳作为碳源之一生产乙醇[65-66];Antonovsky等[67]通过理性设计引入大肠杆菌所缺的CBB 循环两个相关酶,并进行相应代谢网络改造和适应性进化,利用二氧化碳合成了大约35%的生物质。这些研究表明了将异养生物设计转化为自养生物的可行性,对二氧化碳固定途径的设计具有指导意义,但是以上设计改造的菌株尚不能将二氧化碳作为唯一碳源。2019年Gleizer等[68]将一个完整的异源CBB 循环引入大肠杆菌,结合有机碳限制下的适应性进化,并采用电化学得到的甲酸作为能量和电子供体,首次实现了大肠杆菌以二氧化碳为唯一碳源进行生长。与此同时,Gassler 等[69]通过合成生物学改造毕赤酵母将其过氧化物酶体甲醇同化途径改造成类似CBB 循环的固碳途径,利用甲醇作为能量和电子供体,也实现了将二氧化碳作为唯一碳源的“自养”生长。
3 第三代固碳生物炼制的挑战及解决方案
第三代固碳生物炼制以二氧化碳作为化工原料拥有两大优势:一是作为原料,成本低廉且来源丰富;二是对环境友好,可吸收消耗温室气体。相对于从化石资源获得产品,虽然第三代固碳生物炼制的成本目前还比较高,但是由于其可以消耗二氧化碳,目前政府可为其提供一定的减排补贴,第三代生物炼制部分产品已实现商业化[15]。诸多可利用二氧化碳的高效细胞工厂的开发将为我们实现第三代固碳生物炼制、满足低碳可持续发展提供坚实的基础,还为开发火星等拥有二氧化碳的类地星球提供可能,从而带来巨大的经济、社会和环境效益。
第三代固碳生物炼制最大的特点是固定二氧化碳为碳源,目前已经成功挖掘、解析出上文中所提的四类固碳途径,并采取合成生物学、蛋白质工程等手段改进固碳效率[18-19,21,35]。基于这些认识,合成生物学目前已成功将异养微生物转化为新型自养微生物[68-69]。虽然目前固碳效率还不高,且在生物反应器中需要高浓度的二氧化碳,但是随着对自然界中天然固碳途径认识的深入[50],合成生物学研究领域有望在未来设计出比天然途径更加高效的人工固碳途径。
二氧化碳中的碳为+4 价,为了将其转化为生物质或相应产品,必需较高的能量和还原力。在光能自养微生物中,光合作用在能源产生和二氧化碳固定中发挥了重要作用。但是,它需要大面积的表面进行光照,并且受光能捕获效率的限制[129]。对于化能自养微生物,其生物合成过程主要结合电化学系统提供能量[85-91,110],然而该系统面临着电极表面受限、氢气的溶解度低等问题[22]。因此,为生物固碳途径提供高效经济的能量来源将是未来一个重要研究方向。
总之,为了获取可利用二氧化碳的高效第三代固碳生物炼制细胞工厂,还有许多工作去做,主要有:①优化能量捕获技术;②优化、挖掘、设计有效的二氧化碳固定宿主、途径和酶;③开发经济有效的碳转运、碳浓缩机制;④在可利用二氧化碳的天然宿主中开发更多的代谢工程和合成生物学工具;⑤大规模淘汰不必要的途径,扩大产物合成范围,研究二氧化碳利用最小模块。
致谢:感谢科技部及国家自然科学基金委组织的相关项目“国家重点研发计划”及国家自然科学基金对史硕博教授的支持。

