Bmi-1及E-钙黏蛋白在宫颈鳞状细胞癌中的表达及意义
赵莉莉,杨筱青
郑州市妇幼保健院妇产科,郑州 450012
宫颈鳞状细胞癌是女性生殖系统中常见的恶性肿瘤之一,转移和复发是导致其术后死亡的主要原因。最近,越来越多的证据表明,上皮-间充质转化(epithelial-mesenchymal transformation,EMT)是肿瘤转移和复发的关键因素。E-钙黏蛋白(E-cadherin)是一种对细胞连接非常重要的跨膜蛋白,可抑制肿瘤发生和转移,其下调或丢失被认为是EMT的标志。上皮细胞中E-cadherin的减少或丧失导致肿瘤细胞从肿块中脱落,这是癌症侵袭和转移的先决条件[1-2]。文献报道,Bmi-1基因在人类肿瘤中表达上调,并在肿瘤发生和发展过程中发挥重要的致癌作用[3]。Bmi-1可通过调控EMT,促进肿瘤细胞侵袭和转移的能力[4]。但目前Bmi-1和E-cadherin在宫颈鳞状细胞癌组织中的表达及关系国内外文献尚未报道,故本研究检测宫颈鳞状细胞癌组织中Bmi-1、E-cadherin的表达,并探讨其临床意义,现报道如下。
1 资料与方法
1.1 一般资料
收集2011年9月至2012年11月郑州市妇幼保健院收治的宫颈鳞状细胞癌患者的病历资料,所有患者术前均未行放化疗、生物治疗,均经病理检查确诊。共收集宫颈鳞状细胞癌患者138例,年龄28~69岁,中位年龄48岁,≥48岁71例,<48岁67例;高中分化60例,低分化78例;浸润深度:≤1/2 68例,>1/2 70例;无淋巴结转移81例,有淋巴结转移57例;临床分期:Ⅰ期72例,Ⅱ期66例。取138例宫颈鳞状细胞癌患者的宫颈鳞状细胞癌组织,另外取60例因子宫肌瘤行子宫全切术患者的正常宫颈组织。
1.2 检测方法
兔抗人Bmi-1多克隆抗体、鼠抗人E-cadherin多克隆抗体均购自美国Santa Cruz Biotechnology Inc公司,SP试剂盒及二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司。将组织石蜡块制成4 μm厚切片,采用免疫组织化学SP法,按试剂盒说明书进行操作;一抗均按1∶100稀释。用已知阳性片作为对照,用磷酸盐缓冲液(phosphate buffered saline,PBS)代替一抗作为空白对照。
1.3 结果判定
采用双盲法,由两位资深病理科医师同时独立观察每张切片后判定Bmi-1、E-cadherin的表达情况。Bmi-1主要表达于细胞核,呈棕黄色或棕褐色颗粒样染色;E-cadherin主要定位于细胞膜和细胞质,呈棕褐色颗粒样染色。判定标准采用半定量评分法,根据阳性细胞所占百分比(%)和染色强度进行判定。阳性细胞所占百分比:无阳性细胞为0分,<10%为1分,10%~50%为2分,51%~75%为3分,>75%为4分;染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。计算阳性细胞所占百分比评分和染色强度评分的乘积,总分≥4分为阳性。
1.4 随访
随访截止日期为2017年11月,生存时间为手术日期至随访截止日期,或手术日期至因复发、转移而死亡的日期,截尾值指定为0。
1.5 统计学方法
采用SPSS 17.0统计软件进行数据分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;两变量之间的相关性采用Spearman相关性分析;采用Kaplan-Meier绘制生存曲线,Log-rank法比较生存曲线;多因素分析采用Cox风险比例模型;以P<0.05为差异有统计学意义。
2 结果
2.1 正常宫颈组织、宫颈鳞状细胞癌组织中Bmi-1、E-cadherin 表达的比较
宫颈鳞状细胞癌组织中Bmi-1阳性表达率明显高于正常宫颈组织,E-cadherin阳性表达率明显低于正常宫颈组织,差异均有统计学意义(P<0.01)。(图1、表1)
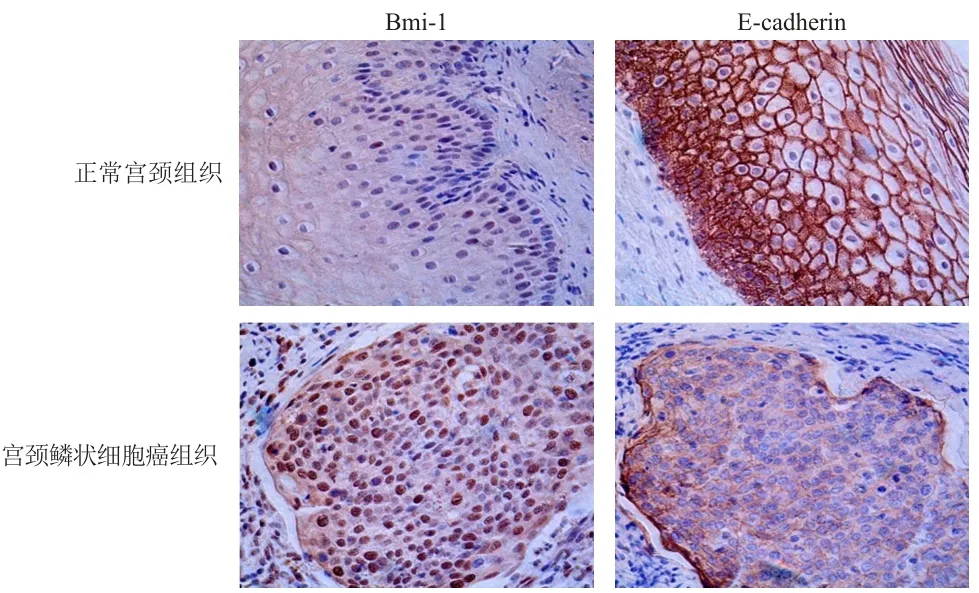
图1 正常宫颈组织、宫颈鳞状细胞癌组织中Bmi-1、E-cadherin的表达(SP,×400)

表1 正常宫颈组织、宫颈鳞状细胞癌组织中Bmi-1、E-cadherin阳性表达情况的比较[n(%)]
2.2 不同临床特征宫颈鳞状细胞癌患者的宫颈鳞状细胞癌组织中Bmi-1、E-cadherin 阳性表达情况的比较
低分化、临床分期为Ⅱ期、浸润深度>1/2、有淋巴结转移的宫颈鳞状细胞癌患者的宫颈鳞状细胞癌组织中Bmi-1阳性表达率均高于高中分化、临床分期为Ⅰ期、浸润深度≤1/2、无淋巴结转移患者,差异均有统计学意义(χ2=9.490、5.337、7.237、18.564,P<0.05);低分化、临床分期为Ⅱ期、浸润深度>1/2、有淋巴结转移的宫颈鳞状细胞癌患者的宫颈鳞状细胞癌组织中E-cadherin阳性表达率均低于高中分化、临床分期为Ⅰ期、浸润深度≤1/2、无淋巴结转移患者,差异均有统计学意义(χ2=10.637、8.970、17.498、18.180,P<0.05);不同年龄的宫颈鳞状细胞癌患者的宫颈鳞状细胞癌组织中Bmi-1、E-cadherin阳性表达率比较,差异均无统计学意义(P>0.05)。(表2)
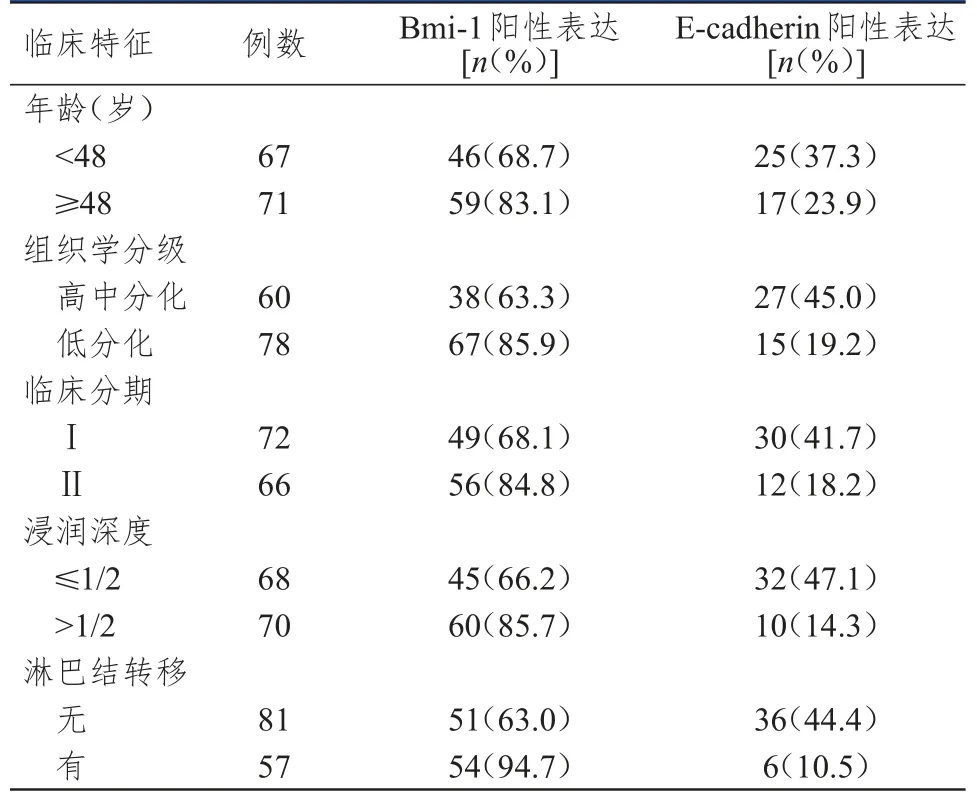
表2 不同临床特征宫颈鳞状细胞癌患者的宫颈鳞状细胞癌组织中Bmi-1、E-cadherin阳性表达情况(n=138)
2.3 宫颈鳞状细胞癌组织中Bmi-1与E-cadherin表达的相关性
Spearman相关性分析显示,宫颈鳞状细胞癌组织中Bmi-1与E-cadherin的表达呈负相关(r=-0.626,P<0.01)。
2.4 Bmi-1、E-cadherin 阳性表达情况与宫颈鳞状细胞癌生存的关系
对138例患者进行随访,失访率为6.5%。Bmi-1阳性表达患者生存时间明显短于阴性表达患者,差异有统计学意义(χ2=28.864,P<0.01)(图 2);E-cadherin阳性表达患者生存时间明显长于阴性表达患者,差异有统计学意义(χ2=24.411,P<0.01)(图3)。
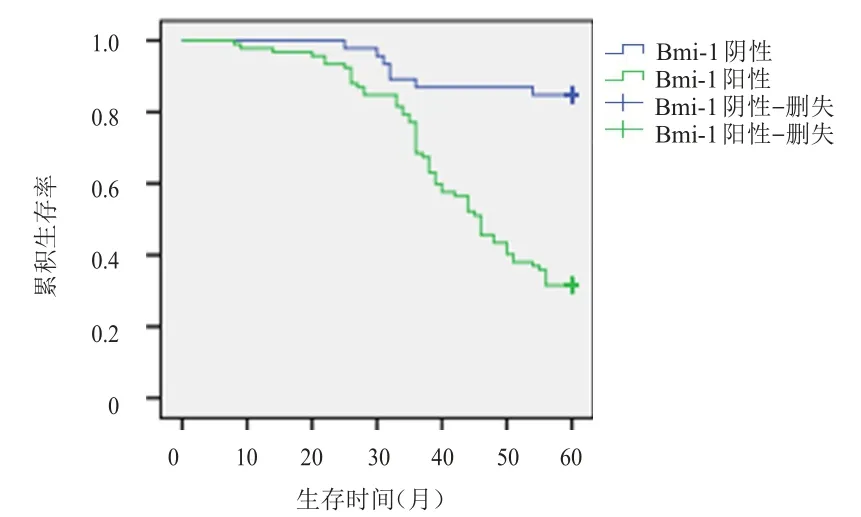
图2 Bmi-1阳性表达(n=105)与阴性表达(n=33)宫颈鳞状细胞癌患者的生存曲线
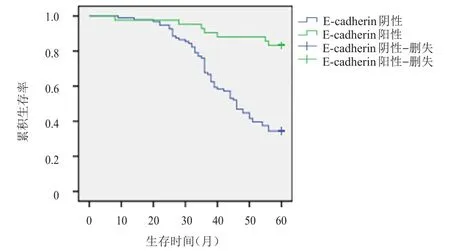
图3 E-cadherin阳性表达(n=42)与阴性表达(n=96)宫颈鳞状细胞癌患者的生存曲线
2.5 宫颈鳞状细胞癌患者预后的多因素分析
将年龄、组织学分级、临床分期、浸润深度、淋巴结转移、Bmi-1表达及E-cadherin表达分别进行多因素Cox回归分析,结果显示,低分化、临床分期为Ⅱ期、有淋巴结转移、Bmi-1阳性表达和E-cadherin阴性表达均为宫颈鳞状细胞癌患者预后的独立危险因素(P<0.05)。(表3)

表3 宫颈鳞状细胞癌患者预后的多因素Cox回归分析(n=138)
3 讨论
人Bmi-l基因位于染色体10p13位点上,DNA 4.9 kb,mRNA 3199 bp,编码蛋白质含有326个氨基酸,相对分子量为36.9 kD[5];作为polycomb基因家族成员,Bmi-l在细胞周期调控、细胞发生和细胞衰老中起关键作用,参与癌症的发生;参与肿瘤细胞的增殖、浸润、远处转移[6]。Allegra等[7]研究发现,Bmi-1在喉鳞状细胞癌中的阳性表达率为84.4%,呈高表达。Li等[8]研究发现Bmi-1在结肠癌组织中的表达与肿瘤的临床分期、浸润深度和转移能力密切相关。本研究结果发现,Bmi-l在宫颈鳞状细胞癌组织中的阳性表达率明显高于正常宫颈组织,提示Bmi-1的高表达与宫颈鳞状细胞癌的发生发展密切相关。进一步分析发现,在宫颈鳞状细胞癌组织中Bmi-1蛋白阳性表达与年龄无关;而低分化、临床分期为Ⅱ期、浸润深度>1/2、有淋巴结转移的宫颈鳞状细胞癌患者的宫颈鳞状细胞癌组织中Bmi-1阳性表达率均高于高中分化、临床分期为Ⅰ期、浸润深度≤1/2、无淋巴结转移患者,差异均有统计学意义(P<0.05),说明Bmi-l的高表达与宫颈鳞状细胞癌的侵袭、转移密切相关;分析其原因可能Bmi-1通过调控EMT,可促进宫颈鳞状细胞癌细胞侵袭和转移的能力[4]。Jiang等[9]研究了在人宫颈癌细胞系HeLa中抑制Bmi-1表达的小干扰RNA(siRNA)的生物学效应,结果发现Bmi-1siRNA可抑制HeLa细胞中Bmi-1RNA和蛋白质表达水平,显著影响体外和体内HeLa细胞的增殖、集落形成和迁移。因此,沉默Bmi-1可以抑制宫颈癌细胞的侵袭、转移能力,Bmi-1可El-Hadaad能是治疗宫颈癌的新型治疗靶点。Abd El hafez和El-Hadaad[10]研究发现卵巢癌细胞中Bmi-1的表达与患者的平均生存率存在显著负相关,Bmi-1高表达的患者生存时间较短,预后差。本研究结果发现,Bmi-1阳性表达患者预后明显差于阴性表达患者,宫颈癌组织中Bmi-1高表达的患者生存率显著下降,提示Bmi-1的高表达与宫颈癌的预后密切相关。多因素Cox分析结果显示,Bmi-1阳性可作为宫颈鳞状细胞癌预后的独立危险因素。因此Bmi-1可能成为预测宫颈鳞状细胞癌转移的分子标志物,为宫颈癌的早期诊断、治疗和预后提供依据。
EMT是肿瘤转移和复发的关键因素。E-cadherin是钙黏蛋白家族的成员之一,是一种对细胞连接非常重要的跨膜蛋白,它抑制肿瘤发生和转移,其下调或丢失被认为是EMT的标志。上皮细胞中E-cadherin的下调或丧失导致肿瘤细胞从肿块中脱落,这是癌症侵袭和转移的先决条件[1-2]。本研究结果显示,E-cadherin表达与宫颈鳞状细胞癌组织的分化程度、临床分期、浸润深度及淋巴结转移有关,即随着恶性肿瘤的分化程度越差、浸润深度越深、临床分期越晚和有淋巴结转移,E-cadherin阳性表达率降低或缺失,因此,E-cadherin的表达降低或缺失,是宫颈鳞状细胞癌浸润、转移的一个重要因素。多因素Cox分析结果显示,E-cadherin可作为宫颈鳞状细胞癌预后的独立危险因素。
Zhang等[11]研究结果表明Bmi-1通过下调E-cadherin诱导EMT,促进结肠癌细胞的侵袭和迁移。本研究结果提示宫颈癌细胞中Bmi-1高表达,E-cadherin低表达,且二者呈负相关,因此,可以推测Bmi-1可能通过抑制E-cadherin的表达诱导EMT,促进宫颈癌细胞的侵袭和转移,其具体机制有待进一步研究。
综上所述,Bmi-1、E-cadherin可能成为宫颈鳞状细胞癌的新型治疗靶点和预测宫颈鳞状细胞癌患者预后的新指标。

