2型糖尿病诊疗进展——全科医师需知
田宏扬 谷成英
摘 要 糖尿病是当前威胁全人类健康的慢性非传染性疾病之一,中国糖尿病患病人数已跃居世界第一,负担极为沉重。近年来,国内外糖尿病领域进展十分迅速,对临床工作产生了较大影响,随着循证医学证据积累,糖尿病相关指南也发生了很大的变化。由于大量糖尿病患者在基层,全科医师已成为糖尿病防治的主力军。本文结合我国2型糖尿病及相关并发症的最新防治指南和2019年美国糖尿病学会诊疗标准,综述近年来糖尿病研究新进展、2型糖尿病诊疗及其常见并发症的预防,供全科医师在糖尿病防治工作中参考。
关键词 2型糖尿病;全科医师;诊断;治疗
中图分类号:R587.1 文献标志码:A 文章编号:1006-1533(2020)12-0009-09
Progress in the diagnosis and treatment of type 2 diabetes—a note for general practitioners
TIAN Hongyang, GU Chengying
(Pudong Hospital of Shanghai, Shanghai 201399, China)
ABSTRACT Diabetes is one of the chronic non-communicable diseases that currently threaten the health of all human beings,the number of diabetes patients in China has jumped to the first place in the world, and the burden is extremely heavy. In recent years, progress in the field of diabetes at home and abroad has been very rapid, which has greatly affected clinical work, and with the accumulation of evidence-based medicine, the guidelines of diabetes have changed a lot. Because a large number of diabetic patients are at the grassroots level, general practitioners have become the main force in the prevention and treatment of diabetes. Combining the latest prevention and treatment guidelines for type 2 diabetes and related complications in China and the diagnosis and treatment standards of the American Diabetes Society in 2019, this paper reviews the recent progress of diabetes research, the diagnosis and treatment of type 2 diabetes and the prevention of its common complications for providing the reference for general practitioners in the prevention and treatment of diabetes,
KEY WORDS type 2 diabetes; general practitioner; diagnosis; treatment
糖尿病的主要病理改變是胰岛素分泌缺陷或胰岛素作用缺陷,是以高血糖为主要特征并伴有多种异常的临床代谢综合征。国际糖尿病联盟(IDF)发布的世界糖尿病地图(第8版)显示,全球约4.25亿20岁以上成人患有糖尿病,2045年这一数字预计将增长至6.29亿[1]。在经济高速发展、生活方式改变和老龄化等多种因素影响下,我国糖尿病患病率逐年递增,患病人数已跃居世界第一,成年糖尿病患者超过1亿,糖尿病负担极为沉重,这为我国的糖尿病防控工作带来极大的挑战。提高糖尿病的诊疗水平,早预防、早诊治、早达标,已成为患者个人、医疗卫生机构以及政府和社会共同努力、积极探索的方向。本文综述近年来2型糖尿病诊疗的进展,以期为一线全科医师提供科学参考,对糖尿病及其并发症的防治工作提供帮助。
1 糖尿病的诊断
目前国际通用糖尿病的诊断标准和分类仍按世界卫生组织(WHO,1999年)标准(表1~2)。
理想的诊断是同时检查空腹血糖及葡萄糖耐量试验(OGTT)后2 h血糖值。2003年美国糖尿病学会(ADA)建议将IFG的空腹血糖调整为≥5.6 mmol/L,已达到IFG的人群建议行OGTT检查,以提高糖尿病的诊断率。暂时性血糖增高,须在应激消除后复查,检测糖化血红蛋白(HbA1c)有助于诊断。
2010年ADA指南将HbA1c≥6.5%作为糖尿病诊断标准之一。2011年WHO建议在条件具备的国家和地区采用这一切点诊断糖尿病[2]。2019年ADA标准在既往诊断标准的基础上,进行了补充修订,主要是针对无明确高血糖的情况,既往标准规定需要两次不同样本的检测结果均达到诊断切点,本次新增也可以是同一样本的两种检测结果达到诊断切点[3],例如同一样本的空腹血糖≥7.0 mmol/L和HbA1c≥6.5%。在我国,如何界定适合中国人的HbA1c切点、如何将其测定方法标准化,成为了争议的焦点[4]。因此,在我国目前HbA1c不作为诊断标准。
2 2型糖尿病综合控制目标
2型糖尿病患者常合并代谢的一个或多个组分异常,如高血压、血脂异常、肥胖症等,使糖尿病慢性并发症的发生风险、发展速度及危害等显著增加。因而,2型糖尿病的治疗策略应该是综合性的,控制目标视患者的年龄、病程、合并症、并发症等不同而异(表3),控制指标的任何改善对患者都将有益,将会降低相关危险因素引发并发症的风险。
应为患者制定个体化HbA1c控制目标。对大多数非妊娠成人2型糖尿病患者,HbA1c的合理控制目标为<7%。而对病程较短、预期寿命较长、无明显心血管疾病(CVD)等患者,可制定更严格的HbA1c控制目标(如<6.5%,甚或尽可能接近正常),其前提是无低血糖或其他不良反应。对于有严重低血糖病史、预期寿命有限、有显著的微血管或大血管并发症,或有严重合并症、糖尿病病程很长的患者,应采用较为宽松的HbA1c目标(如<8.0%)。在治疗调整中,可将HbA1c≥7%作为启动临床治疗或调整治疗方案的重要判断标准。
3 降糖治疗
3.1 血糖监测
反映降糖治疗的效果并指导治疗方案的调整。HbA1c在治疗之初建议每3个月检测1次,一旦达到治疗目标可每6个月检测1次。患者在家中自我血糖监测(SMBG),可便利地了解血糖的控制水平和波动情况。2019年ADA标准继续强调了SMBG在糖尿病管理中的重要性。SMBG的频率应根据患者实际病情、治疗目标和治疗方案决定:(1)因血糖控制非常差或病情危重而住院治疗者应每天监测4~7次血糖或根据治疗需要监测血糖。(2)采用生活方式干预控制者,可根据需要通过血糖监测了解饮食控制和运动对血糖的影响调整饮食和运动。(3)使用口服降糖药者可每周监测2~4次空腹或餐后2 h血糖。(4)使用胰岛素者可根据治疗方案进行相应的血糖监测:使用基础胰岛素者应监测空腹血糖,根据空腹血糖调整睡前胰岛素的剂量;使用预混胰岛素者监测空腹和晚餐前血糖,根据空腹血糖调整晚餐前胰岛素剂量,根据晚餐前血糖调整早餐前胰岛素剂量,空腹血糖达标后,注意监测餐后血糖以优化治疗方案;使用餐时胰岛素者应监测餐后血糖或餐前血糖,并根据餐后血糖和下一餐前血糖调整上一餐前的胰岛素剂量[5]。(5)特殊人群(围手术期患者、低血糖高危人群、危重症患者、老年患者、1型糖尿病、妊娠期糖尿病等)的监测,血糖控制标准更严格,实施个体化监测方案。
3.2 治疗策略
在饮食和运动不能使血糖控制达标时应及时采用药物治疗。先单药治疗,首选二甲双胍。若无禁忌证,二甲双胍应一直保留在糖尿病的治疗方案中[6]。不适合二甲双胍治疗者可选择a-糖苷酶抑制剂或胰岛素促泌剂。如单独使用二甲双胍治疗而血糖仍未达标,则可进行二联治疗,加用胰岛素促泌剂、a-糖苷酶抑制剂、DPP-4抑制剂、TZDs、SGLT2抑制剂、胰岛素或GLP-1受体激动剂。三联治疗:上述不同机制的降糖药物可以三种联合使用。如三联治疗控制血糖仍不达标,则应将治疗方案调整为多次胰岛素治疗(基础胰岛素加餐时胰岛素或每日多次预混胰岛素)。
3.3 合并肾功能不全时药物的选择
3.3.1 二甲双胍
二甲双胍本身不会对肾功能有影响,但在肾功能不全时,可能在体内蓄积,甚至引起乳酸性酸中毒。在预估肾小球滤过率(eGFR)为45~59 ml·min-1·1.73m-2时减量,eGFR<45 ml·min-1·1.73m-2时禁用[7]。美国/欧洲糖尿病学会联合建议放宽二甲双胍用于中度肾功能不全2型糖尿病患者的限制,仅在eGFR<30 ml·min-1·1.73m-2患者中禁用,eGFR在30~45 ml·min-1·1.73m-2的患者依然安全,但应减少药物剂量。对于eGFR在45~60 ml·min-1·1.73m-2的糖尿病肾病(DKD)患者,使用造影剂前或全身麻醉术前48 h应暂时停用二甲双胍,完成至少48 h后复查肾功能无恶化可继续用药。
3.3.2 磺脲类
大部分磺脲类药物由肝脏代谢,经肾脏排泄,因此在肾功能受损时可能蓄积,使低血糖风险增加,应加强血糖监测。多数磺脲类在慢性肾脏病(CKD)1~2期无需调整剂量,3期减量,4~5期禁用。格列喹酮通过胆汁在粪便中排出,仅有5%通过肾脏排出,CKD 1~3期无需调整剂量,4期需谨慎用药,5期禁用。
3.3.3 格列奈类
瑞格列奈主要经肝脏代谢,通过胆汁排泄,少部分经肾排泄,可应用于肾功能不全患者,但CKD 4、5期或肾脏移植、透析者,建议减少剂量,以降低低血糖风险。那格列奈主要在肝脏代谢,83%经尿液排泄,轻、中度肾脏损害无需调整剂量,在CKD 5期患者,其活性代谢产物蓄积,应谨慎使用[8]。
3.3.4 TZDs
TZDs主要经肝脏代谢,大部分吡格列酮经胆汁由粪便清除。罗格列酮可被完全代谢,无原形药物从尿中排出,肾功能下降的患者无需调整剂量。严重肾功能障碍应禁用吡格列酮。需要注意的是,TZDs可增加水钠潴留风险,心功能Ⅲ~Ⅳ级的患者,不宜使用。
3.3.5 a-糖苷酶抑制剂
a-糖苷酶抑制剂一般对肾功能无影响,但随着肾功能降低,血药浓度显著增加。eGFR<25 ml·min-1·1.73m-2应禁用阿卡波糖,eGFR<30 ml·min-1·1.73m-2慎用伏格列波糖。
3.3.6 SGLT2抑制剂
达格列净及相关代谢产物主要经肾脏清除,一般CKD 3~5期不推荐使用。恩格列净和卡格列净经粪便和尿液消除,前者eGFR<45 ml·min-1·1.73m-2时禁用,后者eGFR在45~60 ml·min-1·1.73m-2时限制使用,剂量为每日100 mg,eGFR<45 ml·min-1·1.73m-2的患者不建議使用。多项研究证实SGLT2抑制剂使肾脏终点的风险下降,具有降糖以外的肾脏保护作用[8]。
3.3.7 DPP-4抑制剂
利格列汀主要以原形通过肠肝系统排泄,使用不受肾功能降低的影响,用于CKD 1~5期的患者均无需调整剂量。西格列汀主要以原形从尿中排泄,eGFR>50 ml·min-1·1.73m-2无需调整剂量,eGFR在30~50 ml·min-1·1.73m-2剂量减半,eGFR<30 ml·min-1·1.73m-2减为1/4剂量。沙格列汀在肝脏代谢,通过肾和肝排泄,eGFR<45 ml·min-1·1.73m-2剂量减半。维格列汀代谢后约85%通过尿液排泄,中度或重度肾功能不全患者剂量减半。阿格列汀主要以原形通过尿液排泄,中度肾功能受损患者剂量减半,重度患者使用1/4剂量。有研究显示DPP-4抑制剂可能具有降低尿白蛋白的作用[9],但能否减少终末期肾病(ESRD)等肾脏终点事件风险尚缺乏证据。
3.3.8 GLP-1受体激动剂
这类药物均可应用于CKD 1~3期患者,ESRD患者不建议使用。有随机对照研究观察了GLP-1受体激动剂在心血管高风险2型糖尿病患者中的心血管安全性,其肾脏结局(次级终点)显示GLP-1受体激动剂可降低肾病风险,延缓肾脏疾病进展。GLP-1受体激动剂是否具有降糖之外的肾脏获益,尚需等待以肾脏事件为主要终点的临床研究证实[7]。
3.4 合并心血管病变时药物的选择
中国2型糖尿病防治指南(2017版)在二甲双胍基础上进行二联治疗的药物选择上没有优先顺序,需根据患者的个体化进行决定。临床研究结果显示,磺脲类的使用与糖尿病微血管病变和大血管病变发生的风险下降相关[10]。TZDs有改善血脂谱、提高纤溶系统活性、改善血管内皮细胞功能等作用,对心血管系统有保护作用[11]。研究表明TZDs的使用与骨折和心力衰竭风险增加相关[12],有心力衰竭(纽约心脏学会心功能分级Ⅱ级以上)及严重骨质疏松和有骨折病史的患者应禁用。西格列汀、沙格列汀、阿格列汀不增加心血管病变发生风险[3]。
2019年的ADA标准指出,在生活方式和二甲双胍治疗之后,二线治疗应首先根据患者的合并症情况选择药物。在合并ASCVD的患者中,推荐在二甲双胍和心血管风险因素综合管理基础上,二联治疗时优选已证实具有CVD获益的降糖药,包括SGLT2抑制剂或GLP-1受体激动剂。并不是同一类药物中所有药物都被证实能够在ASCVD上获益,ADA指南中根据循证医学证实获益的确定性(并非获益程度大小)进行了排序,对于GLP-1受体激动剂的证据级别为利拉鲁肽>索马鲁肽>艾塞那肽周制剂;对于SGLT2抑制剂的证据级别为恩格列净>卡格列净[4]。GLP-1受体激动剂和SGLT2抑制剂在优先选择顺序上是平行关系。在二联治疗基础上三联药物的选择,是优先选择在二联治疗中尚未使用过的GLP-1受体激动剂或SGLT2抑制剂,还是其他类型的药物,需要更多循证医学的证据。
对于只有心血管高危因素而没有ASCVD的糖尿病人群,目前并没有充分的循证医学证据支持二联治疗应该首选GLP-1受体激动剂或SGLT2抑制剂。
3.5 胰岛素
在生活方式和口服降糖药联合治疗基础上,若血糖仍未达到控制目标,应尽早开始胰岛素治疗。以下情况应考虑起始胰岛素治疗。(1)经生活方式干预和较大剂量多种口服降糖药联合治疗,血糖仍未达控制目标(HbAlc≥7.0%);(2)在糖尿病病程中,出现无明显诱因的体重显著下降;(3)新诊断2型糖尿病患者如有明显的高血糖症状、发生酮症或酮症酸中毒,可首选胰岛素治疗,可以联用或不联用其他药物,待血糖得到良好控制和症状显著缓解后再根据病情确定后续的治疗方案。可根据患者的具体情况,选择基础胰岛素或预混胰岛素:(1)当仅使用基础胰岛素治疗时,保留原有各种口服降糖药物,不必停用胰岛素促泌剂,联合中效人胰岛素或长效胰岛素类似物睡前注射,起始剂量为0.1~0.3 U·kg-1·d-1,根据患者空腹血糖水平调整胰岛素用量,通常每3~5 d调整1次,根据血糖水平每次调整1~4 U直至空腹血糖达标[13]。(2)使用预混胰岛素时,根据患者的血糖水平,选择每日1~2次的注射方案。每日1次预混胰岛素的起始剂量一般为0.2 U·kg-1·d-1,晚餐前注射,根据患者空腹血糖水平调整胰岛素用量。每日2次预混胰岛素的起始剂量一般为0.2~0.4 U·kg-1·d-1,按1∶1的比例分配到早餐前和晚餐前,根据空腹血糖和晚餐前血糖分别调整早餐前和晚餐前的胰岛素用量[14]。
胰岛素替代治疗的适应证主要包括:2型糖尿病患者β细胞功能明显减退、口服降糖药治疗反应差伴体重减轻或持续性高血糖、难以分型的消瘦糖尿病等。治疗方案可为每天注射2次预混胰岛素或预混胰岛素类似物;也可以采用餐时+基础的多次皮下注射胰岛素、每日3次预混胰岛素类似物或持续皮下胰岛素输注(CSII,胰岛素泵)方案等。
短期胰岛素强化治疗[15]:对于HbA1c≥9.0%或空腹血糖≥11.1 mmol/L伴明显高血糖症状的新诊断2型糖尿病患者可实施短期胰岛素强化治疗,治疗时间在2周至3个月为宜,治疗目标为空腹血糖4.4~7.0 mmol/L,非空腹血糖<10.0 mmol/L,可暂时不以HbA1c达标作为治疗目标。强化治疗方案包括基础-餐时胰岛素治疗(多次皮下注射胰岛素或CSII)或预混胰岛素每天注射2或3次。采用强化胰岛素治疗时,低血糖发生率增加,应注意避免、及早识别和处理。2岁以下幼儿、老年患者、已有严重并发症者均不宜采用强化胰岛素治疗。
总而言之,可先为患者制订试用方案,逐渐调整至达到良好血糖控制。
4 常见并发症的筛查和预防
4.1 心脑血管疾病
糖尿病患者经常伴有高血压、血脂紊乱等心脑血管病变的重要危险因素,与非糖尿病人群相比,发生心脑血管疾病的风险增加2~4倍[16]。臨床证据显示,对多重危险因素的综合控制可显著改善糖尿病患者心脑血管病变和死亡发生的风险[17]。
4.1.1 筛查
糖尿病确诊后,至少应每年评估心血管病变的风险因素,包括心血管病现病史及既往史、年龄、有无心血管危险因素(吸烟、高血压、高血脂、肥胖特别是腹型肥胖、心血管疾病的家族史)、肾脏损害(尿白蛋白排泄率增高等)、心房颤动(可导致脑卒中)。对大血管疾病风险较高的患者行心电图、血管超声、心脏超声等进一步检查评估病变情况。
4.1.2 危险因素的控制
4.1.2.1血压管理
糖尿病与高血压的并存使心脑血管病的发生和进展风险明显增加,增加了患者的病死率。控制高血压可显著降低糖尿病并发症发生和发展的风险[18]。我国指南建议一般糖尿病合并高血压者降压目标应<130/80 mmHg;老年或伴严重冠心病的糖尿病患者,可采取相对宽松的降压目标值,放宽至<140/90 mmHg[3]。
2019年ADA诊疗标准推荐,对于具有较高心血管风险,即现有动脉硬化性心血管疾病(ASCVD)或10年ASCVD风险>15%的患者,降压目标为<130/80 mmHg;对于10年ASCVD风险<15%者,降压目标为<140/90 mmHg。
降压药物选择时应综合考虑降压效果、心脑肾的保护作用、安全性和依从性以及对代谢的影响等因素。五类降压药物[血管紧张素转换酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、利尿剂、钙拮抗剂、β受体阻滞剂]均可用于糖尿病患者:(1)ACEI或ARB为首选,在发挥降压作用的同时,还可提高肌肉和脂肪对胰岛素的敏感性,一定程度上起到改善糖脂代谢的作用[19],但血肌酐、血钾明显升高者禁用。(2)β-受体阻滞剂在治疗过程中会使脂质代谢发生紊乱,导致胰岛素产生抵抗,引起血糖升高[20]。但大量研究显示,β1受体的选择性越高对血压控制的效果越好,且不会对糖代谢造成较大影响[21]。(3)钙拮抗剂的降压疗效明显,而且对糖脂代谢没有影响。对于患有缺血性心脏病、脑血管功能障碍的2型糖尿病合并高血压患者是较好的降压药,而且有肾脏保护作用,可以延缓糖尿病肾病的进展[19]。(4)噻嗪類利尿剂易导致低钾血症,并可激活肾素-血管紧张素-醛固酮系统(RAAS)以及对糖、脂肪和电解质代谢有不利影响。据研究,小剂量的利尿剂不会对糖脂代谢和电解质代谢造成影响,因此在用药时应当慎重选择剂量。
为达到降压目标,通常需要多种降压药联合应用。联合用药推荐以ACEI或ARB为基础的降压方案[22]。在联合方案中更推荐单片固定复方制剂(ARB/钙拮抗剂或ARB或ACEI/利尿剂),在疗效、依从性和安全性方面均优于上述药物自由联合。
4.1.2.2调脂
2型糖尿病患者常有血脂异常,表现为血三酰甘油(TG)和极低密度脂蛋白胆固醇(VLDL)水平升高,游离脂肪酸(FFA)水平升高,高密度脂蛋白胆固醇(HDL-C)水平下降,持续性餐后高脂血症以及低密度脂蛋白胆固醇(LDL-C)水平轻度升高,小而密的LDL和小而密的HDL均增加[23]。这些血脂代谢异常是引起糖尿病血管病变的重要危险因素。
血脂异常与生活方式有密切关系,积极干预生活方式是防治血脂异常和ASCVD的基础,应贯穿整个2型糖尿病的治疗过程[24]。健康的生活方式包括减少饱和脂肪酸、反式脂肪酸和胆固醇的摄入;增加n-3脂肪酸、黏性纤维、植物固醇/甾醇的摄入;减轻体重;增加运动及戒烟、限酒等。
在生活方式干预6个月后,血脂水平仍不正常或出现动脉粥样硬化症状,或有其他CVD危险因素,应考虑启动调脂药物治疗;对>40岁的糖尿病患者或曾确诊为动脉粥样硬化、或有CVD病史、或有经皮冠状动脉介入治疗(PCI)病史、或合并靶器官损害的糖尿病患者在实施生活方式干预的同时应立即启动调脂药物治疗。推荐降低LDL-C作为首要目标,HDL-C作为次要目标。依据患者ASCVD危险高低,推荐:①极高危组:有明确ASCVD病史,包括ACS、心肌梗死(MI)、血运重建术后等,LDL-C的控制目标是<1.8 mmol/L。②高危组:年龄>40岁,无ASCVD病史,具有1个或多个CVD危险因素,如吸烟、高血压、血脂异常、一级亲属心血管病家族史,LDL-C的控制目标是<2.6 mmol/L[3]。
首选他汀类调脂药,起始宜应用中等强度他汀(我国2016年血脂指南将每日剂量可降低LDL-C水平25%~50%的不同种类他汀定义为中等强度他汀类[25]),根据调脂疗效和耐受情况适当调整剂量,若胆固醇水平不能达标,与其他调脂药物联合使用(如依折麦布)可获得安全有效的调脂效果。如果LDL-C基线值较高,现有调脂药物标准治疗3个月后难以使LDL-C降至目标值,则可将LDL-C至少降低50%作为替代目标。临床上也有部分极高危患者LDL-C基线值已在基本目标值以内,这时可将其LDL-C从基线值降低30%左右。LDL-C达标后,若TG水平仍较高(2.3~5.6 mmol/L),可在他汀治疗的基础上加用降低TG药物如贝特类(以非诺贝特首选)或高纯度鱼油制剂。如果空腹TG≥5.7 mmol/L,为了预防急性胰腺炎,首先使用降低TG的药物[26]。
4.1.2.3抗血小板
2019年ADA标准继续推荐将小剂量阿司匹林(75~162 mg/d)作为有ASCVD病史的糖尿病患者的二级预防策略,若患者对阿司匹林过敏,则可用氯吡格雷(75 mg/d)替代;急性冠状动脉综合征发生后,推荐进行为期1年的双联抗血小板药物治疗(低剂量阿司匹林和氯吡格雷)。
中国2型糖尿病防治指南(2017版)建议:阿司匹林(75~100 mg/d)作为一级预防用于糖尿病的心血管高危患者,包括年龄≥50岁,而且合并至少1项主要危险因素(早发ASCVD家族史、高血压、血脂异常、吸烟或蛋白尿)。研究显示,心血管获益和大出血风险增加的绝对风险相似[27],2019年ADA标准指出:一级预防在心血管风险增高的患者可考虑阿司匹林治疗,但需告知可能的获益与出血的风险,由患者仔细权衡利弊后作出决定。出血风险增加的患者包括老年、贫血和合并肾脏疾病的患者。在超过70岁患者中,可能风险超过获益。因此,在一级预防中阿司匹林推荐使用于心血管高风险且出血风险小的患者中,通常不推荐于老年患者。
4.2 糖尿病肾病
DKD是指由糖尿病所致的CKD,通常是根据尿白蛋白升高和(或)eGFR下降、同时排除其他CKD而作出的临床诊断。我国有20%~40%的糖尿病患者合并DKD,现已成为CKD和终末期肾病的主要原因[28]。
4.2.1 筛查
2型糖尿病患者在诊断时即可伴有肾病,确诊2型糖尿病后应立即进行肾脏病变筛查,包括尿常规、尿白蛋白/肌酐比值(UACR)和血肌酐(计算eGFR),以后每年至少筛查一次。
随机尿UACR≥30 mg/g为尿白蛋白排泄增加,即白蛋白尿。在3~6个月内重复检查UACR,3次中有2次尿白蛋白排泄增加,排除感染等其他因素即可诊断白蛋白尿。白蛋白尿对于预测DKD进展存在一定局限性[29],作为诊断依据时需进行综合判断,多次检测并结合eGFR长期随访,且需排除其他可引起白蛋白尿的病因。
4.2.2 诊断
DKD通常是根据UACR升高和(或)eGFR下降、同时排除其他CKD而作出的临床诊断。确诊DKD后,应根据eGFR进行严重程度分期(表7)。
肾脏病改善全球预后(KDIGO)指南建议,联合CKD分期(G1~G5)和白蛋白尿分期(A1期为UACR<30 mg/g,A2期为UACR 30~300 mg/g,A3期为UACR>300 mg/g)描述和判定DKD的严重程度。例如,当糖尿病患者eGFR为70 ml·min-1·1.73m-2、UACR 80 mg/g,则为DKD G2A2。
4.3 糖尿病视网膜病变
糖尿病视网膜病变(DR)是糖尿病最常见的微血管并发症之一,也是处于工作年龄人群第一位的不可逆性致盲性疾病。DR筛查对于糖尿病患者十分必要,早发现、早治疗可有效降低DR致盲风险。目前临床传统的DR检查方法包括眼底照相、激光扫描眼底镜、眼底荧光素血管造影、光学相干断层扫描等,近年来计算机辅助DR自动检测等技术也备受关注。
4.3.1 眼底照相
其优点为操作简单、直观且诊断准确性较高,并能客观地显示视网膜图像。彩色眼底相机是目前临床上最常用的眼底检测手段之一。临床中用于检查DR的彩色眼底照相大多无需散瞳。由于免散瞳眼底照相操作简单、省时省力,且敏感度和特异度较高,可作为筛查DR的有效工具[30]。
4.3.2 眼底荧光素血管造影
眼底荧光素血管造影(FFA)是目前临床评估视网膜微血管的金标准。FFA可观察到30°~55°的视网膜范围,而超广角眼底荧光素血管造影(UWF FA)可显示周边200°的视网膜范围,并可观察到外周毛细血管无灌注区域。但UWF FA复杂、有创,且存在造影剂过敏风险,故不适用于大规模DR筛查中[31]。
4.3.3 激光扫描眼底镜
激光扫描眼底镜(SLO)是利用激光扫描视网膜从而获得眼底图像,尤其适用于晶状体混浊的患者。超广角激光扫描眼底镜是一种新型的免散瞳眼底成像设备,在白内障等晶状体浑浊或瞳孔直径缩小至2 mm的情况下,也可拍摄到眼底的清晰图像。Wilson等[32]的研究表明,在DR诊断方面,超广角激光扫描眼底镜的有效性良好,可用于DR筛查。
4.3.4 光学相干断层扫描
光学相干断层扫描(OCT)可以定量、定性评估糖尿病视网膜病变。它已成为诊断及观察糖尿病黄斑水肿最重要的影像学工具[31]。有研究对比OCT和FA检查对非增殖性糖尿病视网膜病变(NPDR)的诊断率,OCT对NPDR的诊断率为88%,FA为100%[33]。可见OCT可作为DR筛查的有效工具。
4.3.5 DR自动筛查系统
DR自动筛查系统是通过计算机视觉的相关技术来辅助医生判别和精准提取眼底影像的病变指标,智能分析、检测DR特征性病变,采用国际临床分期标准,完成对眼底影像的自动分级诊断,实现自动筛查。相比传统的人工筛查,DR自动筛查系统能够快速、客观、重复地识别DR,并可以对需要行进一步眼科治疗的患者进行分类。随着信息技术飞速发展,越来越多人开始研究DR自动筛查系统。
2型糖尿病患者应在诊断后进行首次综合性眼检查。随后,无DR者至少每1~2年进行复查,DR者应增加检查频率。
4.4 糖尿病周围神经病变
糖尿病病程在10年以上者,常有明顯的神经病变临床表现,其发生风险与糖尿病病程、血糖控制不佳等相关。糖尿病周围神经病变(DPN)是指周围神经功能障碍,包含脊神经、颅神经及植物神经病变,其中以远端对称性多发性神经病变最具代表性。由于半数DPN患者没有临床症状,建议所有2型糖尿病患者确诊时应进行DPN筛查,随后至少每年筛查一次。5项筛查、单丝检查、音叉检查可用于DPN的初筛,适合大流量的门诊。
4.4.1 简易筛查方法
DPN 5项筛查包括温度觉、振动觉、针刺觉、压力觉和踝反射,是临床中最常用的DPN的筛查和诊断方法。我国学者对DPN 5项筛查简化为3项并进行多中心研究,证实踝反射、震动觉及温度觉3项组合筛查DPN的敏感性和特异性与5项筛查全部应用相当[34]。最常用的方法为用128 Hz音叉评估震动觉(大纤维功能)以及10 g尼龙丝评估压力觉以明确足溃疡和截肢的风险,更适用于基层医疗单位或大规模人群筛查。NDS、NSS以及密歇根神经病变筛查工具(MNSI)等各种量表评估筛查,因为很费时,在门诊中开展困难,更多用于住院患者的筛查及DPN的疗效及流行病学研究[35-36]。
4.4.2 神经电生理检查
神经电生理检查(NET)是临床诊断DPN常用的检查方法,包括神经传导速度(NCV)、体感诱发电位(SEP)、皮肤交感反应(SSR)等多项检查内容,其中以NCV的检出率最高[37]。NCV是公认的诊断DPN的“金标准”,但是阴性结果不能排除DPN,临床上还需要结合其他检查综合判断。当近端神经损害时神经传导难以检测出异常,SEP可以一定程度上弥补这一点。NCV对早期末梢神经病变的筛查存在一定的局限,SSR一定程度上弥补了NCV的不足。有研究表明,SSR对临床疑似和无症状DPN的诊断较NCV检查更占优势[38]。NET操作复杂,价格昂贵,检查过程中患者会有不适感,在门诊和社区较难开展,使DPN的早期广泛筛查受限。
4.4.3 定量感覺检查
临床上常用的是简化版定量感觉检查(QST),主要包括定量温度觉检查和定量震动觉检查两个方面。有研究表明,在DPN早期诊断中QST较NCV更为敏感[39],可以与NCV相互补充。但是QST反映的是患者的主观感受,对环境和患者的配合都有着比较高的要求。
4.4.4 其他检查
近年来,高频超声技术日渐成熟,可以反映神经的走行和形态结构的改变,一定程度上补充了NET检查在神经形态学方面的不足。相对NET廉价易行,但是对操作者本身的临床经验、操作技能和解剖学功底都提出了较高要求。角膜共聚焦显微镜在诊断小神经病变中有着重要价值,可以弥补NCV对小神经纤维病变诊断的不足,有利于DPN的早期诊断及严重程度评估,但是需要专科专业人员操作,在临床上应用受限。
4.5 糖尿病足病
我国糖尿病足溃疡(DFU)的年发病率为8.1%,年复发率为31.6%,年死亡率为14.4%[40]。糖尿病足病治疗困难,但相对容易识别,预防比较有效,重在早期筛查和预防。
4.5.1 筛查
早期筛查并矫正糖尿病足病危险因素对避免及延缓糖尿病足的发生具有关键作用。整体危险因素包括男性、糖尿病长病程、吸烟、视力障碍、代谢紊乱、并发症与合并症多,此类患者需重点关注足部情况。局部危险因素多是导致DFU的诱因,如DPN、周围动脉病变、足的生物力学异常、足溃疡病史、截肢史等。DPN、下肢动脉病变(LEAD)是DFU发病风险增加的主要原因,DPN筛查上文已介绍,下面介绍LEAD的筛查。
对于50岁以上的糖尿病患者,应常规进行LEAD的筛查,以全面评估下肢血管状况。伴有LEAD发病风险因素(如心脑血管病变、血脂异常、高血压、吸烟或糖尿病病程5年以上)的糖尿病患者每年至少筛查一次。具体筛查路径见图1[41]。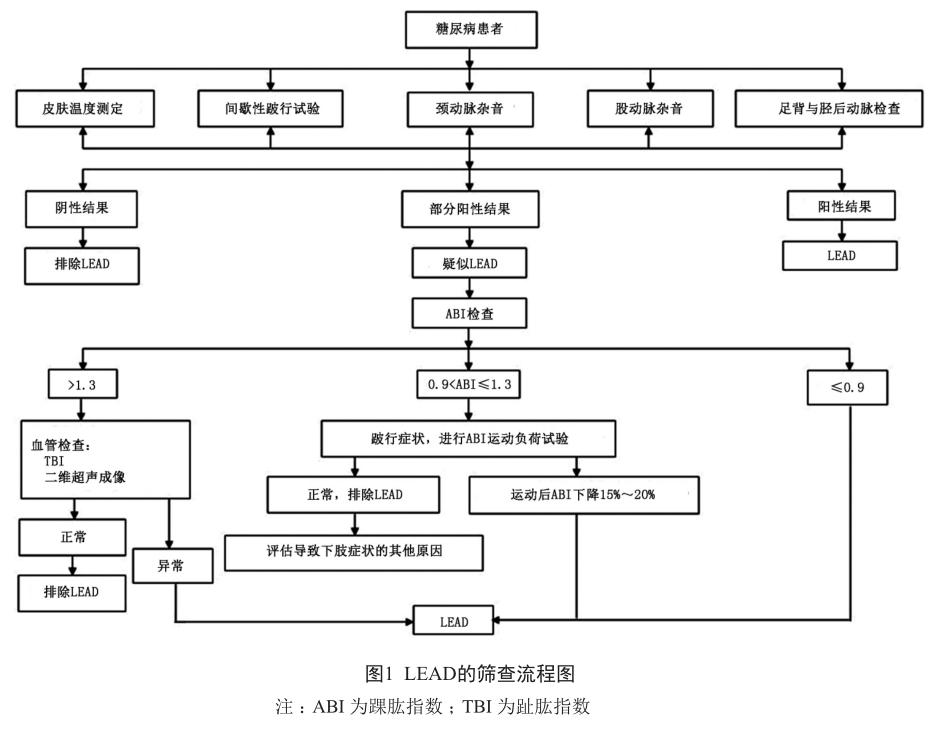
4.5.2 预防
糖尿病足的预防,依然是从整体到局部的全面预防理念。整体预防包括对患者及家属的宣传教育、严格控制血糖、控制心血管疾病高危因素、戒烟以及适度规律运动。局部预防主要是每日检查足部、胼胝与嵌甲的处理、足真菌感染的处理、足部力学变化的早发现、早确诊等。应对所有糖尿病患者的足部进行定期检查,包括有无畸形、胼胝、溃疡、皮肤颜色变化、足背动脉和胫后动脉搏动、皮肤温度以及有否感觉异常等。
系统的糖尿病足相关知识教育可以减少DFU的发生率,降低复发率、截肢率和提高患者的生活质量[42]。应对患者及家属进行足部保护相关知识和护理方面的教育,帮助他们转换成有效的行动。这些健康教育措施可以使患者早期发现DFU的前期病变,加强自我行为管理,并保持足部清洁,是预防溃疡发生和复发的重要手段。
参考文献
[1] Cho NH, Shaw JE, Karuranga S, et a1. IDF Diabetes Atlas: global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Res ClinPract, 2018, 138: 27l-281.
[2] World Health Organization. Use of glycated haemoglobin(HbA1c) in the diagnosis of diabetes mellitus. Abbreviated report of a WHO consultation[EB/OL]. (2011-01-13)[2013-11-12]. https: //www. who. int/diabetes/publications/ diagnosis_diabetes2011/en/
[3] American Diabetes Association. Standards of medical care in diabetes-2019[J]. Diabetes Care, 2019, 42(Suppl 1): S1-S193.
[4] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中华糖尿病杂志, 2018, 10(1): 4-67.
[5] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华糖尿病杂志, 2014, 6(7): 447-498.
[6] 母义明, 纪立农, 宁光, 等. 二甲双胍临床应用专家共识(2016年版)[J]. 中国糖尿病杂志, 2016, 24(10): 871-884.
[7] 中华医学会糖尿病学分会微血管并发症学组. 中国糖尿病肾脏疾病防治临床指南[J]. 中华糖尿病杂志, 2019, 11(1): 15-28.
[8] National Kidney Foundation. KDOQI clinicaI practice guideline for diabetes and CKD: 2012 update[J]. Am J Kidney Dis, 2012, 60(5): 850-886.
[9] Mosenzon O, Leibowitz G, Bhatt DL, et a1. Effect of saxagliptin on renal outcomes in the SAVOR-TIMI 53 trial[J]. Diabetes Care, 2017, 40(1): 69-76.
[10] Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes[J]. N Engl J Med, 2008, 358(24): 2560-2572.
[11] 葛均波, 徐永健, 王辰. 內科学[M]. 9版. 北京: 人民卫生出版社, 2018.
[12] Hernandez AV, Usmani A, Rajamanickam A, et al. Thiazolidinediones and risk of heart failure in patients with or at high risk of type 2 diabetes mellitus: a meta-analysis and meta-regression analysis of placebo-controlled randomized clinical trials[J]. Am J Cardiovasc Drugs, 2011, 11(2): 115-128.
[13] 纪立农, 陆菊明, 朱大龙, 等. 成人2型糖尿病基础胰岛素临床应用中国专家指导建议[J]. 中国糖尿病杂志, 2017, 25(1): 2-9.
[14] Garber AJ, Wahlen J, Wahl T, et al. Attainment of glycaemic goals in type 2 diabetes with once-, twice-, or thrice-daily dosing with biphasic insulin aspart 70/30 (The 1-2-3 study)[J]. Diabetes ObesMetab, 2006, 8(1): 58-66.
[15] 中华医学会糖尿病学分会. 新诊断2型糖尿病患者短期胰岛素强化治疗专家共识[J]. 中华医学杂志, 2013, 93(20): 1524-1526.
[16] Ji L, Hu D, Pan C, et al. Primacy of the 3B approach to control risk factors for cardiovascular disease in type 2 diabetes patients[J]. Am J Med, 2013, 126(10): 925.
[17] Gaede P, Lund-Andersen H, Parving HH, et al. Effect of a multifactorial intervention on mortality in type 2 diabetes[J]. N Engl J Med, 2008, 358(6): 580-591.
[18] ACCORD Study Group, Cushman WC, Evans GW. Effects of intensive blood-pressure control in type 2 diabetes mellitus[J]. N Engl J Med, 2010, 362(17): 1575-1585.
[19] 周蕾. 糖尿病合并高血压患者有效降压药物的选择[J]. 中国社区医师, 2016, 32(22): 23-25.
[20] Sarafidis PA, Bakris GL. Antihypertensive treatment with beta-blockers and the spec-trum of glycaemiccontrol[J]. QJM, 2006, 99(7): 431-436.
[21] 李艳敏, 李世玲, 袁晓安. 高血压合并糖尿病的降压药物治疗研究进展[J]. 临床医药文献杂志, 2019, 6(27): 198.
[22] Gradman AH, Basile JN, Carter BL, et al. Combination therapy in hypertension[J]. J Am SocHypertens, 2010, 4(1): 42-50.
[23] Vergès B. Pathophysiology of diabetic dyslipidaemia: where are we[J]? Diabetologia, 2015, 58(5): 886-899.
[24] 中华医学会内分泌学分会脂代谢学组. 中国2型糖尿病合并血脂异常防治专家共识(2017年修订版)[J]. 中华内分泌代谢杂志, 2017, 33(11): 925-936.
[25] 李建军. 调脂药物评价[J]. 中华心血管病杂志, 2017, 45(2): 93-95.
[26] 赵水平. 《中国成人血脂异常防治指南(2016年修订版)》要点与解读[J]. 中华心血管病杂志, 2016, 44(10): 827-829.
[27] ASCEND Study Collaborative Group, Bowman L, Mafham M, et al. Effects of aspirin for primary prevention in persons with diabetes mellitus[J]. N Engl J Med, 2018, 379(16): 1529-1539.
[28] Zhang L, Long J, Jiang W, et al. Trends in chronic kidney disease in China[J]. N Engl J Med, 2016, 375(9): 905-906.
[29] American Diabetes Association. 15. Diabetes advocacy: standards of medical care in diabetes-20l8[J]. Diabetes Care, 2018, 41(Suppl l): S152-153.

