几种抗菌素对豌豆根边缘细胞培养液的抑菌测定
王芳 乔美星 喻敏
摘要:采用液体培养的方法,测定了5种抗菌素对豌豆根边缘细胞培养液污染细菌的抑制和对边缘细胞的降解作用。结果表明,5种抗菌素在50-4 000 mg/L的浓度梯度内,对边缘细胞培养液污染细菌均具有一定的抑制作用。其中,罗红霉素、头孢呋辛酯和恩诺沙星对污染细菌抑制率较适宜的浓度分别为2 000、1 000和1 000 mg/L,抑制率分别迭93.480-/0、58.70%和91.30%。青霉素、罗红霉素、头孢呋辛酯、庆大霉素和恩诺沙星分别在500、500、l 000、1 000和500 mg/L时对边缘细胞的降解作用较缓慢,分别为63.89%、58.95%、60.80%、73.15%和58.95%,浓度增高,对边缘细胞的影响会明显增强。
关键词:抗菌素;污染细菌;边缘细胞;抑制作用
中图分类号:TQ455.5
文献标识码:A
文章编号:0439-8114( 2020) 08-0080-03
D01:10.1408 8/j.cnki.issn0439- 8114.2020.08.018
在植物组织培养的污染危害中,最严重的是细菌污染[1]。染菌的试管苗很难生根[2],即使生根,移栽成活率也很低,造成无法挽回的损失。细菌污染的消除一般是用抗生素[3],抗生素可以直接加入到培养基中,也可以用抗生素浸泡外植体或喷洒外植体。
大多数植物的根尖每天都要代谢产生大量的边缘细胞(Root border cells,简称BC),这些边缘细胞作为根表面和土壤间构建的一个生物表界面,在减少或避免外界的生物与非生物胁迫,如真菌、细菌、线虫的侵染和铝毒的伤害中起着重要作用[4]。绝大多数物种都有边缘细胞,且90%以上具有生物学活性,一条根系所产生的边缘细胞数量因物种而异。此外,细胞活性受环境条件、染色及观察时间等外界因素的影响较大。
边缘细胞是从根冠表皮游离出来并聚集在根尖周围的一群特殊细胞。关于边缘细胞形成和释放的调控机制以及在提高植物抗逆性,尤其是抗铝毒方面的研究,已成为植物学研究领域的新热点之一[5]。本试验就边缘细胞的体外培养过程中细菌污染的抑制问题进行了初步探讨,旨在为边缘细胞培养液的研究提供参考。
1 材料与方法
1.1 材料
豌豆由佛山科学技术学院土壤肥料实验室提供。
药剂主要有青霉素、罗红霉素、头孢呋辛酯、恩诺沙星和庆大霉素。
仪器主要有三角烧瓶、试管、玻璃棒、酒精灯、电子显微镜、超净工作台。
1.2 方法
1.2.1 豌豆根边缘细胞的培养选择饱满且大小均匀的豌豆种子用0.5%次氯酸钠杀菌10 min,流水冲洗30 min,再用无菌水冲洗3次,然后在无菌水中浸泡12 h,使其吸胀。采用超声雾化装置在恒温(23℃)培养箱中培养豌豆幼苗[6.7],待根长至15 mm以上时分离边缘细胞。
1.2.2 药剂的配制选取青霉素、罗红霉素、头孢呋辛酯、恩诺沙星、庆大霉素5种药剂处理。供试药剂均分别设置4 000、2 000、1 000、500、250、100和50mg/L 7种浓度,用无菌水定容至250 mL。
取边缘细胞培养液1 mL,分别加入以上药剂一滴( 1/20 mL);以无菌水为对照,设2次重复,24 h后测定细菌含量,同时测定细胞的数量和活性。
1.2.3 边缘细胞的数目 预备试验发现,在豌豆种子根长为15 mm时,边缘细胞数量最大。因而本试验挑选15 mm长的根。每次均取根适量,剪取根尖3 mm,放人装有1 000 μL无菌水的离心管中,10 000 r/min离心5 min,吸取上清液于另-1 000 μL离心管中,加无菌水稀释备用。使用前摇均匀,使边缘细胞及其黏液在水中充分展开再使用。用移液枪吸取10 μL含边缘细胞的悬浮液于离心管中,再加入适量0.4%台盼蓝染色,充分混合后吸取2.5 μL的混合溶液在干净的载玻片上划线,并在电子显微镜下统计边缘细胞数目,3次重复。
1.2.4 细菌抑制率和边缘细胞降解率的计算
抑制率=(对照生长量一相应浓度生长量)/对照生长量xl00%
降解率=(处理前边缘细胞总数一相应浓度处理后边缘细胞数)/处理前边缘细胞总数xl00%
1.3 数据处理
利用Excel、SAS有关软件进行数据统计分析。
2 结果与分析
2.1 不同浓度供试抗菌素对边缘细胞的降解作用
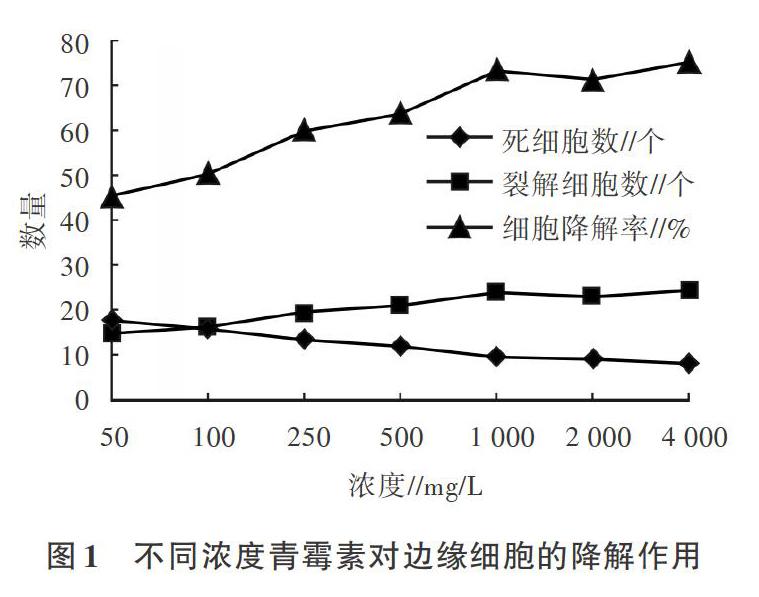
由图1可见,青霉素在50-4 000 mg/L的浓度梯度内对边缘细胞的降解率为45.37%-75.31%,在50-1 000 mg/L的浓度范围内降解率增加明显,500 mg/L时降解率为63.89%,1 000 mg/L时降解率增加至73.15%,两者之间差异较明显。这说明500mg/L青霉素对于边缘细胞的降解作用较缓慢,随着浓度增高对于边缘细胞的影响明显增强。
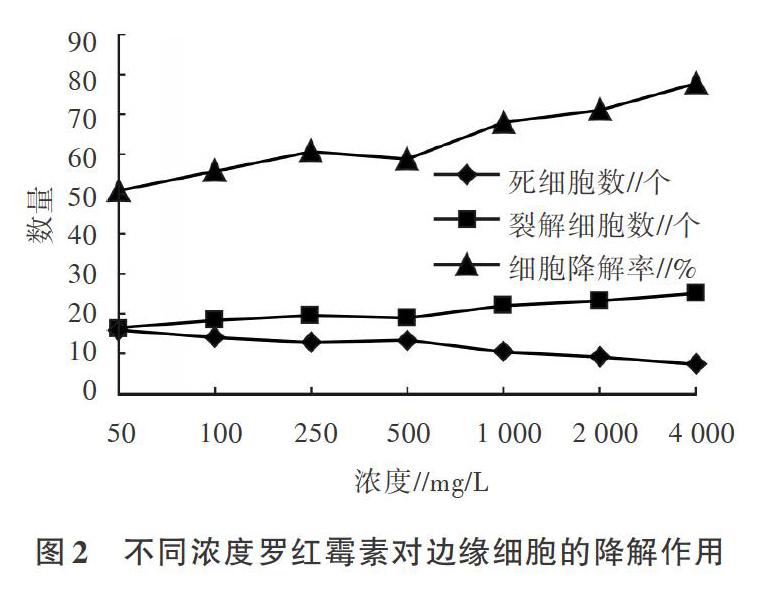
由图2可见,罗红霉素在50-4 000 mg/L的浓度梯度内对于边缘细胞的降解率为50.62%-77.47%,在50-1 000 mg/L的浓度范围内降解率增加明显,500 mg/L时降解率为58.95%,1 000 mg/L时降解率增加至68.21%,两者之间差异较明显。这说明500mg/L罗红霉素对于边缘细胞的降解作用较缓慢,随着其浓度增高,对于边缘细胞的影响明显增强。
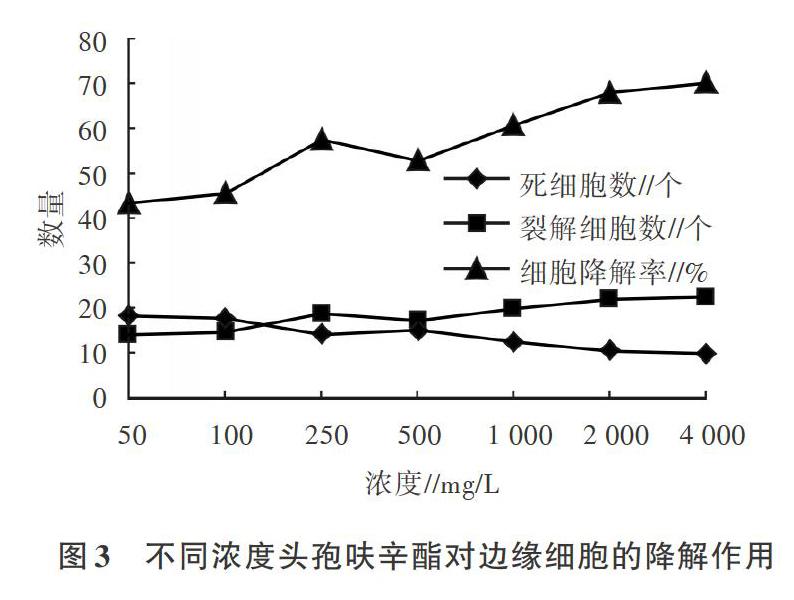
由图3可知,头孢呋辛酯在50-4 000 mg/L的浓度梯度内对边缘细胞的降解率为43.52%-70.06%。在50-2 000 mg/L的浓度范围内降解率增加明显,1 000mg/L时降解率為60.80%,2 000mg/L时降解率增加至68.21%,两者之间差异较明显。这说明1 000mg/L头孢呋辛酯对边缘细胞的降解作用较缓慢,随着其浓度增高,对边缘细胞的影响明显增强。
由图4可知,庆大霉素在50-4 000mg/L的浓度梯度内对边缘细胞的降解率为62.96%-90.74%。在50-2 000mg/L的浓度范围内降解率增加明显,1 000mg/L时降解率为73.15%,2 000 mg/L时降解率最高,达90.74%,两者之间差异较明显。这说明1 000 mg/L庆大霉素对边缘细胞的降解作用较缓慢,随着其浓度增高,对于边缘细胞的影响明显增强。
由图5可知,恩诺沙星在50-4 000 mg/L的浓度梯度内对边缘细胞的降解率为36.11% -81.48%。在50-1 000mg/L的浓度范围内降解率增加明显,500mg/L时降解率为66.98%,1 000 mg/L时降解率达72.22%,两者之间差异较明显,2 000 mg/L时降解率最高,达81.48%。这说明500 mg/L恩诺沙星对边缘细胞的降解作用较缓慢,随着其浓度增高,对于边缘细胞的影响明显增强。
2.2 不同浓度抗菌素对污染细菌的抑制作用
由表1可知,青霉素在50-4 000mg/L的浓度梯度内对边缘细胞培养液污染细菌的抑制率为0-73.91%。在50-1 000mg/L时,青霉素抑制率增加幅度较大,在500、1 000和2 000mg/L时,其抑制率均达40%以上,分别为43.48%、45.65%和47.83%,在4 000mg/L时,抑制率增加到73.91%,说明青霉素使用浓度提高,对于污染细菌的抑制率有明显的增强。
罗红霉素在50-4 000mg/L的浓度梯度内对边缘细胞培养液污染细菌的抑制率为17.39%-95.65%。在50-2 000mg/L时抑制率增加幅度较大,1 000mg/L时达67.39%.2 000 mg/L时抑制率达93.48%,两者之间差异明显,说明罗红霉素在2 000 mg/L时,对于污染细菌的抑制作用有较明显的增强。
头孢呋辛酯在50-4 000mg/L的浓度梯度内对边缘细胞培养液污染细菌的抑制率为34.78%-80.43%。在50-1 000mg/L时,抑制率增加幅度较大,50 mg/L时抑制率为34.78%,1 000mg/L时则为58.70%,两者之间差异明显,说明头孢呋辛酯在1 000mg/L时对污染细菌的抑制作用有较明显的增强。
庆大霉素在50-4 000mg/L的浓度梯度内对边缘细胞培养液污染细菌的抑制率为84.78%-100%,各处理浓度抑制率均相对较高。
恩诺沙星在50-4 000mg/L的濃度梯度内对边缘细胞培养液污染细菌的抑制率为76.09%-93.48%。在50-1 000mg/L时,抑制率增加幅度较大,500mg/L时抑制率为71.74%,1 000 mg/L时则为91.30%,两者之间差异明显,说明恩诺沙星在1 000mg/L时对污染细菌的抑制作用有较明显的增强。
3 小结与讨论
供试的5种抗菌素在50-4 000mg/L的浓度梯度内,对边缘细胞均有一定程度的降解作用。其中,青霉素在50-1 000 mg/L的浓度范围内降解率增加明显,50 mg/L时降解率为45.37%,4 000 mg/L时降解率最大,为75.31%。罗红霉素在50-1 000mg/L的浓度范围内降解率增加明显,500mg/L时降解率为58.95%,1 000mg/L时降解率达68.21%。头孢呋辛酯在50-2 000mg/L的浓度范围内降解率增加明显,1 000mg/L时降解率为60.80%,2 000mg/L时降解率增加至68.21%。庆大霉素在50-2 000mg/L的浓度范围内降解率增加明显,1 000mg/L时降解率为73.15%,2 000 mg/L时解率增至最大,为90.74%。恩诺沙星在50-1 000mg/L的浓度范围内降解率增加明显,250mg/L时降解率为58.95%,500mg/L时降解率增加至66.98%,两者之间差异较明显。说明青霉素、罗红霉素、头孢呋辛酯、庆大霉素和恩诺分别在500、500、1 000、1 000和250mg/L时对边缘细胞的降解作用较缓慢,随着其浓度增高,对于边缘细胞的影响会明显增强。
5种抗菌素在50-4 000 mg/L的浓度梯度内对边缘细胞培养液污染细菌均具有一定的抑制作用。其中,罗红霉素在50-2 000mg/L时抑制率增加幅度较大,1 000mg/L时抑制率达67.39%,2 000 mg/L时达93.48%。头孢呋辛酯在50-1 000mg/L时抑制率增加幅度较大,500 mg/L时抑制率为54.35%,1 000mg/L时则为58.70%。恩诺沙星在50-1 000mg/L时抑制率增加幅度较大,500mg/L时抑制率为71.74%,1 000 mg/L时则为91.30%,两者之间差异明显,说明罗红霉素、头孢呋辛酯和恩诺沙星对于污染细菌抑制率较适宜的选择浓度分别为2 000、1 000和1 000 mg/L。青霉素和庆大霉素随着使用浓度的提高,抑制率则明显增强。
由于抗生素的大量频繁使用,细菌抗药性问题引起人们的关注。在抗生素的使用过程中诱导产生了具有忍耐性的抗性菌株,使得抗生素能杀死细菌的有效剂量在不断提高。越来越多的试验证明,环境致病菌耐药性的增加和扩散将会对人类的公共健康构成潜在威胁。根边缘细胞是从根冠表皮游离出聚集在根尖周围的一群特殊细胞,发育受遗传调控,在逆境中具有多种生物学功能。Hawes等[4]将这类细胞称为根边缘细胞,强调这类细胞位于根表面与土壤之间、有生物活性的生物边界层。边缘细胞于根冠产生后,发挥多方面的功能,如影响根际微生态系统、抑制病源菌侵入、减少根系的机械阻力、保护根尖等。表明抗菌素在抑制细菌的同时,也对正常的边缘细胞有降解作用,被处理后的边缘细胞总数均比处理前少。
参考文献:
[1] LEIFERT C, WAITES W M,CAMOTTA H,et al.Lactobacillus plan-tarr.tm:A deleterious contaminant of plant tissue cultures[J].Joum-al of applied bacteriology, 1989, 67: 363-370.
[2]罗青,李晓莺,巫鹏举,等.枸杞组织培养中青霉素对细菌污染的抑制作用[J].宁夏农林科技,2006(3):6.
[3]王黎波,李晓燕.抗生素在植物组织培养中控制污染的应用[J].辽宁农业科学,2007(3):69-70.
[4] HAWES M C.GUNAWARDENA U, MIYASAKA S, et al. The roleof root border cells in plant defense [Jl. Trends Plant Sci. 2000.5(3):128-133.
[5]李荣峰,蔡妙珍,刘鹏,等.植物根边缘细胞的抗逆性研究进展[J].广西植物,2007,27(3):497-502.
[6] WEATHERS P J,CHEETHAM R D,GILES K. Dramatic increasesin shoot number and lengths for Musa, CordVline, and Nephrylepsisusing nutrient mists[J]. Acta Hort, 1988, 230: 39-44.
[7]郝震龙,欧阳藩,陈正华,等.植物的营养液雾化培养反应器[P].中国专利:ZL96211808.7,1996-05-15.
作者简介:王芳(1964-),女,山东莱阳人,副教授,硕士,主要从事植物真菌病害研究,(电话)18689286491(电子信箱)1940480985@qq.com。

