高山被孢霉生长和产脂的影响因素分析
唐 鑫,顾舒婕,常璐璐,赵建新,张 灏,陈海琴,陈 卫
(江南大学 食品学院,江苏 无锡 214122)
高山被孢霉是一种具有很强脂质合成能力的产油丝状真菌,其脂质积累量可达到自身干重的50%以上,其中花生四烯酸(ARA)含量可超过总脂肪酸含量的40%,目前已应用于商业化生产。为提高高山被孢霉的应用价值,研究人员常通过优化发酵条件、诱变育种等来提高菌株的生产特性[1-2]。现阶段,随着基因工程的兴起,利用分子生物学手段针对性地改造脂质合成相关基因、构建重组菌能够更有效地实现总脂质以及特定脂肪酸产量的提高[3]。与酵母和细菌不同,丝状真菌本身生长状态差异较大,发酵过程较不稳定。丝状真菌对不同的培养条件如碳源、氮源、发酵时间、培养温度、pH、摇床转速、接种量等十分敏感,可对菌体的生长和代谢造成较大的影响。为进一步探究高山被孢霉的发酵特点,本研究从初始葡萄糖质量浓度、活化次数、接种量、装液量、发酵时间、菌球打碎时间等方面分析发酵培养条件对高山被孢霉生长和脂质积累的影响,并确定最适培养条件,为高山被孢霉的研究以及遗传改造过程中转化子筛选的准确性提供更为稳定的数据和参考。
1 材料与方法
1.1 实验材料
1.1.1 菌株
本实验所用菌株为高山被孢霉ATCC 32222,购自美国菌种保藏中心。
1.1.2 主要试剂
正十五烷酸(C15∶0)、盐酸-甲醇,Sigma;F006葡萄糖试剂盒,南京建成;酵母提取物、氯化钠、甲醇、氯仿、盐酸、正己烷、葡萄糖、磷酸二氢钾、硝酸钾、七水合硫酸镁,国药集团。
1.1.3 培养基
Broth种子培养基:20 g/L葡萄糖,5 g/L酵母提取物,1 g/L KH2PO4,0.25 g/L MgSO4·7H2O,10 g/L KNO3。
Broth发酵培养基:50 g/L葡萄糖,5 g/L酵母提取物,1 g/L KH2PO4,0.25 g/L MgSO4·7H2O,10 g/L KNO3。
1.1.4 主要仪器
T10 basic Ultra-turrax高速分散机,德国IKA;G-GP2010 Plus气相色谱仪,日本岛津;ND100-2氮气吹扫仪,杭州瑞诚;a5100微型单反数码相机,日本索尼。
1.2 实验方法
1.2.1 菌株培养
200 μL孢子液(107个/mL)接种于Broth种子培养基,28℃、200 r/min振荡培养2 d,弃上清,使用高速分散机,以8 000 r/min转速打散菌体20 s,按1%(体积分数,下同)接种量接种于新的种子培养基,重复2次至菌体生长为状态良好、大小均一的松散毛球状。使用高速分散机以8 000 r/min转速打散菌体20 s,按1%接种量接入Broth发酵培养基,28℃、200 r/min培养7 d。活化过程的培养体系为250 mL摇瓶,装液量40%(体积分数,下同)。
在考察不同培养条件对菌株生长和产脂的影响时,除所考察的条件有所变化外,其他操作条件均固定。
1.2.2 高山被孢霉生物量及脂肪酸组成和含量测定
发酵后的菌体样品经200目网筛过滤,用去离子水反复冲洗菌体,在滤纸上挤干水分,置于真空冷冻干燥机中冻干至恒重,使用分析天平称量,得到菌体干重(DCW)。
将干燥菌体充分研磨至均匀的粉末状,称取(50±5)mg干菌粉于提脂瓶中,加入2 mL 4 mol/L的盐酸溶液,使用微量进样器准确加入100 μL质量浓度为2.0 mg/mL 的溶解于正己烷的正十五烷酸(C15∶0)作为内标,混匀后于80℃/-80℃反复冻融3次用于破壁。用甲醇-氯仿法萃取菌内脂质,充分振荡,离心后吸取氯仿层于新提脂瓶,重复2次,新提脂瓶内的脂肪酸萃取样品氮吹至干,用10%盐酸-甲醇溶液于60℃水浴3 h进行甲酯化处理。之后加入1 mL饱和氯化钠溶液和1 mL正己烷,充分振荡,萃取得到脂肪酸甲酯。使用GC-MS检测样品,分析脂肪酸组成及相对含量。根据色谱峰的保留时间定性,色谱峰的峰面积与已知浓度和添加量的内标(C15∶0)进行定量,面积归一化法确定不同脂肪酸相对含量。相关参数的计算公式如下。
生物量=菌体干重/培养基体积
脂肪酸含量=脂肪酸质量/干菌粉质量×100%
去脂生物量=(1-脂肪酸含量)×生物量
脂肪酸绝对量=脂肪酸含量×生物量
1.2.3 培养基上清液残糖含量测定
培养基上清液残糖含量参考F006葡萄糖试剂盒进行。
1.2.4 菌体形态观察与记录
将培养体系充分摇匀,取3 mL倒入直径为6 cm的玻璃培养皿并加入等量生理盐水稀释,静置后保持固定距离拍摄菌体形态照片(微距模式),观察和记录不同培养条件对菌体形态的影响。
2 结果与讨论
2.1 初始葡萄糖质量浓度对高山被孢霉生长和产脂的影响
微生物发酵过程中的碳源是菌体形成细胞质基质、细胞膜、细胞壁等各类细胞组分的重要原料,能够构成细胞生长所必需的碳骨架[4]。多数微生物偏好葡萄糖为优先碳源[1],葡萄糖参与的糖酵解过程是为生物体生命活动提供能量的最主要方式。不同碳氮比会影响菌丝体的生长状态以及脂质积累[5],高山被孢霉在较高碳氮比下能大量积累脂质,而过高的碳氮比不仅会因高渗透压抑制菌体生长,还会导致碳源浪费[4]。因此,确定最适合高山被孢霉产脂和生长的碳氮比具有重要的意义。本研究设置了20、30、35、40、50、65、80 g/L共计7组初始葡萄糖质量浓度,研究高山被孢霉的生长和产脂情况,结果见图1。
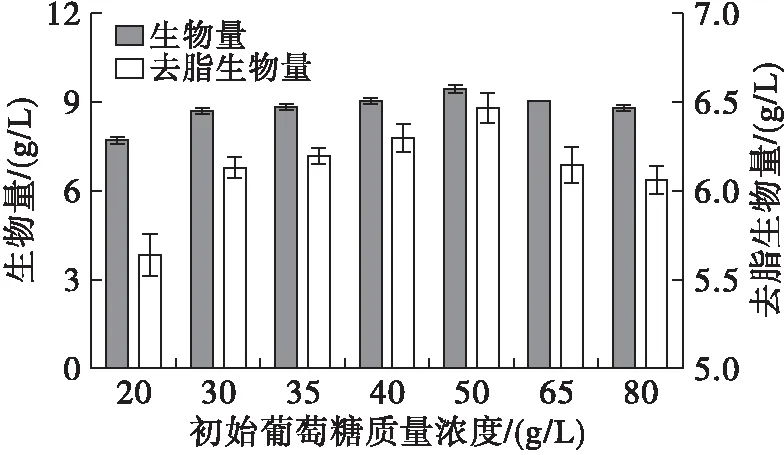
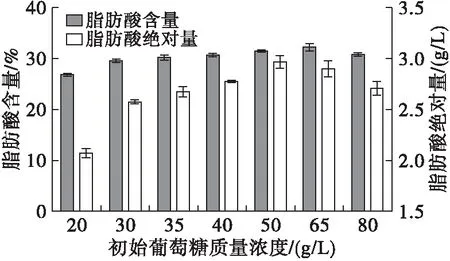
图1 不同初始葡萄糖质量浓度下高山被孢霉生长、产脂情况
由图1可知,当初始葡萄糖质量浓度低于50 g/L时,高山被孢霉的生物量随着培养基中葡萄糖含量的增加而提高,表明葡萄糖为菌丝体细胞的生长提供了可利用的碳源,而初始葡萄糖质量浓度处于低水平时(<30 g/L),无法满足高山被孢霉产脂所需的高碳氮比,其生物量较低。当培养基中的初始葡萄糖质量浓度为50 g/L时,菌体的生长情况最好,生物量达到9.4 g/L,脂肪酸绝对量高达3.0 g/L。而葡萄糖质量浓度高于50 g/L时,菌体生物量和脂质积累量有所降低。这可能是由于高浓度糖使细胞处于高渗透压的环境胁迫状态导致代谢水平失衡[6],同时可能产生一些有害副产物使菌体生理活动受影响[7],阻碍菌丝体的正常生长。
进一步对不同初始葡萄糖质量浓度下高山被孢霉中脂肪酸组成及相对含量进行分析,结果见表1。
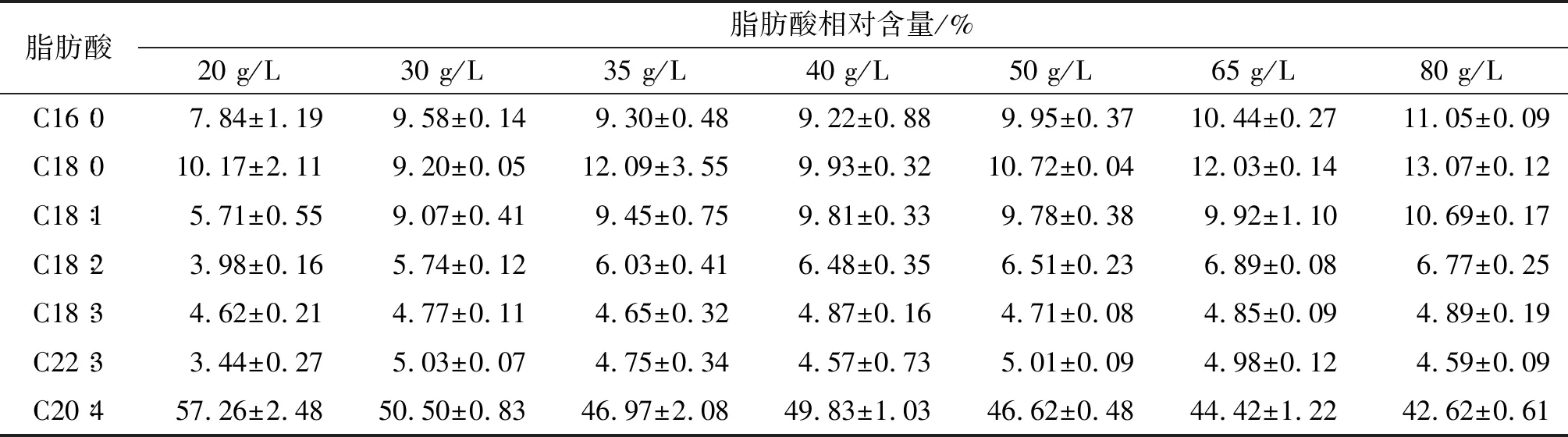
表1 不同初始葡萄糖质量浓度下脂肪酸组成及相对含量
注:表中仅列出相对含量>3%的脂肪酸。下同。
由表1可知,随着初始葡萄糖质量浓度的增加,高山被孢霉中ARA含量大幅度降低,初始葡萄糖质量浓度为20 g/L时ARA含量高达57.26%,当初始葡萄糖质量浓度高达80 g/L时ARA含量下降至42.62%,与此同时,以C16∶0、C18∶0和C18∶1为代表的饱和及单不饱和脂肪酸含量显著增加,表明高初始葡萄糖质量浓度下脂肪酸的脱饱和及延长途径受阻[6]。有研究显示,碳源等营养原料不足时菌体进入老化阶段,在此时期内菌体生物量积累停止而ARA产量大幅度提高[8]。综合比较菌体的生长和产脂情况,选择初始葡萄糖质量浓度为50 g/L。
2.2 活化次数对高山被孢霉生长和产脂的影响
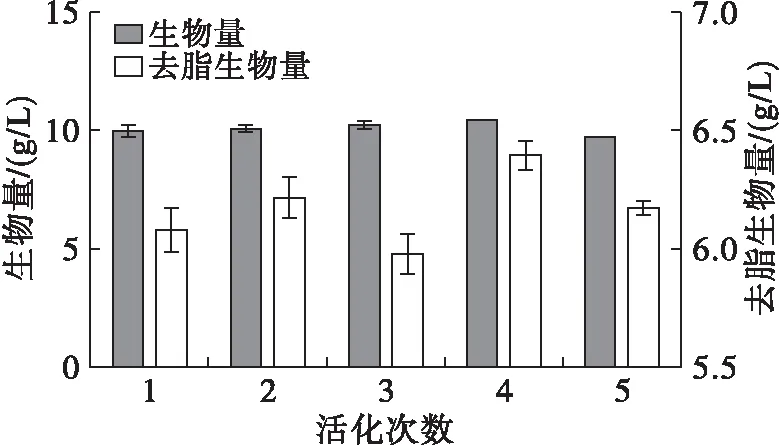
菌体需达到相对一致的生长状态时才能接入发酵培养基中,以保证培养过程中菌体生长发酵的稳定性,减少菌体个体生长差异对实验结果的影响。高山被孢霉要经过多次活化才能达到最佳生长状态,通常一次活化需2~3 d,重复活化2~3次,直至长成个体均一、形态饱满的白色绒毛状菌球再接入发酵培养基。设置活化1、2、3、4、5次5组条件,每组3个平行。比较不同活化次数对高山被孢霉生长和产脂的影响,结果见图2。
由图2可知,活化次数对菌体生物量影响不大,但脂肪酸的合成受到影响,导致各活化次数下去脂生物量和脂肪酸绝对量有所不同。活化1次和2次的菌体脂肪酸含量均小于40%,第3次活化后脂肪酸含量达到最高。之后随着活化次数增加,脂质积累性能总体降低,可能是活化次数过多而导致菌体活性降低、增殖能力减弱、遗传性状丢失或生物学功能衰退。
不同活化次数下高山被孢霉脂肪酸组成及相对含量见表2。
由表2可知,活化次数对高山被孢霉脂肪酸组成的影响较小,因此为避免多次活化带来的不利影响,本实验选择将产脂性能最好、活化3次的菌体接入发酵培养基进行发酵培养。
2.3 接种量对高山被孢霉生长和产脂的影响
菌株的接种量与生长状态密切相关。液体培养基中高山被孢霉菌球的密度决定着菌株达到稳定期的时间,直接关系到培养基中营养物质和溶解氧的传递效率及菌丝体的生长发酵情况。有研究表明高接种密度下菌体延滞期缩短,可较快到达对数生长期从而缩短整个发酵周期[9]。将活化3次的菌体以0.5%、1%、2%、3%、4%的5个梯度接入发酵培养基进行发酵培养,每组设置3个平行。不同接种量下高山被孢霉菌体形态见图3,不同接种量下高山被孢霉生长、产脂情况见图4。
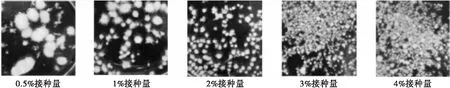
图3 不同接种量下高山被孢霉菌体形态
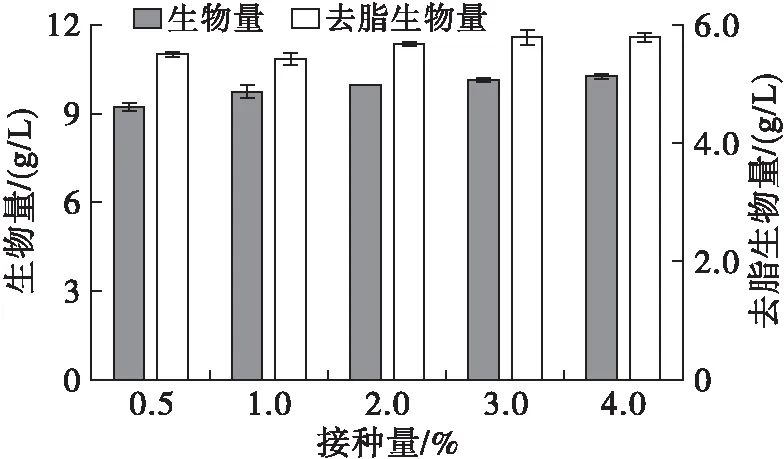
图4 不同接种量下高山被孢霉生长、产脂情况
由图3和图4可知,接种量为1%~2%时高山被孢霉呈毛球状,菌球大小一致,分布均匀,生长状态最佳。当接种量为0.5%时,菌球个体大、数量少,生长不均匀,生物量仅为9.13 g/L,该条件下脂肪酸产量显著低于其他组别,可能因为0.5%接种量所形成的大体积菌球内部营养物质的运输、尤其是溶解氧的传递受阻严重[10]。当接种量超过1%时,接入培养基的菌丝在生长过程中缩聚成一个个表面相对光滑的紧实小菌球。研究表明,丝状真菌在适合自身生长的条件下不易结成紧密的球体,而在营养匮乏时菌丝聚集现象加倍出现[11]。
对不同接种量下脂肪酸组成及相对含量进行分析,结果见表3。
由表3可知,接种量对各类脂肪酸相对含量无明显影响。考虑到菌体生长速度、生物量和脂质积累量,选择2%~3%为最适接种量。
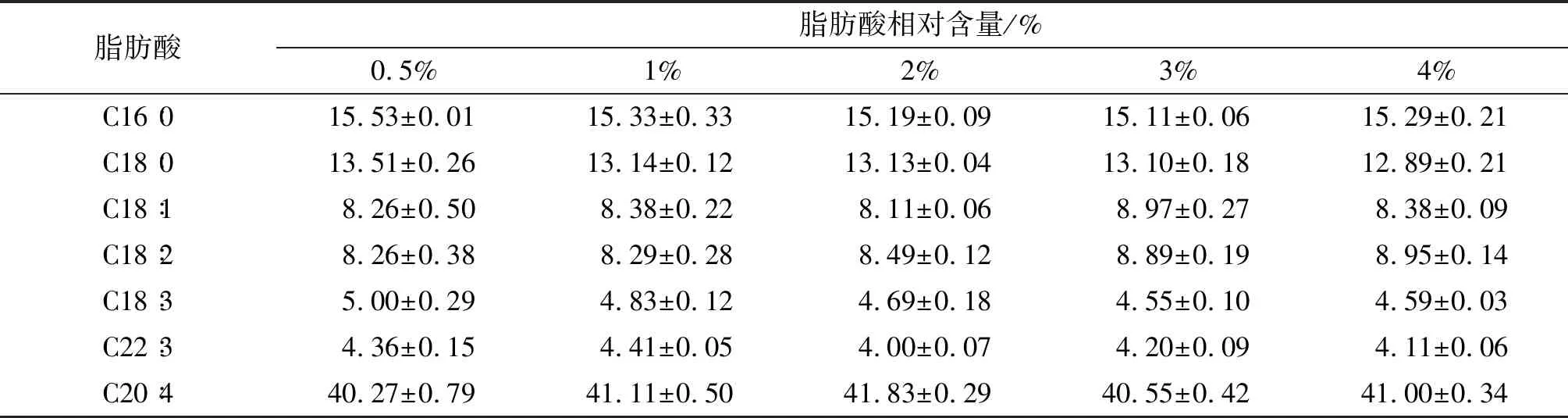
表3 不同接种量下脂肪酸组成及相对含量
2.4 装液量对高山被孢霉生长和产脂的影响
溶解氧含量是影响菌体生长和产脂的关键因素之一,而装液量与摇瓶培养体系中溶解氧含量密切相关[10],装液量越小,培养基与空气的接触面积越大,溶氧量越多。将Broth发酵培养基分别按照20%、30%、40%、50%、60%装液量分装,探究装液量对高山被孢霉生长发酵的影响。不同装液量下高山被孢霉菌体形态见图5,生长、产脂情况见图6。
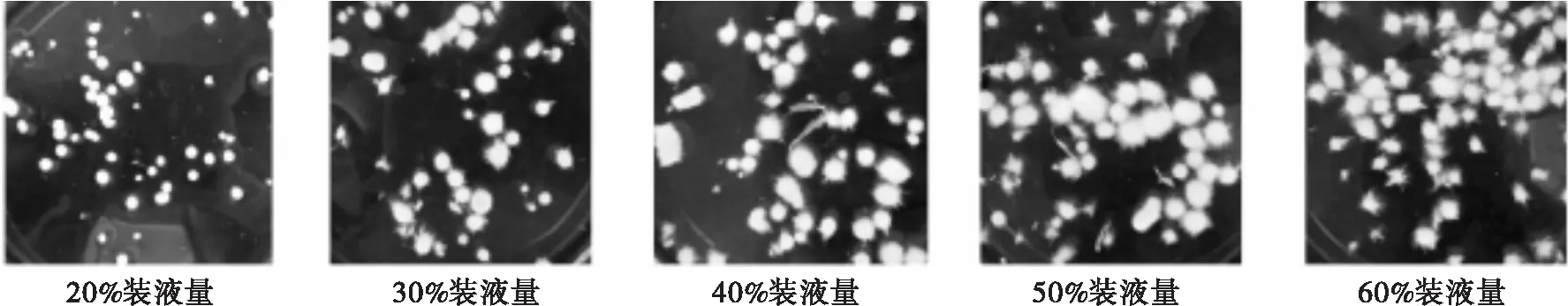
图5 不同装液量下高山被孢霉菌体形态
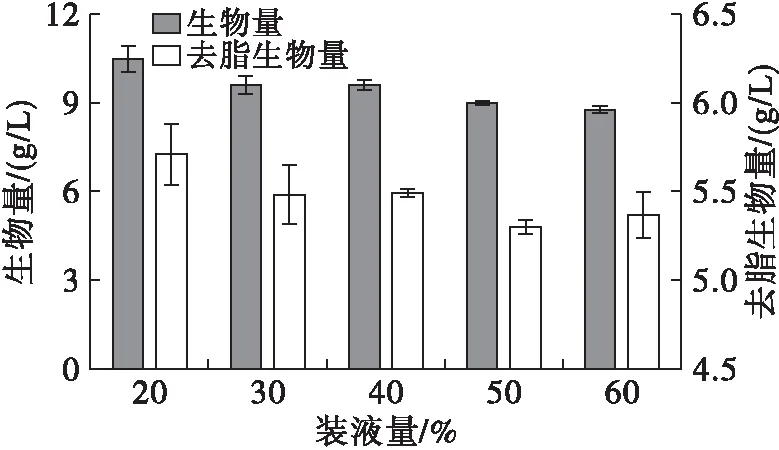
图6 不同装液量下高山被孢霉生长、产脂情况
由图5可知,在20%装液量下,菌球体积小且表面光滑,这是菌体对所处培养环境的响应表现。有研究表明,在高溶氧量条件下,菌体因受到高氧浓度的胁迫,菌丝生长被束缚并开始加速分化,菌体表面部分结构裂解,形成光滑的外壁,这是菌体在高氧压力下的一种自我应激保护机制[12]。装液量增加后,菌株逐渐生长成绒毛状的蓬松小球。菌丝在培养过程中需浸没在培养基中以保证营养物质的吸收,装液量可能成为限制菌丝向外延伸、扩大的因素,因而菌球体积在20%装液量时最小并随装液量的增加而增大。
由图6可知,高山被孢霉的去脂生物量几乎没有随着装液量的改变而变化,但脂肪酸绝对量与装液量呈负相关,装液量20%时脂肪酸含量达到45.72%,分别比其他4组提高6.20%、6.60%、10.97%、17.74%,推测溶氧量会改变菌株的代谢途径,溶解氧缺乏的情况不利于产油微生物将游离脂肪酸转化为甘油三酯积累于胞内,也不利于不饱和脂肪酸的生成[7,13]。
不同装液量下脂肪酸组成及相对含量见表4。
由表4可知,随着装液量的增加,菌体饱和脂肪酸与多不饱和脂肪酸含量之比(SFAs/PUFAs)无明显变化,可能因为本研究中氧气供给量的改变不足以影响脂肪酸的脱饱和作用。有研究表明,溶解氧浓度在一定范围内增加能够促进高山被孢霉中不饱和脂肪酸花生四烯酸(ARA)的合成,但氧含量过高时菌体需利用额外的能量来响应高浓度氧对细胞的氧化胁迫,诱导代谢向所不需要的方向进行,ARA的生成受阻碍[13-14]。此外,由于高装液量、低溶氧量下培养的菌体形态较大,菌球外缘呈放射状聚集的菌丝会抑制溶解氧的传递,同时在一定程度上阻碍了营养成分和代谢产物的运输通路,这会导致菌球内部无法获得充足的养分且氧传递速率很低,一些有毒有害的代谢产物也不能及时排出,对菌株的发酵生产十分不利[7]。根据脂质合成情况选择溶氧量最大的20%装液量作为优化条件。
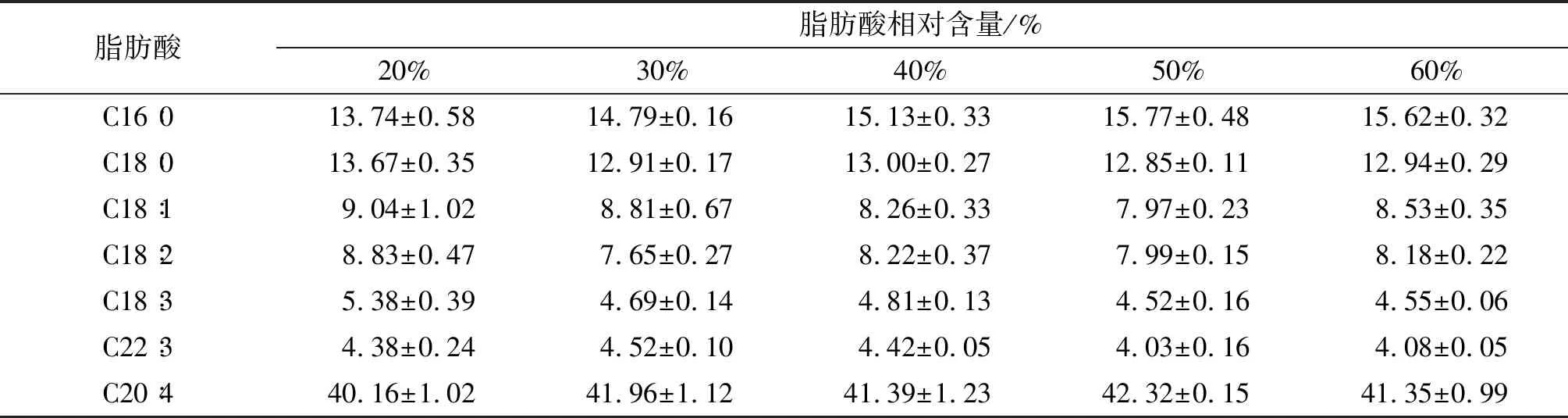
表4 不同装液量下脂肪酸组成及相对含量
2.5 发酵时间对高山被孢霉生长和产脂的影响
经活化的高山被孢霉在接入发酵培养基之后存在短暂延滞期再进入对数生长期[6],此时去脂生物量快速增加,大量消耗碳源、氮源,脂质合成开始但处于较低水平。之后在氮限制下菌体生长受到抑制,脂质积累相关酶活性改变,为脂肪酸的形成提供了充足的乙酰-CoA碳源底物和NADPH还原力,高山被孢霉生长速度减缓甚至停止转而大量生成脂肪酸,培养基中残糖作为脂肪酸合成的重要原料仍被不断利用[15],葡萄糖消耗量持续下降,其中5.5~7 d时菌体耗糖速度最快,即这段时间是脂质快速积累期(见图7)。

图7 不同发酵时间下高山被孢霉培养基上清液残糖含量
不同发酵时间下高山被孢霉生长、产脂情况见图8。
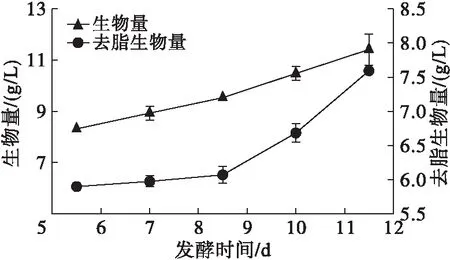
图8 不同发酵时间下高山被孢霉生长、产脂情况
由图8可知,高山被孢霉在发酵7 d前后的去脂生物量几乎没有发生变化,菌丝体生长十分缓慢甚至接近停止。但发酵7 d时高山被孢霉的脂肪酸含量比5.5 d时提高了14.38%,到8.5 d时脂肪酸含量进一步上升并达到最高,这符合发酵后期菌体代谢由生长期进入脂肪酸积累期的一般规律[2]。高山被孢霉在培养8.5 d时已基本完成脂质的快速积累,但11.5 d时脂肪酸含量比10 d时又降低了7.72%,说明菌体内脂肪酸含量在第8.5~10 d时相对稳定,因此选取该发酵时期的菌体进行脂肪酸提取。此外,菌体的去脂生物量在10 d和11.5 d的发酵末期内分别提高10.05%和13.62%,推测可能在发酵后期碳源即将耗尽时菌体启动细胞自噬[16],在一些分解酶的作用下降解部分细胞器、已合成脂肪酸和非必要蛋白质等成分,为生物体的生命代谢提供必要的能量和碳骨架,因而去脂生物量增加[4]。
不同发酵时间下脂肪酸组成及相对含量见表5。
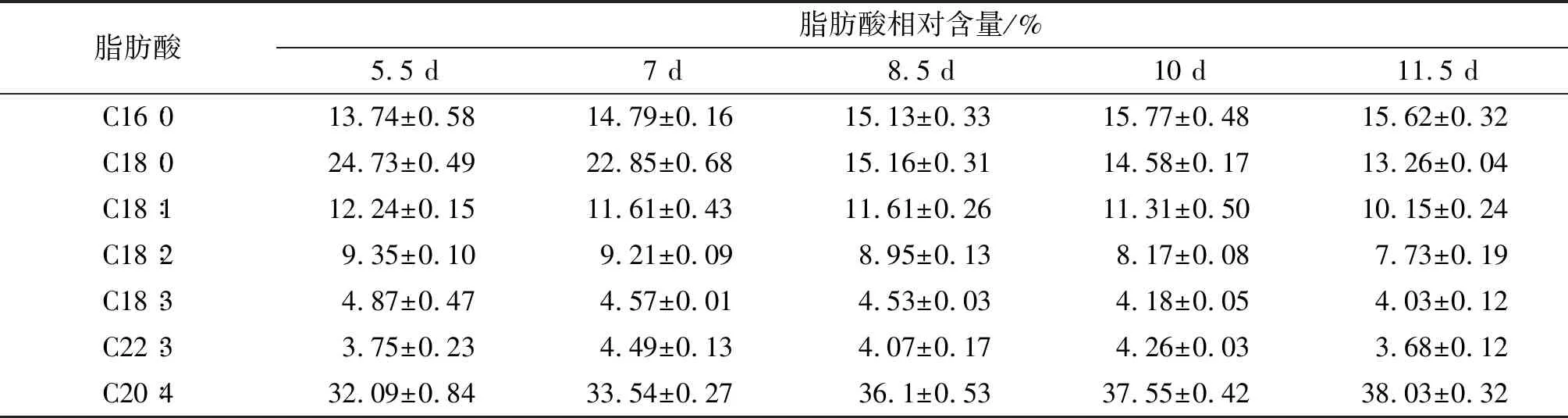
表5 不同发酵时间下脂肪酸组成及相对含量
由表5可知,C18∶0、C18∶1、C18∶2、C18∶3 4种脂肪酸的含量随发酵时间的延长而降低,而其特征脂肪酸ARA的含量随发酵时间的延长而增加。综上,选择8.5 d作为高山被孢霉的发酵时间。
2.6 菌球打碎时间对高山被孢霉生长和产脂的影响
高山被孢霉等丝状真菌在培养过程中会聚集成小球状,菌株的活化需要将菌球打散成菌丝并接入新的培养基,之后在振荡培养过程中重新长成菌球。菌球破碎程度不仅会影响活化过程中菌球的均一性从而影响发酵结果的稳定,还会因外加的机械力影响菌体的活性。前期实验发现,不同打碎程度对菌丝的生长状态有明显的影响。取活化3代的菌体,将菌球以8 000 r/min转速分别打碎20、40、80、120、160 s至均匀菌絮状,接种到发酵培养基中,不同菌球打碎时间下高山被孢霉菌体形态(发酵1 d)见图9。不同菌球打碎时间下高山被孢霉生长、产脂情况见图10。

图9 不同菌球打碎时间下高山被孢霉菌体形态(发酵1 d)
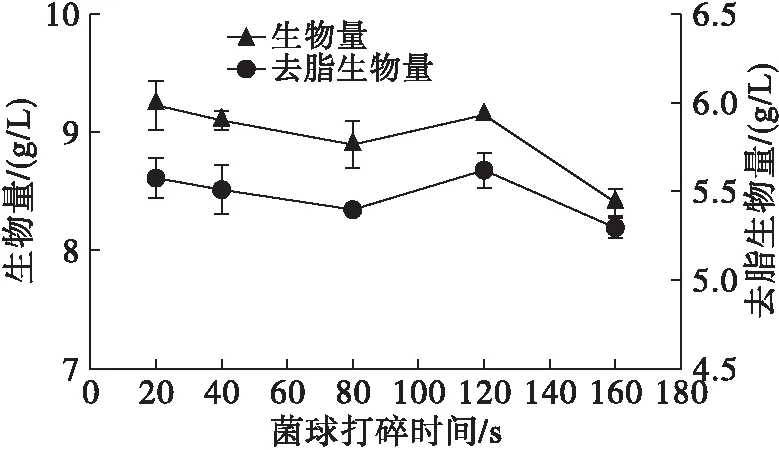
图10 不同菌球打碎时间下高山被孢霉生长、产脂情况
由图9~图10可知,在菌球打碎时间较短时(20、40 s),菌丝在发酵1 d后就开始聚集形成小型菌球雏形,而菌球打碎时间较长(80、120、160 s)的菌体仍呈分散的颗粒状菌丝且菌丝生长稀薄,生长速度延缓。发酵培养7 d后菌体的形态基本达到一致,生物量稳定在9.0 g/L,只有打碎程度最高(菌球打碎时间160 s)的菌体生长情况较差,其生物量和去脂生物量分别只有8.40 g/L和5.29 g/L,表明打碎程度会影响菌体活性和生长速度,而打碎时间过长时菌体难以恢复到较好生长状态。可见,打碎程度虽对高山被孢霉的生长终状态影响不大,但过高的打碎程度会明显降低菌体的生长速度,进而影响菌丝体的发酵生长。打碎20~120 s的菌体脂肪酸产量相差不大,仅呈略微下降趋势,打碎20 s时菌体的脂肪酸含量最高,达到39.74%。将打碎时间延长至160 s时,菌体脂肪酸含量降低了6.97%。
不同菌球打碎时间下脂肪酸组成及相对含量见表6。
由表6可知,打碎20 s时ARA的含量最高,表明此时高山被孢霉的脂肪酸生产特性表现最佳。综上,选择20 s为最佳菌球打碎时间。
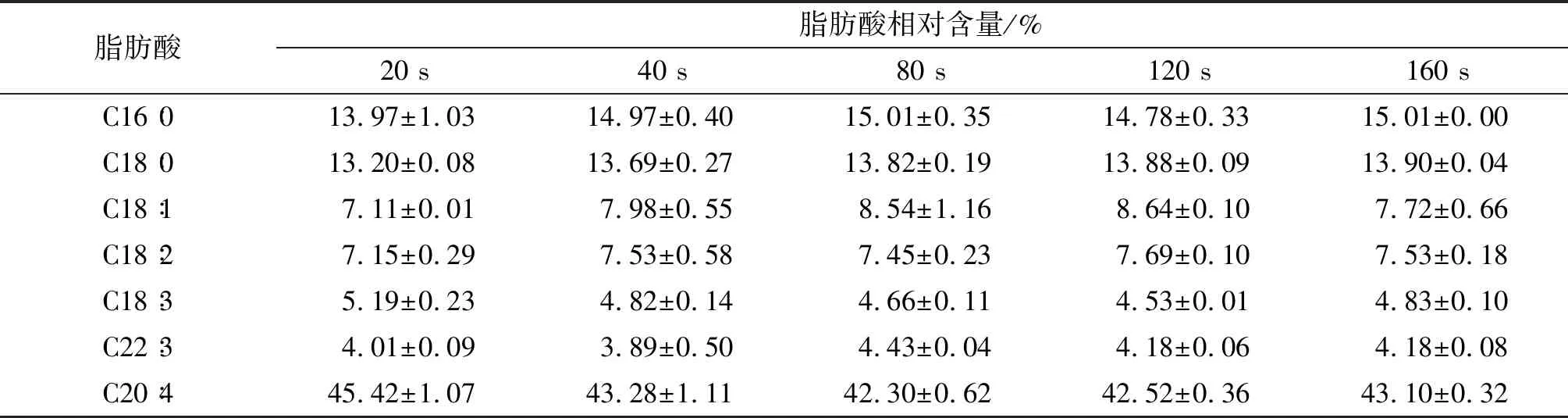
表6 不同菌球打碎时间下脂肪酸组成及相对含量
3 结 论
高山被孢霉作为已经应用于商业化生产花生四烯酸(ARA)的菌株,具有良好的应用价值和开发前景。本研究比较了不同初始葡萄糖质量浓度、活化次数、接种量、装液量、发酵时间、菌球打碎时间等不同发酵条件下高山被孢霉的生长及产脂情况,完成对其所产脂肪酸的提取和分析,发现初始葡萄糖质量浓度、装液量和发酵时间对高山被孢霉生长、产脂的影响最为突出,得到高山被孢霉产脂的最佳发酵条件:初始葡萄糖质量浓度50 g/L,装液量20%(体积分数),菌株需活化3次,打碎20 s至均匀状态,按2%~3%(体积分数)接种量接入Broth发酵培养基,200 r/min、28℃培养8.5 d。本研究还发现,虽然较高的初始葡萄糖质量浓度可以促进高山被孢霉脂质积累,但是发酵末期葡萄糖剩余量较高,造成碳源浪费并提高了发酵成本,而且高葡萄糖浓度会抑制ARA的积累。由于ARA等长链多不饱和脂肪酸的合成主要由脂肪酸脱饱和酶和延长酶参与,后续可对外源葡萄糖浓度对脂肪酸脱饱和及延长途径关键酶的活性调控进行探究,在保证菌株生长和产脂的基础上,通过分批补料等方式控制发酵过程中葡萄糖浓度、提高脂肪酸脱饱和及延长过程关键酶的活性,为进一步促进高山被孢霉高产具有高附加值的长链多不饱和脂肪酸提供更好的理论基础。

