鞣花酸对变异链球菌的体外抑菌作用及机制研究
闫莉 周晓英


中圖分类号 R965 文献标志码 A 文章编号 1001-0408(2020)05-0607-05
DOI 10.6039/j.issn.1001-0408.2020.05.20
摘 要 目的:研究鞣花酸对变异链球菌的体外抑菌作用及可能机制,为其防治龋病的应用提供实验依据。方法:以复方氯己定含漱液为阳性对照、5%二甲基亚砜(DMSO)溶液为阴性对照,采用打孔法抑菌试验测定抑菌圈直径考察50、25、12.5、6.25、3.125、1.562 5 mg/mL鞣花酸对变异链球菌的抑菌效果,并采用微量稀释法测定其对变异链球菌的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)。以5%DMSO溶液为阴性对照,采用结晶紫染色法测定1/8MIC、1/4MIC、1/2MIC、MIC鞣花酸对变异链球菌生物膜形成的影响,并在荧光染色后通过激光扫描共聚焦显微镜观察1/2MIC鞣花酸作用后生物膜的结构变化;分别采用苯酚硫酸法和还原型辅酶Ⅰ氧化法考察1/8MIC、1/4MIC、1/2MIC、MIC鞣花酸对变异链球菌细胞外多糖(EPS)的抑制率和细胞外基质中乳酸脱氢酶(LDH)活力的影响。结果:12.5~50 mg/mL鞣花酸对变异链球菌产生了直径均大于15 mm的抑菌圈,50 mg/mL鞣花酸作用下抑菌圈直径与复方氯己定含漱液相当。鞣花酸对变异链球菌的MIC、MBC分别为12.5、25 mg/mL。1/8MIC~MIC鞣花酸作用后细菌生物膜的存活率较阴性对照显著降低(P<0.01),且呈剂量依赖趋势,MIC鞣花酸作用后细菌生物膜的存活率仅为(16.41±1.346)%;荧光染色后显微镜下可见,1/2MIC鞣花酸作用后细菌生物膜结构被破坏;1/8MIC~MIC鞣花酸作用后细菌水不溶性EPS和水溶性EPS的抑制率较阴性对照均显著升高(P<0.01),1/4MIC~MIC鞣花酸作用后细胞外基质中LDH活力较阴性对照均显著升高(P<0.01),且呈剂量依赖趋势。结论:鞣花酸对变异链球菌的生长具有一定的抑制作用;其机制可能与抑制EPS产生、降低细菌的黏附、破坏细菌细胞膜有关。
关键词 鞣花酸;变异链球菌;细菌生物膜;体外;抑菌作用;机制
Study on in vitro Anti-bacterial Activity and Mechanism of Ellagic Acid on Streptococcus mutans
YAN Li1,ZHOU Xiaoying2(1.Central Laboratory, Xinjiang Medical University, Urumqi 830011, China;2.School of Pharmacy, Xinjiang Medical University, Urumqi 830011, China)
ABSTRACT OBJECTIVE: To study the in vitro anti-bacterial activity and potential mechanism of ellagic acid on Streptococcus mutans, and to provide evidence for its prevention and treatment of dental caries. METHODS: Using Compound chlorhexidine gargle as positive control, 5%DMSO as negative control, bacteriostasis experiment was conducted by the method of drilling hole, and bacteriostatic effects of 50, 25, 12.5, 6.25, 3.125, 1.562 5 mg/mL ellagic acid on S. mutans was preliminarily determined by measuring the diameter of bacteriostatic ring. The minimal inhibitory concentration (MIC) and minimal bactericidal concentration (MBC) of ellagic acid on S. mutans were determined by microdilution method. Using 5% DMSO as negative control, the effects of 1/8 MIC, 1/4 MIC, 1/2 MIC and MIC ellagic acid on the formation of S. mutans biomembrane was determined by crystal violet staining. The changes of the biomembrane structure under the action of 1/2 MIC ellagic acid were observed by microscopy after fluorescence staining. Phenol sulfuric acid method and reducing coenzymeⅠoxidation method were used to determine inhibitory effects of 1/8MIC, 1/4MIC, 1/2MIC, MIC ellagic acid on S. mutans on extracellular polysaccharide (EPS) as well as effect on the activity of lactate dehydrogenase (LDH) in extracellular matrix. RESULTS: Ellagic acid with concentration of 12.5~50 mg/mL produced an inhibitory ring on S. mutans with diameter greater than 15 mm. Under the action of 50 mg/mL ellagic acid, the diameter of bacteriostatic ring was the same as that of Compound chlorhexidine gargle. MIC and MBC of ellagic acid to S. mutans were 12.5 mg/mL and 25 mg/mL. The survival rate of bacterial biomembrane after 1/8MIC-MIC ellagic acid treatment was significantly lower than that of the negative control (P<0.01), and had a certain dose-response trend. After MIC ellagic acid treatment, the survival rate of bacterial biomembrane was (16.41±1.346)%. After fluorescence staining, the structure of bacterial biomembrane was destroyed by 1/2 MIC ellagic acid. After treated with 1/8MIC-MIC ellagic acid, its inhibitory rates on water-soluble EPS and water-insoluble EPS were increased significantly, compared with negative control (P<0.01). After treated with 1/4MIC-MIC ellagic acid, the activity of LDH in the extracellular matrix of bacteria increased significantly, compared with negative control (P<0.01), in dose-effect dependent trend. CONCLUSIONS: Ellagic acid can inhibit the growth of S. mutans, the mechanism of which may be associated with inhibiting EPS production, reducing bacterial adhesion, destroying bacterial cell membrane.
KEYWORDS Ellagic acid; Streptococcus mutans; Biomem- brane; in vitro; Anti-bacterial activity; Mechanism
龋病是一种口腔内多因素疾病,与心血管疾病、癌症一起被列为人类三大重点防治的慢性非传染性疾病[1]。虽然龋病的病程发展较为缓慢,但是其发病率高、流行区域广泛,不容忽视。细菌的存在是龋病发生的基础,而牙菌斑生物膜是龋病发生所依赖的微环境[2]。变异链球菌是目前公认的主要致龋菌群,常黏附于牙面形成生物膜而导致龋病[3]。糖代谢是变异链球菌致龋的重要途径:变异链球菌以蔗糖为底物,可以合成细菌胞外多糖(EPS),而合成EPS和形成生物膜的能力是其经典毒力表型,这些毒力因子在变异链球菌致病过程中发挥着重要作用[4]。
目前,抗生素、氟化物以及免疫防龋等的使用已被证明能有效地抑制口腔内的致龋菌,但这些方法存在会产生耐药性或致使口腔菌群失调等问题[5]。而天然产物因其毒副作用小的优势,逐渐成为防龋药物研究开发的热点[6]。鞣花酸作为一种多酚二内酯成分,是没食子酸的二聚衍生物,存在于许多水果(如覆盆子、石榴等)及药用植物(如五倍子、地榆等)中[7]。鞣花酸因具有多种生物活性(如抗氧化、抗癌、抗突变、抑制溃疡、抑制人体免疫缺陷病毒等)而受到广泛关注[8-9]。近年来,许多多酚类化合物(如茶多酚、厚朴酚等)被证实具有广谱的抑菌效果,且对口腔致龋菌有良好的抑制作用[10]。鞣花酸作为一种天然的多酚类成分,国内外对其抑菌作用,特别是其对口腔致龋菌的抑制作用及机制的研究报道相对较少。因此,本研究以鞣花酸为研究对象,通过考察对口腔主要致龋菌——变异链球菌的生长、细菌生物膜形成等毒力因子的影响,探索其在防治龋病方面的开发应用潜力。
1 材料
1.1 仪器
C2型激光扫描共聚焦显微镜(日本Nikon公司);311型二氧化碳培养箱(美国Thermo公司);752型紫外分光光度计(上海菁华科技仪器有限公司);4K15型冷冻离心机(美国Sigma公司);LDZX-75KBS型高压蒸汽灭菌锅(上海申安医疗器械有限公司);SMP500型酶标仪(德国Spectro Max公司)。
1.2 药品与试剂
复方氯己定含漱液(江苏晨牌邦德药业有限公司,批号:201810232,规格:500 mL,含葡萄糖酸氯己定0.6 g、甲硝唑0.1 g);鞣花酸对照品(中国食品药品检定研究院,批号:111959-201802,纯度:≥98%);脑心浸肉汤(BHI)培养基(批号:1226L031)、刃天青染色剂(批号:512C031)均购自北京索莱宝科技有限公司;活/死细菌染色试剂盒(货号:L13152)、磷酸盐缓冲液 (PBS,批号:NXL0739)均购自赛默飞世尔生物化学制品(北京)有限公司;乳酸脱氢酶(LDH)试剂盒(中国南京建成生物工程公司,批号:20181025);其余试剂均为分析纯,水为灭菌蒸馏水。
1.3 菌种
变异链球菌标准菌株(ATCC 700610)由新疆医科大学中心实验室提供。
2 方法
2.1 菌悬液的制备
取常规复苏的变异链球菌标准菌株接种于BHI液体培养基中,于37 ℃培养箱中培养24 h后,取菌液在BHI板上划线培养24 h,然后挑取单菌落在BHI液体培养基中以同样条件纯培养。待细菌进入对数生长期后,用紫外分光光度计调整菌液浓度约107 CFU/mL[在630 nm波长处的吸光度(OD)为0.2],备用。
2.2 抑菌圈的测定
采用打孔法抑菌试验进行抑菌圈测定。将鞣花酸对照品用5%二甲基亚砜(DMSO)溶液溶解后制成质量浓度为50 mg/mL的母液;再用BHI液体培养基将母液按二倍稀释法稀释成鞣花酸质量浓度分别为25、12.5、6.25、3.125、1.562 5 mg/mL的药液。取100 μL菌悬液(107 CFU/mL,下同)均匀涂布在BHI平板上,再以打孔器打孔。设置鞣花酸不同质量浓度組(1.562 6~50 mg/mL)、阴性对照组(5%DMSO)和阳性对照组(复方氯己定含漱液),每组重复设置3个孔,每孔中加入20 μL相应样品溶液,然后于37 ℃培养箱中培养24 h。取出后,以十字交叉法测定抑菌圈直径,取平均值。结果判定按《药理实验方法学》标准[11]:抑菌圈直径<10 mm为无抑菌活性,10 mm为轻度敏感,11~15 mm为中度敏感,16~20 mm为高度敏感。
2.3 最小抑菌浓度的测定
使用96孔板,按100 μL/孔加入菌悬液,设置鞣花酸不同质量浓度组(50、25、12.5、6.25、3.125、1.562 5 mg/mL)、阴性对照组(5%DMSO溶液)和阳性对照组(复方氯己定含漱液),每组重复设置3个孔。每孔中加入100 μL相应样品溶液,然后37 ℃培养箱中培养24 h。每孔中加入刃天青染色剂(1 mg/mL)20 μL,4 h后观察,由蓝色变为粉色的药物浓度即为最小抑菌浓度(MIC)。
2.4 最小杀菌浓度的测定
根据MIC值测定结果,选择药液浓度≥MIC的各孔菌悬液,分别划线于BHI平板上,将平板置于37 ℃培养箱中培养24 h,观察无可见菌落生长的最低浓度即为最小杀菌浓度(MBC)。
2.5 变异链球菌细菌生物膜形成情况考察
采用结晶紫染色法进行测定。使用96孔板,按100 μL/孔加入菌悬液,设置鞣花酸不同质量浓度组(1/8MIC、1/4MIC、1/2MIC、MIC)、阴性对照组(5%DMSO溶液),每组重复设置3个孔,每孔加入100 μL相应样品溶液,然后置于37 ℃培养箱中培养24 h后,吸弃上清液。沉淀用无菌PBS轻轻洗涤2次,加入100 μL 0.1%结晶紫,对形成的生物膜染色15 min。弃去染料,用无菌PBS冲洗2次,干燥后每孔加入100 μL 95%乙醇溶液,溶解已被染色的生物膜上的结晶紫。采用酶标仪于540 nm波长处测定其OD值,并计算细菌生物膜存活率:细菌生物膜存活率(%)=1-[(1-OD给药组/OD阴性对照组)×100%]。
2.6 变异链球菌细菌生物膜结构的观察
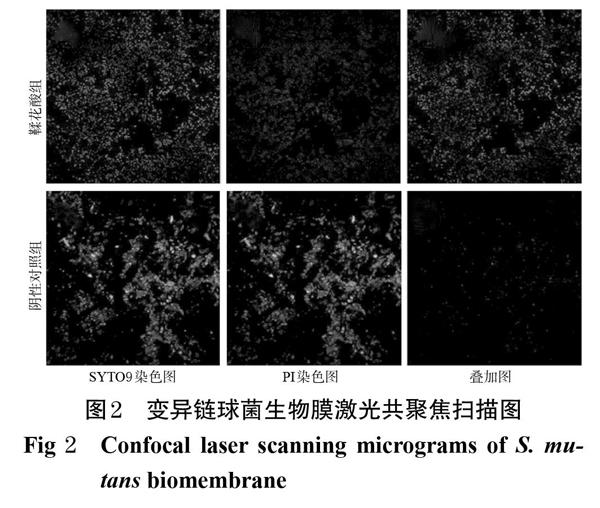
采用激光扫描共聚焦显微镜进行观察。按500 μL/皿的量將菌悬液加入激光扫描共聚焦专用培养皿中,设置鞣花酸组(1/2MIC)和阴性对照组(5%DMSO溶液),每组设置3个平行皿,每皿加入500 μL相应样品溶液,置于37 ℃培养箱中培养24 h后,吸弃上清液,以无菌PBS洗去浮菌,用2%甲基纤维素固定后,加入制备好的活/死细菌荧光染料20 μL[按说明书将试剂盒中荧光染色剂SYTO9和碘化丙啶(PI)按照 1 ∶ 1(V/V)的比例混合溶于适当体积的无菌水中],室温下避光孵育20 min,然后立即在激光扫描共聚焦显微镜下观察。活菌被SYTO9染色后发出绿色荧光,死菌被PI染色后发出红色荧光,SYTO9和PI染色叠加图中黄色表示活菌和死菌重叠处。
2.7 变异链球菌中EPS生成情况考察
采用苯酚硫酸法进行测定。按500 μL/管的量将菌悬液加入无菌离心管中,以5%DMSO溶液为阴性对照,考察不同质量浓度(1/8MIC、1/4MIC、1/2MIC、MIC)鞣花酸对变异链球菌中EPS生成的影响,每个样品设置3个平行管,每管中加入5 mL相应样品溶液,然后置于37 ℃培养箱中培养16 h。在4 ℃条件下以5 000 r/min离心20 min(下同),收集上清液;用无菌蒸馏水重悬沉淀并再次离心,收集上清液,合并2次上清液(含有水溶性EPS)。然后加入0.1 mol/L NaOH溶液5 mL重悬沉淀,离心2次,收集上清液(含有水不溶性EPS)。以0.22 μm的滤膜分别过滤以上2种上清液,各取适量分别加入3倍量冷却的95%乙醇溶液,4 ℃过夜以沉淀EPS。次日再次离心,弃水相,沉淀物分别加入5 mL蒸馏水和5 mL 0.1 mol/L NaOH 溶液溶解。取上述含2种EPS的溶液各1 mL,分别加入5%冰苯酚1 mL,摇匀,迅速加入浓硫酸5 mL,摇匀,放置5 min后,放入沸水浴中反应15 min后,冷却到室温。采用紫外分光光度仪于490 nm波长处测定其OD值,并分别计算水溶性EPS和水不溶性EPS的抑制率:EPS抑制率(%)=(1-OD给药组/OD阴性对照组)×100%。
2.8 变异链球菌细胞外基质中LDH活力的测定
采用还原型辅酶Ⅰ氧化法进行测定。使用96孔板,按100 μL/孔加入菌悬液和等量的BHI液体培养基后,置于37 ℃培养箱中培养24 h。弃去上清液,沉淀用无菌PBS缓冲液清洗2次。设置鞣花酸不同质量浓度组(1/8MIC、1/4MIC、1/2MIC、MIC)和阴性对照组(5%DMSO溶液),每组设置3个平行孔,在清洗过的培养孔(含有沉淀)中加入200 μL相应样品溶液后,置于37 ℃培养箱中培养24 h。离心,收集上清液,按照LDH试剂盒说明书操作测定LDH活力。
2.9 统计学方法
采用SPSS 12.0软件对试验数据进行统计分析。计量资料以x±s表示,采用单因素方差分析的Dunnett(双侧)检验进行组间比较。P<0.05为差异有统计学意义。
3 结果
3.1 抑菌圈测定结果
结果显示,5%DMSO作为溶剂对变异链球菌的生长无明显变化。12.5~50 mg/mL鞣花酸对变异链球菌产生了抑菌圈,且抑菌圈的直径随着药物质量浓度的增加而增大,其中50 mg/mL鞣花酸对变异链球菌抑菌圈的大小与复方氯己定含漱液相近,对变异链球菌均为高度敏感。抑菌圈直径测定结果见表1。
表1 抑菌圈直径测定结果(x±s,n=3,mm)
3.2 MIC和MBC测定结果
结果显示,鞣花酸对变异链球菌的MIC为12.5 mg/mL、MBC为25 mg/mL,表明鞣花酸对变异链球菌有抑制作用。
3.3 细菌生物膜存活率的测定结果
结果显示,不同质量浓度鞣花酸作用后,变异链球菌生物膜存活率较阴性对照组均显著降低(P<0.01),且呈明显剂量依赖趋势。在MIC浓度下,变异链球菌生物膜的存活率仅为(16.41±1.346)%。细菌生物膜存活率测定结果见图1。
3.4 细菌生物膜结构的观察结果
染色结果显示,阴性对照组中细胞互相黏附聚集形成团块,主要呈绿色荧光,表示多为活菌,细菌生物膜结构完整。鞣花酸组中,多呈红色荧光,表明经1/2MIC鞣花酸干预后细胞多为死菌,生物膜结构被破坏。变异链球菌生物膜激光共聚焦扫描图见图2。
3.5 细菌中EPS生成抑制率测定结果
结果显示,鞣花酸对变异链球菌中水不溶性EPS和水溶性EPS的生成均有显著抑制作用,不同质量浓度鞣花酸对2种多糖的生成抑制率均较阴性对照显著升高(P<0.01),且该抑制作用随着鞣花酸质量浓度的增大而增强,但鞣花酸对变异链球菌水不溶性EPS的抑制作用强于其对水溶性EPS的抑制作用。EPS的生成抑制率测定结果见图3。
3.6 细菌细胞外基质中LDH活力的测定结果
结果显示,不同质量浓度鞣花酸作用后,细菌细胞外基质中LDH活力均有所提高,且呈剂量依赖趋势。与阴性对照组比较, 1/4MIC、1/2MIC、MIC鞣花酸组细菌细胞外基质中LDH活力均显著升高(P<0.01)。LDH活力测定结果见图4。
4 讨论
龋病是口腔内的慢性多因素疾病,寻找安全、有效、经济的防龋药品一直是龋病防治研究的重点[12]。天然药物因其毒副作用小、取材方便和经济等特点,在龋病防治中的作用日益受到重视[13]。细菌的存在是龋病发生的第一要素,细菌在口腔中的存在形式主要为生物膜状态,当浮游细菌黏附团聚形成生物膜后,能快速适应新的生长环境,这种由细菌和基质搭建的紧密生物膜结构,成为了阻碍药物穿透的有力屏障[14]。在这种状态下,生物膜结构的细菌比浮游状态下的同种细菌耐药性更强,并且其致毒力和对抗宿主免疫防御的能力也更强[15]。因此,在研究中除了研究浮游状态下细菌的生长变化外,对于生物膜状态下细菌的生长、代谢的研究显得更加重要。EPS是细菌以蔗糖为底物分泌出的紧密围绕菌体细胞的荚膜或者黏质层,可以参与生物膜的基质组成。其中,水不溶性EPS能够促进细菌的蔗糖依赖性细胞黏附,加快生物膜的形成和龋病的发展;并且,其还具有生物屏障作用,可以限制生物膜内外各种物质的出入[16]。水溶性EPS是细菌在生物膜内的能量补充剂,在外源性糖缺乏时,其可以降解成单糖而提供能量[6]。LDH以高浓度存在于细菌细胞内,是变异链球菌中的固有酶,可以调节细菌的酸代谢[17]。由于LDH主要存在细菌细胞内,故可以通过测定细胞外基质中LDH活力来判定药物对细菌细胞壁及细胞膜的影响[18],从而推测药物可能的抑菌机制。因此,关于药物对口腔内致龋细菌的作用研究需要从药物对细菌的生长、生物膜的形成、代谢、形态结构、胞外基质的影响等多方面进行。
本研究通过打孔法抑菌圈试验测定抑菌圈直径,来初步判定鞣花酸对变异链球菌的抑制作用。结果显示,12.5~50 mg/mL鞣花酸對变异链球菌产生了抑菌圈,且抑菌圈直径>15 mm。研究中选用复方氯己定含漱液为阳性对照药,该药品中每500 mL中含葡萄糖酸氯己定0.6 g、甲硝唑0.1 g,为口腔常用的抑菌消炎药[19]。本研究选用微量稀释法测定了鞣花酸对变异链球菌的MIC,试验中以刃天青显色进行MIC的终点判定,最终得到了鞣花酸对变异链球菌的MIC、MBC分别为12.5、25 mg/mL,该方法比直接观察法更加客观、灵敏。另外,试验结果显示,3.125~25 mg/mL鞣花酸对变异链球菌的生物膜产生了抑制作用,且1/2MIC浓度的鞣花酸可破坏细菌生物膜结构。通过以上试验结果可知,鞣花酸不仅可以抑制浮游细菌的生长,还能抑制细菌生物膜的形成。
除此之外,本研究还对鞣花酸的抑菌机制进行了研究。以1/4MIC~MIC浓度鞣花酸作用后,细菌胞外基质中LDH的活力显著升高(P<0.01)。通过对药物作用后细菌中EPS进行收集测定,发现鞣花酸对变异链球菌水不溶性EPS和水溶性EPS均有不同程度的抑制作用。通过以上研究可知,鞣花酸可以阻断细菌毒力因子的作用途径:第一,其可以通过抑制EPS的形成能力以降低细菌的黏附、聚集及能源供给,干扰细菌内正常的糖代谢,从而影响细菌生物膜的形成;第二,其还可以通过对变异链球菌的细胞产生一定程度的膜损伤,使存在于细菌胞浆内的LDH从胞浆中释放出来,破坏细胞的正常形态和物质交换从而降低细菌活性。另外,在测定鞣花酸对EPS的抑制率时,笔者发现其对水不溶性EPS的抑制率较对水溶性EPS的高,可能是因为水不溶性EPS具有高稳定性、强黏性、不易被降解的特性,同时也是细菌具有更强致龋性的原因之一[20],因此更加说明鞣花酸能通过干扰EPS途径抑制细菌生物膜的形成。
综上,鞣花酸对变异链球菌的生长以及生物膜的形成均有抑制作用。其机制可能是通过抑制EPS产生、降低细菌的黏附、破坏细菌细胞膜,从而降低细菌活性。本研究为将鞣花酸开发成天然的防治龋病药物提供了一定的实验参考,但其更深入的抑菌作用及机制还有待进一步研究。
参考文献
[ 1 ] 饶瑞瑛,任元雪,李欣瑜,等.白及提取物抗变异链球菌致龋效果的研究[J].中国微生态学杂志,2018,30(3):291- 295.
[ 2 ] 刘蕾,何光志,王文佳.银杏抗菌肽蛋白基因原核表达及其重组蛋白的体内外抑菌作用研究[J].中国药房,2019,30(18):2513-2518.
[ 3 ] VARON SE,SHRON E,ZABROVSKY A,et al. Antibacterial orthodontic cements and adhesives:a possible solution to Streptococcus mutans outgrowth adjacent to orthodontic appliances[J]. Oral Health Prev Dent,2019,17(1):251-296.
[ 4 ] 卢国英,刘建党,
[ 5 ] 陈思佳.柠檬精油等提取物对变形链球菌luxS基因的影响[D].天津:天津医科大学,2015.
[ 6 ] 罗晓东,魏丽芳,钟昳,等.植物多酚提取物对致龋菌作用的研究进展[J].中国药房,2019,30(1):73-77.
[ 7 ] 吴小磊,钟晨,史金铭.鞣花酸的生物学效应[J].中国林副特产,2019,18(1):73-78.
[ 8 ] 周本宏,张红盼,郭咸希,等.鞣花鞣质类成分研究进展[J].中国药师,2017,20(10):1838-1841.
[ 9 ] 谭登航,王鹏娇,张硕,等.刺梨不同药用部位中鞣花酸的含量测定及其醇提物的体外抗氧化活性研究[J].中国药房,2019,30(9):1236-1240.
[10] 范高福,胥振国,刘修树,等.植物提取物鞣花酸的药理作用及制剂研究进展[J].基因组学与应用生物学,2016,35(12):3562-3568.
[11] 徐叔云,卞如濂,陈修.药理实验方法学[M]. 3版.北京:人民卫生出版社,2005:1647-1662.
[12] YANG X,TOMAS BF. Tea is a significant dietary source of ellagitannins and ellagic acid[J]. J Agric Food Chem,2019,67(19):1326-1335.
[13] 宋颖,周京琳,何远丽,等. Sortase A与变异链球菌致龋性关系的代谢组学研究[J].华西口腔医学杂志,2018,36(4):360-366.
[14] XU ZT,LI MY. Comparison of inhibitions to oral bacteria among 10 Chinese herbs[J]. Chin J Mod Appl Pharm,2000,17(4):277-279.
[15] 刘晓璇,方圆,傅志华,等.植物多酚提取物对致龋菌作用的研究进展[J].中国地方病防治杂志,2019,34(2):147-149.
[16] 宋忠臣,束蓉,姚菊芳.没食子对口腔常见细菌抑制作用的体外研究[J].口腔医学研究,2006,22(6):634-638.
[17] SHAO D,LI J,BATES R,et al. Inhibition of gallic acid on the growth and biofilm formation of Escherichia coli and Streptococcus mutans[J]. J Food Sci,2015,80(6):299-305.
[18] KAWARAI T,NARISAWA N,YONEDA S,et al. Inhibition of Streptococcus mutans biofilm formation using extracts from Assam tea compared to green tea[J]. Arch Oral Biol,2016.DOI:10.1016/j.archoralbio.2016.04.002.
[19] 王卫,邓倩,郭婉晴,等.洗必泰在口腔护理中应用的Meta分析[J].临床口腔医学杂志,2015,31(6):357-360.
[20] 吴琳,叶峥嵘,梁瑾.细菌耐药现状及中药应对策略概述[J].实用中医药杂志,2012,28(2):159-160.
(收稿日期:2019-11-05 修回日期:2020-01-17)
(编辑:林 静)

