不同动物肌肉组织中DNA提取方法研究
程 浩,查 勇 ,高丹丹,丁功涛,马忠仁,冯若飞
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.西北民族大学 生物医学研究中心,甘肃 兰州 730030;3.日照市产品质量监督检验所,山东 日照 276800 ;4.陕西省土地工程建设集团有限责任公司宝鸡分公司,陕西 西安 710075)
随着食品工业的快速发展和居民生活水平的不断提高及饮食结构的改善,我国居民对于肉类食品需求增加的同时,在食品安全方面所面临的问题也日益严峻[1-2].食品中肉制品掺假的现象也日益增多[3-4].近些年来,在肉制品领域发生了中国的“瘦肉精事件”、瑞典、英国和法国的“鸡、马肉风波”、沃尔玛的“狐狸肉事件”等[5-6].饲料产品的安全又是畜产品加工养殖业的基础,总有一些不法分子铤而走险,添加患病的动物性成分在饲料里,轻则会导致大量牲畜患病死亡,例如非洲猪瘟、疯牛病等,重则会对人类健康带来巨大的危害[7-9].所以对食品和牲畜饲料中动物源性成分检测技术就显得尤为重要.
随着科学技术的发展,目前已有ELISA法、光谱法、电子鼻等多种食品和牲畜饲料中动物源性成分检测技术手段,但是这些检测技术或多或少都有一定的缺陷,如ELISA法不能很好的对经过热加工变性的样本进行检测,光谱法设备昂贵,操作复杂,电子鼻对环境要求很高等.而PCR技术在食品与饲料安全检测、提升动物配种效果、增加产乳量、改善肉质、种质资源保护等方面具有很大的优势[10].Cai等人[11]利用Taqman实时荧光定量PCR法,根据牛β-肌动蛋白和绵羊催乳素受体基因(PRLR)序列设计了特异性引物来检测牛源和绵羊源性成分,结果表明,此方法检测精度和效率均高,可以作为官方和第三方检测机构的检测依据,用来保证食品和饲料行业产品的质量.Silveira等人[12]采用PCR-RFLP技术研究了生长激素受体(growth hormone,GH)、胰岛素生长因子I(insulin-like growth factor 1,IGF-I)和信号转导和转录激活因子5A(STAT5A,5A)基因多态性与血清YGF-I关联后的荷斯坦奶牛的繁殖能力和产奶量,结果表明,IGF-I与泌乳奶牛的首次排卵减少和受孕间隔天数降低相关,且GHRAluIT等位基因与提高生育力上有一定的关联.Zhao等人[13]为了降低食品风险,建立牛肉的可追溯性,使用AFLP-PCR方法从中国不同地方采了牛6个品种的89个个体,获得了八对组合引物,总共产生了1095个多态性片段,并且每种引物都可以成功区分所有检测的个体和所检测的6个品种.Martin等人[14]开发了一种SYBR-Green实时PCR法用于对饲料中猪源性成分进行定性和定量检测,结果表明,该方法对饲料中猪DNA的检测和定量限低至0.1%.
建立PCR检测技术,首先是要获取高浓度和高纯度的DNA[15].常规提取基因组DNA的方法有:浓盐法、阴离子去污剂法、水抽提法、试剂盒法等[16-18],但是传统提取方法实验过程繁琐、消化时间长且所提取的DNA质量难以保证后续分子生物学的检测,食品或者饲料中经常将原材料进行热加工处理后才进行售卖,因此本研究采用试剂盒法、SDS法和异硫氰酸胍法提取不同动物肌肉组织的基因组DNA,并对所提取DNA的纯度、浓度进行检测和PCR检测对比分析,从中筛选出一种动物性基因组DNA提取方法,为食品中肉制品检测和动物营养以及动物遗传育种的分子生物学技术鉴定提供一个经济适用、操作简单、快速,且满足后续PCR检测分析的DNA提取方法.
1 材料与方法
1.1 材料
1.1.1 实验原材料
生鲜猪肉、牛肉、羊肉、鸡肉、草鱼肉均购自兰州市亚欧超市.高压肉(121℃,高压 30 min).
1.1.2 仪器与试剂
仪器:DYY-6D型电泳仪(北京六一生物科技有限公司);PCR仪(德国 Biometar GmbH公司);ChemiDocTMTouch lmaging System(美国伯乐);Varioskan LUX-1510型酶标仪(美国赛默飞世尔).
试剂:Tissue DNA Kit 50次(美国Omega Biotek公司);2×Taq Plus Mix、100bp DNA Ladder(北京天根生化科技有限公司);RNase A(广州美基生物科技有限公司);DL 10 000 DNA Marker、6×Lodding Buffer(日本TaKaRa公司);TES裂解液(1mol/L Tris-Hcl、0.85% Nacl、0.5 mol/L EDTA10%十二烷基磺酸钠);异硫氰酸胍裂解液(5 mol/L异硫氰酸胍,0.05 mol/LTris-Hcl、0.02 mol/L EDTA,1.3%Triton-100);TE缓冲液(0.05 mol/L Tris-Hcl、0.02mol/LEDTA);Tris-Hcl 、EDTA、SDS、异硫氰酸胍、Triton-100、酚、氯仿、异戊醇、乙醇等化学试剂均为分析纯.
1.2 方法
1.2.1 样品制备
将待测动物肌肉组织样本用生理盐水清洗三遍后,去除动物组织中的脂肪及结缔组织后称取30 mg,各取两份,其中一份放在高压蒸汽灭菌锅内加热,将高压高温加热后的组织样品以及生鲜组织样品分别放入液氮预冷的研钵中,然后将液氮缓缓加入研钵中,将样品迅速研磨至粉末状后将动物组织样本分别加入1.5 mL离心管内.
1.2.2 基因组DNA的提取1.2.2.1 SDS法
取50 mg样品至1.5 mL离心管中,加入400 μLTES裂解液后置于组织研磨仪上至均浆状态,然后加入200μL的SDS和20 μL蛋白酶K后56 ℃水浴消化2h,期间每半小时颠倒混匀一次直至溶液变透明水浴后的裂解液加入等体积的饱和酚,缓慢颠倒混匀5~6 min后静置5 min,12 000 r/min离心10min;将上清液转移到全新的1.5 mL离心管中;加入相同体积的饱和酚∶氯仿∶异戊醇(25∶24∶1),缓慢颠倒至均匀,静静搁置4~5 min,12 000 r/min离心10 min;取上清液至全新1.5 mL离心管中,加入等体积的氯仿∶异戊醇(24∶1),摇晃至充分均匀,静置4~5min,12 000 r/min离心10 min;取上清,加入两倍体积的无水乙醇(无水乙醇需在-20 ℃预冷20 min),12 000 r/min离心10 min;将无水乙醇排净后加入1 mL的75%的乙醇,缓慢吹打,12 000 r/min离心10 min,此步骤重复一次;然后将离心管放在室温干燥5~10 min后加入100 μL TE将DNA溶解后放于-20 ℃备用.
1.2.2.2 异硫氰酸胍法
取50 mg样品至1.5 mL离心管中,参照文献[19]的提取方法,取50 mg样品至1.5 mL离心管中,加入200 μL TE后置于组织研磨仪上至均浆状态后,加入400 μL异硫氰酸胍裂解液,涡旋混匀;在离心管里加入600 μL酚∶氯仿∶异戊醇(25∶24∶1),涡旋剧烈震荡15 s,13 000 r/min离心10 min;将上清移至新的1.5 mL离心管中,加入等体积氯仿∶异戊醇(24∶1),涡旋震荡15 s后13 000 r/min离心10 min;将上清液移至新的1.5 mL离心管中,加入0.8倍体积的异丙醇,12 000 r/min离心10 min;弃掉异丙醇后用1 mL的70%乙醇将离心管底部的沉淀清洗一次后将离心管放置室温10~15 min干燥,然后加入100 μL TE将DNA溶解后放于-20 ℃备用.
1.2.2.3 试剂盒法
将30 mg组织置于1.5 mL离心管内,按照Tissue DNA Kit 50次(美国Omega Biotek公司)试剂盒说明书提取模板DNA,将所提取的的DNA储存在-20 ℃备用.
1.2.3 DNA浓度及纯度测定
用酶标仪检测DNA在230、260和280 nm处的吸收值,以及A260/A280、A260/A230值,来检测三种方法提取的DNA中盐分、蛋白质、酚等杂质的去除情况[20],并同时检测DNA浓度.
1.2.4 DNA质量检测
配制1%琼脂糖凝胶,吸取5μLDNA提取的样品基因组DNA溶液与上样缓冲液混匀后,加入上样孔,并在另一个孔中加入DL10 000分子量标准,配制1.5%琼脂糖凝胶,在PCR扩增产物中加入上样缓冲液混匀后加入上样孔,并在另一个孔中加入100 bp分子量标准.电压设定为120 V,电泳30 min后,在凝胶成像分析仪上扫描.
1.2.5 PCR反应条件的建立1.2.5.1 引物设计
在NCBI中查找猪(基因ID:808513)、牛(基因ID: 3283889)、绵羊(基因ID:808260)、鸡(基因ID:39116918)、草鱼(基因ID:13230650)的线粒体细胞色素B基因序列,使用primer5.0软件设计引物,见表1.
1.2.5.2 PCR反应条件的建立
PCR反应体系为25 μL,各成分含量为:2×Taq酶12.5 μL,上下游引物各1 μL,模板1 μL,无菌水补足至25 μL,轻柔混匀后短暂离心,在PCR仪上开始循环扩增.循环参数为:95 ℃预变性3min,然后进行40个循环,每个循环为95 ℃变性2min,62 ℃退火30 s,72 ℃延伸20 s.
表1 PCR引物序列

2 结果与分析
2.1 DNA的完整性
在提取DNA后,将基因组DNA在1%琼脂糖凝胶上进行电泳检测,通过图1a、图1b可知三种方法对生鲜组织和高压组织都能提取出高分子量的基因组DNA(>10 Kb),生鲜肌肉组织和高压肌肉组织大部分都出现了弥散性条带,生鲜肉基因组DNA条带弥散性低于高压肉基因组DNA,弥散性上SDS法>异硫氰酸胍法>试剂盒法.表明有可能在提取过程中DNA已经出现不同程度的降解,或者在混匀试剂过程中涡旋力度太大,造成长链DNA断裂形成较短DNA片段,所以导致了弥散性条带的出现.所提取的DNA完整性与刘娟、王戊藤等人实验结果相比较[21-22],本实验的条带弥散性略高,但是条带的亮度也高,说明本实验所提取的DNA浓度高,由于在实验中混匀用力过度才导致DNA条带弥散性较为严重.
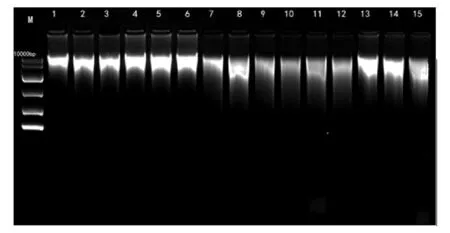
M:marker(DL10 000 bp);1、2、3、4、5为SDS法提取的高压组织基因组DNA;6、7、8、9、10为试剂盒法提取的高压组织基因组DNA;11、12、13、14、15为异硫氰酸胍法提取的高压组织基因组DNA.
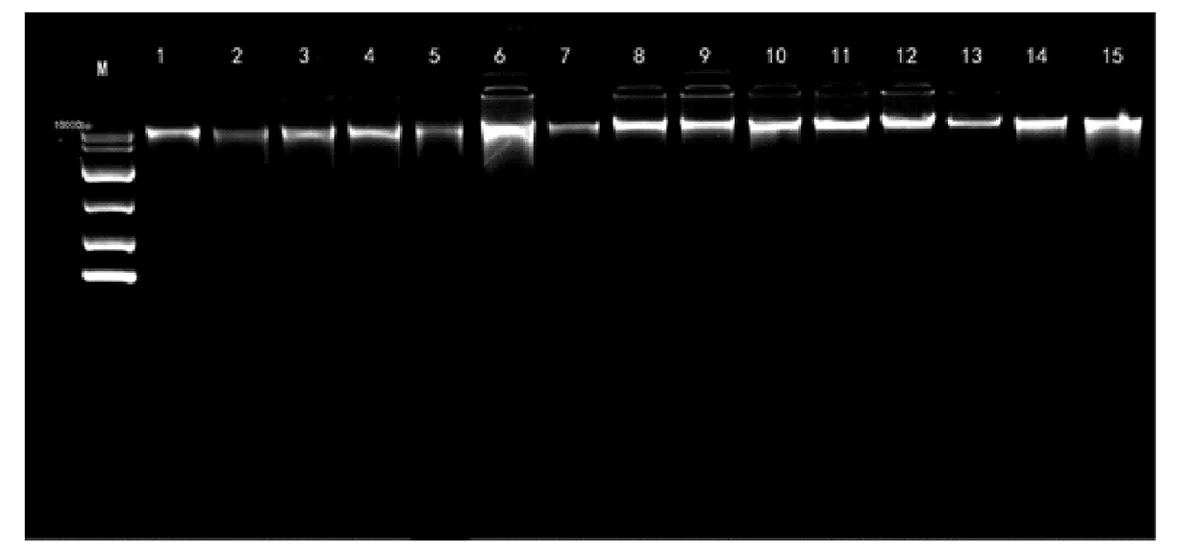
M:marker(DL10000bp);1、2、3、4、5为试剂盒提取的基因组;6、7、8、9、10为异硫氰酸胍法提取的基因组;11、12、13、14、15为SDS法提取的基因组.
2.2 DNA的纯度及浓度测定
用酶标仪测定所提取DNA的纯度和浓度,结果如表2、表3所示.OD260/OD280的比值用来体现蛋白质和酚等杂质的去除情况,OD260/OD280的比值在1.8左右,说明DNA纯度高,低说明DNA中有蛋白质以及苯酚等杂质未除尽.比值高则说明有RNA.230 nm处是多肽、苯酚、碳水化合物的吸光度,所以OD260/OD230比值反映了DNA样品碳水化合物和盐类等物质的污染情况.OD260/OD230比值一般大于2,比值低说明有盐分、氨基酸和核苷酸等小分子物质存在[23].
SDS法、异硫氰酸胍法、试剂盒法对生鲜所提取DNA的OD260/OD280的比值范围分别是:1.67~1.82,1.78~1.94,1.84~1.92;OD260/OD230比值范围分别是:1.83~2.24,1.94~2.14,2.14~2.35.对热加工组织所提取的DNA的OD260/OD280得到比值范围分别是:1.61~1.75,1.72~1.98,1.91~1.86,OD260/OD230比值范围分别是:1.91~2.11,1.96~2.15,2.04~2.27.总体来看,生鲜样品及热加工样品所提取的DNA纯度及浓度是试剂盒法>异硫氰酸胍法>SDS法,且生鲜组织所提取DNA的纯度和浓度都优于热加工组织.可能是因为肌肉组织经过热加工后,样品中基因组DNA受高温、高压影响会发生一定程度的降解;SDS法和异硫氰酸胍法在操作时需要转移上清液至另一离心管中,但是在使用移液枪吸取上清液时容易将离心后有机相和水相中所沉淀的杂质吸起.SDS法和异硫氰酸胍法所用试剂裂解效果不如试剂盒法.与王萍等人[24]所采用的酚-三氯甲烷法、聚乙烯吡咯烷酮法(PVP法)相比,本实验异硫氰酸胍法、SDS法在提取的DNA浓度和纯度上都要比前者要高.
表2 不同物种生鲜肉DNA浓度及纯度检测
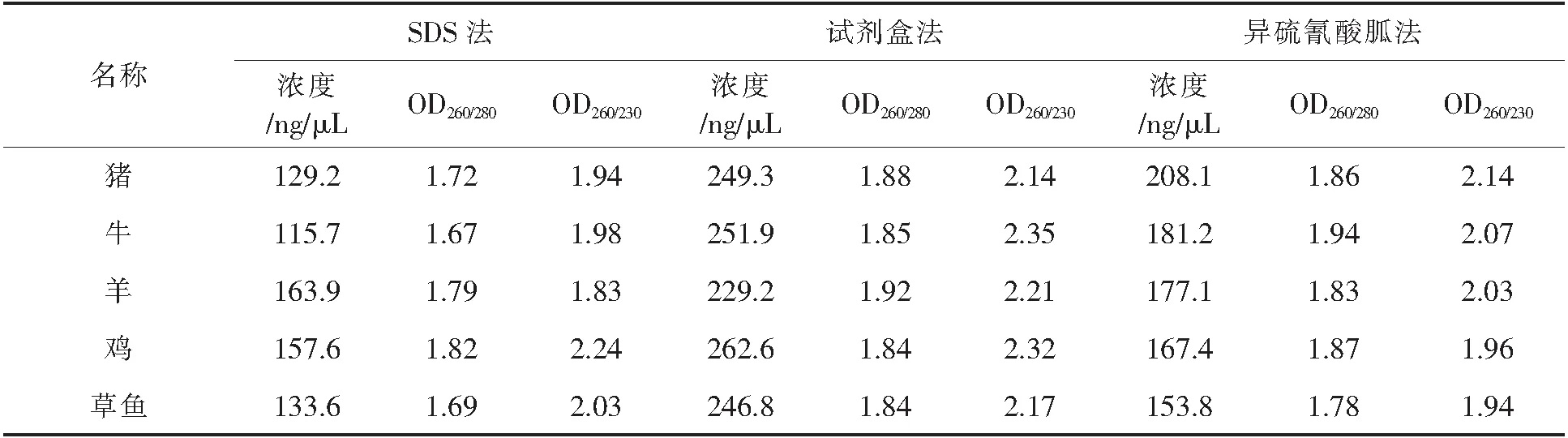
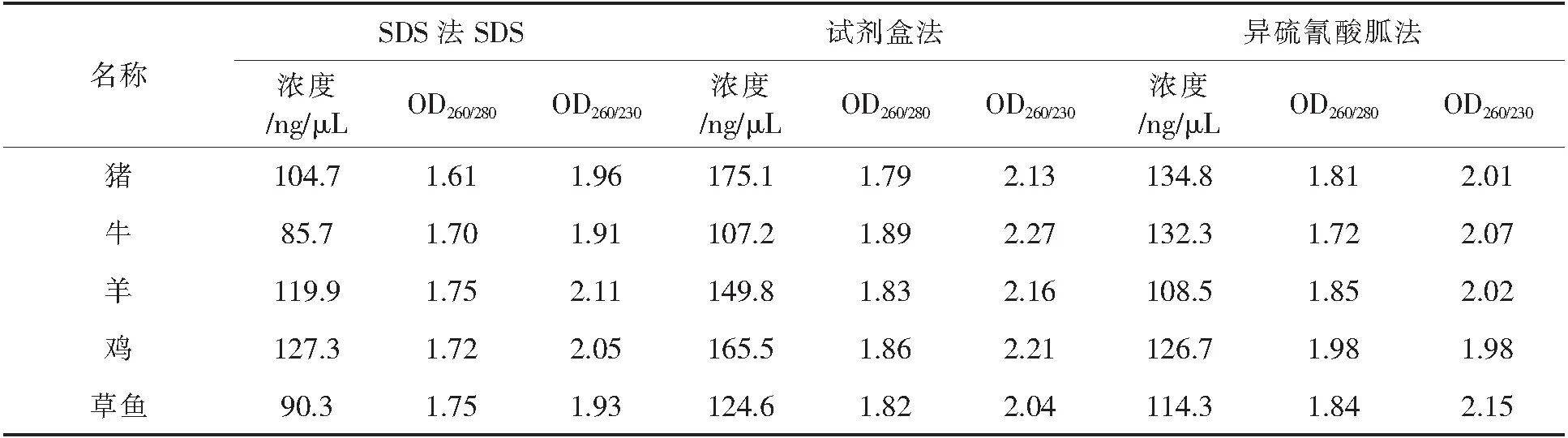
表3 不同物种高压肉DNA浓度及纯度检测
2.3 PCR扩增
将三种方法提取的生鲜组织和热加工组织的DNA分别扩增猪、牛、羊、鸡、草鱼的线粒体细胞色素B基因,电泳结果见图2所示.各样品之间扩增条带明亮程度差距较大,且明亮程度与DNA提取浓度的高低趋势相一致.图2a的试剂盒法和异硫氰酸胍法提取的生鲜组织DNA经过PCR扩增后,电泳检测的条带亮度清晰且明亮.SDS法提取的基因组DNA经过PCR后条带明亮度程度不一,10、13、14号样品清晰度和明亮度较差.表明此三个样品PCR产物浓度低且产物质量差.
图2b三种方法提取的基因组DNA经PCR扩增后于琼脂糖凝胶电泳检测观察,发现4、9、14、15号条带颜色昏暗且条带弥散严重,表明样品基因组DNA的PCR产物浓度低,且完整性低于其他样品.
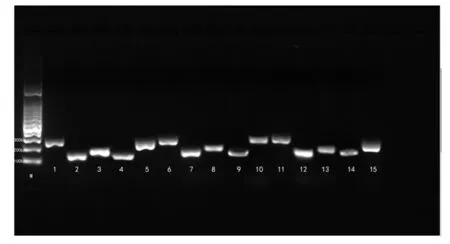
M:marker(100bp);1、2、3、4、5为试剂盒提取的生鲜基因组作为模板;6、7、8、9、10为异硫氰酸胍法提取的生鲜基因组作为模板;11、12、13、14、15为SDS法提取的生鲜基因组作为模板,cytb基因扩增后的效果.
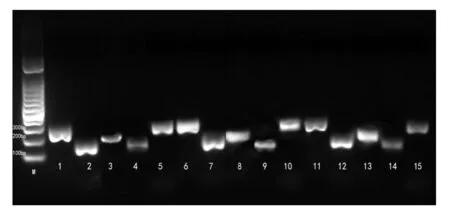
M:marker(100bp);1、2、3、4、5为试剂盒提取的高压基因组作为模板;6、7、8、9、10为异硫氰酸胍法提取的高压基因组作为模板;11、12、13、14、15为SDS法提取的高压基因组作为模板,cytb基因扩增后的效果.
3 讨论
3.1 不同方法提取DNA操作过程及提取质量比较
通过对三种DNA提取方法的比较,发现异硫氰酸胍法无需水浴加热,操作简便、快速,单个样品可以在30 min内完成,比试剂盒法提取时间至少缩短1小时,比SDS法提取时间至少缩短1.5小时.试剂盒法在提取过程中避免使用了有毒的有机溶剂,所以减少了在操作过程中对操作人员的健康损害.异硫氰酸胍法在操作过程中所使用的有毒的有机溶剂比SDS法要少,所以对操作人员的损害较少.将异硫氰酸胍法和试剂盒法所提取的DNA的浓度和纯度进行比较,发现异硫氰酸胍法所提取的DNA的OD260/OD280比值稳定在1.8左右,OD260/OD230的比值均大于2.0,证明异硫氰酸胍所提取的DNA的浓度和纯度高,证明异硫氰酸胍法提取的DNA质量和产率高,蛋白质和盐分等杂质去除效果好,效果仅次于试剂盒法.
3.2 扩增产物比较
通过后续PCR产物的电泳图可知,所得到的扩增带的亮度和完整性完全可以媲美试剂盒法所提取的DNA,所以异硫氰酸胍法所提取的DNA可以满足以PCR为基础的分子生物学检测技术的要求.从扩增产物的质量来看,高压肉扩增条带的完整性稍差于生鲜肉的扩增条带,因为高温高压下导致DNA片段降解断裂,不能形成完整的DNA片段,在扩增过程中,引物不能很好地与DNA链进行结合,所以在扩增过后,高温处理过的扩增产物条带比生鲜肉条带的完整性差,且不均一.
4 结论
1)异硫氰酸胍法所提取的DNA浓度和纯度与试剂盒提取的浓度及纯度相近,都要高于SDS法.
2)异硫氰酸胍法提取的DNA经过PCR扩增后,产物条带清晰明亮,完全满足对PCR扩增要求.
3)异硫氰酸胍提取动物组织基因组DNA,操作简单、快速,DNA产率与质量高.
4)异硫氰酸胍法是一种有效的大量提取动物基因组DNA的方法,并且可以满足PCR等后续分子生物学实验的要求.

