长时程抑郁小鼠模型建立及行为与神经病理特征观察
田野,栗鋆,原一桐,杜若琛,李宵,王菲,王雅丽,邵宏元,王春芳*
(1. 山西医科大学,太原 030001; 2. 山西省人民医院,太原 030001)
抑郁症是一种由多因素引起的情绪障碍,其病情复杂,以持续性悲伤、低自尊、社交退缩、兴趣减低和低落心境等症状为特点,持续数周或以上。 压力被认为是造成重症抑郁的主要原因之一[1]。 大量研究表明,儿童时期经历与抑郁症有着密切联系[2]。 目前的治疗主要基于单胺能系统调节,然而,仍约30%的抑郁症患者对此治疗有部分或完全抗性[3]。
然而,抑郁症的分子调节机制至今仍不清楚,导致抑郁症的临床治疗受到限制。 在抑郁症的基础研究中,抑郁模式小鼠是研究的基石,但是目前而言没有一种能长期稳定表达抑郁症状的小鼠[4]。 目前为止已经有很多抑郁症小鼠构建模型,例如药物诱导抑郁模型、慢性束缚模型、习得无助模型(learned helplessness model,LH)、慢性不可预知温和刺激模型(chronic unpredictable wild stress,CUMS)、早期应激模型(early life stress model,ELS)、社会挫败模型(social defeat model)等[5-6]。 为了不影响药物效果,物理刺激导致的抑郁模型是经常使用的,其中CUMS是最常见的抑郁小鼠模型。 CUMS 小鼠是通过长时间向动物随机施加温和的无法预知的刺激,如限制活动、禁食禁水、冷水游泳、昼夜颠倒等刺激,可导致啮齿动物产生抑郁行为[7-8]。 ELS 小鼠模拟一种早期生活压力的动物模型,可以调节下丘脑-垂体-肾上腺轴(HPA 轴),并影响成年期后续的脑功能和行为[9-10]。 然而,这两种抑郁小鼠模型无法使小鼠长期稳定表达抑郁症状[11]。
本文将综合CUMS 小鼠与ELS 小鼠的构建方法,从小鼠新出生开始给予与母体分离,并在其断乳后给予噪声、强光等一系列刺激来构建长时程抑郁模型(long-term depression model,LTD),为抑郁症的基础研究提供新型的模式小鼠。
1 材料与方法
1.1 材料
1.1.1 实验动物
2 月龄清洁级C57BL/6 小鼠45 只,雌雄比1 ∶1,体重21 ~27 g;清洁级C57BL/6 孕鼠15 只,13 ~14 d 孕龄,体重25 ~33 g;清洁级eGFP 转基因小鼠1 只,2 月龄;清洁级eGFP 转基因孕鼠1 只,13 ~14 d孕龄,体重25 ~33 g。 购于山西医科大学实验动物中心【SCXK(晋)2015-0001】,饲养于山西医科大学实验动物中心屏障环境中【SYXK(晋)2009-0004】。 实验小鼠的饲养过程和其他实验操作均符合实验动物伦理学要求(审批号:IACUC2017-002)以及中华人民共和国《实验动物管理条例》。
1.1.2 主要仪器和主要试剂
荧光显微(OLYMPUS,日本),石蜡切片机(Leica RM 2245,德国),强迫游泳柱(自制),悬尾盒(自制),旷场反应箱(自制),高架十字迷宫(自制),新物体识别(自制)。
1.2 方法
1.2.1 实验模型制备
(1)长时程抑郁模型的制作
将刚出生的新生鼠与母鼠分离,每天分离两次,每次持续2 h,持续14 d。 并在小鼠3 周龄后开始单笼饲养,并给予(1)噪音15 min,(2)倾斜鼠笼12 h,(3)连续光照或黑暗24 h,(4)夹尾1 min,(5)潮湿环境1 h,(6)摇晃鼠笼5 min,(7)限制活动30 min,(8)频闪灯照射15 min,(9)束缚2 h,(10)空水瓶暴露1 h,每天给予1 种应激,连续两天不给予相同刺激,持续21 d。
(2)慢性温和不可预知应激模型的制作
将2 ~3 周龄小鼠单笼饲养,给予和早期长时程抑郁模型相同刺激,每天给予两种应激,连续两天不给予相同刺激,持续21 d[12]。
(3)早期应激模型的制作
将刚出生的新生鼠与母鼠分离,每天分离两次,每次持续2 h,持续14 d。 待小鼠6 周龄时开始实验[13]。
1.2.2 行为学实验
(1)糖水偏好实验
实验分为适应阶段和实验阶段。 适应阶段:实验前1 天将每笼小鼠配备两瓶含有1%蔗糖水的水瓶,自由饮食饲养12 h,随后将一瓶1%的蔗糖水替换成清水,继续自由饮食12 h。 实验阶段:每笼小鼠随机放置一瓶1%蔗糖水和一瓶清水,放置之前统计各自重量,清水和蔗糖水位置每8 h 更换1 次,自实验开始24 h 后统计两瓶水重量,糖水偏好率以蔗糖水溶液的消耗量(g)/总液体的消耗量(g) ×100%表示。
(2)强迫游泳实验
将小鼠放入一个透明圆柱体中(高25 cm,直径14 cm),圆柱体中注入17 ~19 cm 高的温水,使其自由游泳6 min。 统计小鼠在6 min 内后4 min 保持漂浮状态的累计时间。 每只小鼠试验后需换水。
(3)悬尾实验
将小鼠尾部1 cm 通过小夹子固定在一个高55 cm,宽60 cm 的长方体盒内,让其上下左右都难以接触盒壁,并使其头部朝下时离底部有20 ~25 cm,记录其6 min 内后4 min 累计不动的时间。
(4)旷场实验
将小鼠放置于一个旷场反应箱内(长40 cm,宽40 cm,高40 cm),将反应箱底部分为16 小格,外周12 格联合定义为周边区,中间4 格联合定义为中心区;记录6 min 内小鼠处于中心区累积时间。
(5)高架十字迷宫实验
将小鼠放置于由两条开放臂(长30 cm,宽6 cm)和两条闭合臂(长30 cm,宽6 cm,高15 cm)组成,距离地面40 cm 的高架十字迷宫中央,并使小鼠头部面向开放臂;记录6 min 内小鼠累积进入开放臂的时间。
(6)新物体识别实验
实验分为适应阶段和实验阶段。 适应阶段:实验前1 天将小鼠放置在一个正方形反应箱内(长25 cm,宽25 cm),持续10 min。 使小鼠充分熟悉环境;实验阶段:在反应箱内部场地轴对称位置放置两个相同的物体,将小鼠背朝物体放入,让小鼠自由探索10 min;1 h 后,保持物体位置不变,用新物体更换其中一个旧物体,再次将小鼠背朝物体放入,让小鼠自由探索10 min;小鼠鼻子距离物体1 cm 内指向物体或鼻子触及物体可视为探索行为。 记录小鼠探索新物体以及旧物体次数,新物体识别概率视为新物体探索次数/总探索次数× 100%表示。
1.2.3 切片制备
麻醉小鼠后用生理盐水和4%的多聚甲醛灌注小鼠,取出其脑组织,冲洗、脱水、浸蜡、石蜡包埋,以5 μm 的厚度切片,置于荧光显微镜下观察海马各区域神经元。
1.3 统计学分析
所得数据均用SPSS 21.0 统计软件处理,检测结果采用平均值±标准差(±s)表示,自残概率比较采用卡方检验,不同时间行为学检测采用重复测量方差分析,P<0.05 表示差异具有显著性,P<0.01 表示差异极有显著性。
2 结果
2.1 不同建模方式影响小鼠自残概率
在构建3 种不同抑郁小鼠模型过程中,部分小鼠会出现吞噬自己后肢、后肢脚趾或尾部的现象,LTD 小鼠自残概率明显升高(表1),而CUMS 小鼠未出现自残情况。
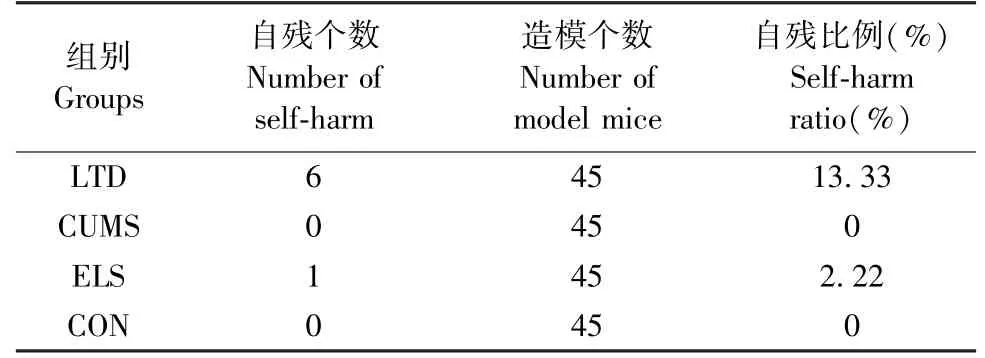
表1 各组小鼠自残比例Table 1 Proportion of self-harm in mice of each group
2.2 长时程抑郁模型长时间影响小鼠抑郁样行为
将三种抑郁小鼠分别造模结束后的1 d、10 d与20 d 进行了抑郁样行为的测定(图1A-C)。 与对照组相比,造模结束后1 d 3 组抑郁模型动物糖水偏好指数显著性降低(P<0.05),10 d 时LTD 小鼠与CUMS 小鼠糖水偏好指数显著性降低(P<0.05),20 d 后与对照组相比仅LTD 小鼠有显著差异(P<0.05)(图1A)。 在强迫游泳实验中,造模结束后1dLTD 小鼠与CUMS 小鼠与对照组相比静止时间有极显著差异(P<0.01),10 d 时LTD 小鼠与CUMS小鼠显著性升高(P<0.05),20 d 时LTD 小鼠对比对照组仍显著性升高(P<0.05)(图1B)。 在悬尾实验中,仅10 d 与20 d 早期长时程抑郁组与对照组相比有显著性差异(P<0.05)(图1C)。
2.3 长时程抑郁模型不会影响小鼠学习记忆能力与焦虑行为
为了探究新的造模方式是否会影响小鼠的焦虑行为和学习记忆能力,将LTD 小鼠与对照组的旷场试验、高架十字迷宫试验和新物体识别试验进行对比(图2A-C),结果均无显著性差异。
2.4 长时程抑郁模型影响小鼠海马神经元存活
为了探究早期长时程抑郁模型是否会影响小鼠海马神经元,构建了一批eGFP 转基因长时程抑郁模型小鼠,待其造模结束1 d、10 d 观察其各区海马神经元(图3)。 结果显示LTD 小鼠CA1 区、CA3区海马神经元结构明显变薄,呈退行性改变。 而DG 区影响不明显。
3 讨论

图1 不同抑郁小鼠抑郁样行为持续时间(±s,n =8)Note.*P<0.05,**P<0.01,vs the control group in the same day.Figure 1 Duration of depression-like behavior in different depressed mice(±s,n =8)

图2 LTD 对小鼠焦虑行为和学习记忆的影响Figure 2 Effect of LTD on anxiety behavior and learning and memory of mice

图3 LTD 对eGFP 转基因小鼠海马CA1 区、CA3 区和DG 区神经元的影响(× 200)Figure 3 Effect of LTD on neurons in hippocampal CA1,CA3 and DG regions of eGFP transgenic mice (× 200)
抑郁症是现当代最常见得精神障碍之一,拥有患病率高、复发率高、潜伏期长、自杀率高等特点。如何有效的防治抑郁症是现当代神经精神医学重要的研究方向之一。 随着对抑郁症的研究越来越深入,没有可以长时间表现抑郁行为的模型的劣势开始逐渐显现。 为了模拟长期抑郁症患者的临床治疗,人们只能选用Wistar Kyoto(WKY)大鼠等转基因鼠作为模式动物,但其对药物的耐受性限制了其广泛应用[14]。
压力性生活事件以及生命早期的不良事件是抑郁症的高危因素[15]。 长期暴露于压力下会导致目标导向的行为减少,并可能成比例地增加患抑郁症的风险[16]。 以此为理论基础,CUMS 小鼠是经典的抑郁模型之一,其病因和发病机制接近于人类抑郁症,并已经被证实能导致小鼠多方面的抑郁表现。 但CUMS 小鼠难以长时间维持抑郁状态,不利于慢性抑郁症的研究[11]。 早期不良事件会增加成年后行为障碍的风险,包括神经精神疾病,例如抑郁症和精神病[17]。 在啮齿动物和灵长类动物模型中,新生儿时期的不利环境容易导致个体调节行为异常以及压力耐受性降低,这可能会导致成年后神经生物学、生理学和情绪行为发生持续改变[18-21]。然而,ELS 小鼠在表达抑郁样行为时稳定性不够,假阳性率高。 在此基础上,本课题组综合了CUMS 和ELS 造模方法,通过早期不良事件降低小鼠对压力的耐受性,并通过慢性应激事件激发小鼠的抑郁样行为,诱导小鼠表现出长期稳定的抑郁表现,提高模型的可靠性。
由上述实验结果可知,对比CUMS 以及ELS 小鼠,LTD 小鼠在造模结束后20 d 依然表现出稳定的抑郁状态,可以有效模拟临床慢性抑郁症患者。 同时,LTD 模型并不会使小鼠表现出明显的焦虑状态,可能与慢性温和刺激频数减少有关。 同时,我们观察到LTD 小鼠的海马神经元呈退行性病变,可能是LTD 小鼠能长久的表现出抑郁行为的原因之一。
有趣的是,我们观察到LTD 小鼠与ELS 小鼠会出现不同程度自残现象。 因为小鼠在开始慢性刺激前已经单笼饲养,所以可以排除是其它小鼠所为。 这种现象往往容易出现在脊髓损伤后的小鼠模型,疼痛可能是脊髓损伤后小鼠自残的原因[22]。我们认为,早期的母婴分离以及后期压力应对不足可能是导致小鼠自残的原因,但具体的机理还有待进一步研究。
综上,我们认为LTD 小鼠对比其他抑郁小鼠在长时间表达抑郁状态上有很大的优势,并可能是通过影响海马神经元退行性变化而导致小鼠的长期抑郁行为。

