苦参碱对小鼠S180肉瘤细胞凋亡及对FAS/FASL信号途径的影响
黄光弦,赵 蕊,卢 相,王淑美
重庆医科大学中医药学院,重庆 400016
当前癌症发病率、死亡率呈持续增长趋势,癌症问题迫在眉睫,但目前并无有效方法彻底根治。中药抗肿瘤效果明显,副作小且治疗后存活率高,因此逐渐成为研究热点。其中,中药苦参碱的抗肿瘤研究较多,其抗肿瘤作用明显,不良反应少,其制剂和复方已应用于临床试验。苦参为豆科植物苦参的干燥根,味苦,性寒,具有强心、抗炎、抗肿瘤、抗菌等多种药理活性[1,2]。苦参碱(matrine,MT)是从传统中医苦参中提取的生物碱,在体外对多种肿瘤细胞如胰腺癌[1]、肺癌[2]、结肠癌[3]、乳腺癌[4]和前列腺癌[5]具有杀伤作用。Fas/FasL是近年来研究得最为深入的有关细胞凋亡的膜表面分子信号通路,是细胞凋亡最关键的信号机制,能和死亡受体结合激活胞内凋亡信号分子,发出信号并传递至细胞内,调节基因转录,从而诱导细胞凋亡[6]。本研究探讨了苦参碱对小鼠S180肉瘤细胞凋亡及其对Fas/FasL信号通路的影响。
1 材料与方法
1.1 主要仪器与试剂
SPF级昆明小鼠(北京维通利华有限公司);苦参碱(中国药品生物制品检定所,批号110805-201709,20 mg/支,纯度>99%);TUNEL染色试剂盒(美国Sigma公司);FAS、FASL、Caspase-8和β-actin抗体(美国Abcam公司);Caspase-8检测试剂盒和二喹啉甲酸(BCA)蛋白测定试剂盒(碧云天生物技术研究所);SDS-聚丙烯酰胺、PBST溶液、垂直电泳仪及GIS-2020D凝胶图像分析系统(Sigma公司)。
1.2 S180肉瘤小鼠肉瘤模型的建立
从液氮罐中取出S180细胞株,37 ℃水浴中使之迅速解冻移到离心管内,加入10 mL RPMI1640培养液,振摇混匀,2000 rpm离心2次(5 min/次),除去冻存液,用10 mL RPMI1640培养液稀释10倍,振摇成混悬液,在超净工作台上进行小鼠腹腔注射1 mL传代。取传代第8天的S180腹水小鼠,脱颈椎处死,无菌抽取腹水,以生理盐水调至瘤细胞浓度为3.2×107个/mL混悬液。接种取昆明种小鼠33只雌雄各半,用1 mL的一次性注射器吸取S180肿瘤细胞悬液0.2 mL,右前肢腋窝部皮下注射。接种24 h后,剔除死亡小鼠1只及状态不佳小鼠2只,将剩余30只小鼠分为5组,每组6只,对照组、苦参碱10 mg/kg、苦参碱25 mg/kg、苦参碱50 mg/kg和顺铂组(DDP 5 mg/kg),对照组采用生理盐水灌胃,苦参碱组采用不同浓度苦参碱灌胃,顺铂组采用顺铂5 mg/kg腹腔注射3天,正常饲养,每3天用游标卡尺测量肿瘤的长径(L)和短径(W),计算肿瘤体积:TV=(L×W2)/2,绘制成肿瘤增长曲线。饲养12天后取出瘤体,统一处死各组小鼠,剥离肉瘤,并测定的瘤体重量。计算抑瘤率=[(对照组平均瘤重-实验组平均瘤重)/空白对照组平均瘤重]×100%。
1.3 肉瘤组织TUNEL法检测凋亡
每组随机选取部分肿瘤组织标本,经包埋剂OCT混合物包埋后冰冻,用冷冻切片机制作4 μm 冰冻切片,严格按照TUNEL检测试剂盒说明书要求步骤进行操作。光学显微镜下观察3组切片内细胞凋亡情况,以细胞内有棕黄色物质或整个细胞呈棕黄色判定为凋亡细胞,每张切片计数5个随机视野(×400),每个视野计数400个细胞,计算肿瘤凋亡率,肿瘤凋亡率(apoptosis rate)=(凋亡细胞总数/肿瘤细胞总数)×100%。
1.4 肉瘤组织Caspase-8活性测定
每组随机取部分肿瘤组织标本,用PBS洗涤3次,加入组织裂解缓冲液,冰浴条件下剪碎组织,用匀浆器匀浆至充分裂解,在4 ℃条件下10 000 rpm离心10 min,吸取上清液,-20 ℃保存。采用二喹啉甲酸(BCA)比色法进行蛋白定量。按Caspase-8活性活性检测试剂盒说明加入缓冲液及底物,加入100 μg总蛋白。37 ℃孵育60 min,405 nm检测吸光度。做标准曲线同时测定并计算caspase-8活性。
1.5 免疫组化检测FAS/FASL蛋白表达
每组随机取部分肿瘤组织标本,石蜡包埋切片,脱蜡,梯度乙醇脱水,过氧化氢浸泡15 min,TritonX-100通透15 min,羊血清37 ℃湿盒封闭25 min,滴加一抗4 ℃孵育过夜。次日二抗室温孵育2 h,滴加辣根酶标记的链霉卵白素工作液室温2 h,DAB显色,封片,显微镜下观察。
1.6 Western blot方法检测小鼠肉瘤的FAS/FASL蛋白及Caspase-8的表达影响
每组随机取部分肿瘤组织标本,组织匀浆后,进行BCA蛋白定量检测,取等量蛋白样品进行12%SDS-PAGE凝胶电泳,转至PVDF膜,5%脱脂奶粉4 ℃封闭过夜,一抗稀释于0.5%BSA液中,与印迹膜室温孵育2 h,取出用TBST洗膜10 min×3 次,然后用0.5%BSA液稀释的二抗与印迹膜于室温孵育2 h后,TBST液洗膜15 min×3次,ECL试剂发光,凝胶成像仪观察成像,进行统计学分析。
1.7 统计分析
实验数据用Mean±SD表示,采用SPSS17.0软件进行检验,正态分布资料统计描述采用均数±标准差,服从正态分布采用方差分析进行多组间比较,继而采用t检验进行组内比较,采用双侧检验,P<0.05为差异有统计学差异,P<0.01为差异有高度统计学意义。
2 结果
2.1 苦参碱对小鼠肉瘤成瘤实验的影响
小鼠肉瘤模型建立成功,实验结束时,对照组、苦参碱10、25、50 mg/kg与顺铂5 mg/kg五组肉瘤的平均肿瘤重量为4.6±1.7、3.1±1.2、1.9±0.8、1.5±0.6和2.8±1.6 g。苦参碱三组的肿瘤重量和抑瘤率与对照组相比,差异具有显著统计学差异(P<0.01)。随着苦参碱浓度增加,抑瘤率也不断增加,具有明显浓度依赖性。苦参碱25和50 mg/kg组的肿瘤重量和抑瘤率明显低于顺铂组,差异具有显著统计学意义(P<0.01)(见图1)。

图1 苦参碱对S180肉瘤小鼠肿瘤生长情况及抑瘤率的影响
2.2 TUNEL染色观察苦参碱对肉瘤凋亡情况的影响
TUNEL染色中棕褐色即为凋亡阳性细胞。对照组凋亡细胞数量少见,凋亡率2.7%±0.8%;苦参碱10、25、50 mg/kg组凋亡细胞显著增加,分别为32.8%±4.9%、39.6%±7.2%和46.7%±9.4%,与正常对照相比具有显著统计学差异(P<0.01),且与苦参碱浓度呈现正相关趋势。顺铂组凋亡率为37.8%±8.4%,苦参碱25和50 mg/kg组凋亡率高于顺铂组,具有显著统计学差异(P<0.01)(见图2)。
2.3 Caspase-8活性测定
与对照组相比,苦参碱10、25和50 mg/kg的Caspase-8活性逐渐增加,差异均具有显著统计学意义(P<0.01),且Caspase-8活性随着苦参碱浓度增加而增加,具有明显浓度依赖性。苦参碱25和50 mg/kg组Caspase-8活性高于顺铂组,具有显著统计学差异(P<0.01)(见图3)。

图2 苦参碱对肉瘤小鼠瘤体细胞凋亡情况的影响

图3 苦参碱对肉瘤小鼠瘤体Caspase-8活性的影响
2.4 免疫组化观察苦参碱对肉瘤小鼠瘤体FAS/FASL表达的影响
免疫组化观察肉瘤组织中FAS染色及FASL染色呈现棕黄色,对照组FAS染色及FASL染色较为淡染,而低、中、高浓度苦参碱组FAS染色及FASL染色与对照组相比明显增强,差异具有统计学意义(P<0.05),其中以高浓度苦参碱组增加最为显著,具备浓度依赖性(见图4及图5)。
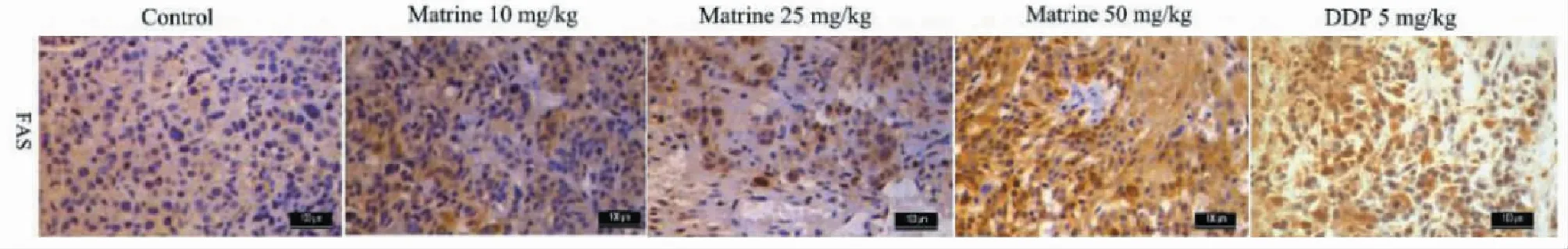
图4 免疫组化观察苦参碱对肉瘤小鼠瘤体FAS表达的影响

图5 免疫组化观察苦参碱对肉瘤小鼠瘤体FASL表达的影响
2.5 苦参碱对肉瘤小鼠瘤体FAS/FASL及Caspase-8蛋白表达的影响
Western blot结果显示,低、中、高浓度苦参碱FAS、FASL及Caspase-8表达较对照组明显增加,差异具有显著统计学意义(P<0.05),且FAS、FASL及Caspase-8表达与苦参碱浓度呈现正相关趋势(见图6)。

图6 Western Blot观察苦参碱对肉瘤小鼠瘤体FAS/FASL及Caspase-8表达的影响
3 讨论
苦参为豆科植物苦参的干燥根,味苦,性寒,始见于《神农本草经》,主心腹气结,癥瘕积聚,黄疸,溺有余沥等,其中癥瘕积聚描述的是腹部肿块,苦参具备明目、养肝胆、清热解毒、杀虫、祛风湿、泻血解热痢的功效,临床上苦参注射液多用于肝炎及肠道疾病的治疗[7,8]。
苦参碱是从传统中医苦参中提取的生物碱,是苦参的主要有效成分。多项研究发现苦参碱具有抗肿瘤的效果:Li等[9]发现苦参碱能够通过下调ERK-NF-kappa B进而抑制骨肉瘤细胞的增殖和侵袭转移。苦参碱通过降低细胞周期蛋白mRNA的表达,在G0/G1期阻断细胞周期,显著抑制横纹肌肉瘤细胞的增殖[10]。Zou等[11]发现苦参碱抑制人骨肉瘤MG-63细胞增殖和诱导凋亡,苦参碱具有提高肉瘤小鼠生存质量、抑制肉瘤小鼠肿瘤细胞生长等作用,其作用机制亦涉及多个方面,主要表现在促进肿瘤细胞凋亡,降低瘤细胞的增殖,提高机体抗肿瘤能力,以及降低瘤组织的侵袭转移能力等[12]。有研究认为[13],苦参碱对肺癌肿瘤血管形成有明显的抑制作用。苦参碱亦能协同增强肺癌化疗的效果,降低化疗的骨髓抑制,减轻化疗的毒副反应[7,8]。本研究发现苦参碱和顺铂能显著抑制肉瘤小鼠肿瘤生长,并且增加肉瘤小鼠肿瘤组织的凋亡率,且苦参碱25 mg/kg和50 mg/kg抑制肿瘤生长和促肿瘤凋亡的效果甚至优于顺铂5 mg/kg,说明苦参碱能够促进肉瘤细胞凋亡,与其他研究结果较为一致[12]。
死亡受体介导信号通路是新近发现的一种细胞凋亡途径,死亡受体FAS属肿瘤坏死因子受体超家族,死亡受体FAS与配体 FASL结合形成Fas结合蛋白(FADD),结合死亡效应结构域及Caspase-8前体,形成Fas-FADD-Caspase-8前体组成的死亡诱导复合物(DISC),激活Caspase-8,活化后的Caspase-8可以进一步激活执行死亡功能的效应蛋白Caspase3、6、7等,触发一系列级联反应,最终导致细胞死亡[14,15]。研究显示[16],苦参碱在体内外均能通过上调Fas/FasL,激活Caspase-3、8和9诱导骨肉瘤细胞凋亡。苦参碱能够以剂量依赖的方式诱导胰腺癌凋亡,这一作用与降低Bcl-2/Bax的比例,上调Fas,促进Caspase-3、8和9的活化有关[17]。苦参碱通过上调Fas/FasL和活化Caspase-3亦能诱导胃癌细胞凋亡[15]。苦参碱能够促进乳腺癌MCF-7细胞凋亡,其作用机制可能是上调Fas蛋白的表达、抑制端粒酶活性和抑制肿瘤血管的形成有关[18]。苦参碱能够通过活化Caspase-3、8和9促进鼻咽癌细胞凋亡[19]。上述研究说明苦参碱能够调控部分肿瘤细胞FAS/FASL表达,活化Caspase-8,并且这些作用与促进肿瘤细胞凋亡高度相关[15-19];但目前少见苦参碱与肉瘤细胞FAS/FASL信号通路相关报道。本研究结果显示,苦参碱和阳性对照顺铂均能够上调肉瘤小鼠肿瘤组织中的FAS/FASL表达,增加Caspase-8活性和表达,且苦参碱的这些作用呈现浓度依赖性,说明苦参碱可能能够通过上调FAS/FASL信号途径,活化Caspase-8,进而抑制肉瘤组织生长及促进肉瘤细胞凋亡。
综上所述,苦参碱能够促进肉瘤小鼠肿瘤组织的凋亡,并且该作用与上调FAS/FASL表达及活化Caspase-8有关。

