长链非编码RNA在正常皮肤、瘢痕、瘢痕癌组织中的表达差异
任利成,崔 旭
(1.深圳大学总医院,广东 深圳 518055;2.中南大学湘雅医院,湖南 长沙 410008)
瘢痕是人体皮肤组织受到一定程度损伤后自然愈合所形成的产物,瘢痕癌是皮肤瘢痕发生癌变而形成的皮肤癌,瘢痕癌确切的发病机制目前尚未清楚.lncRNA是一类长度超过200个核苷酸的非编码RNA,同编码RNA一样,lncRNA同样也参与基因调控网络组成,影响包括癌症发生发展、细胞分化、机体生长发育以及创面愈合等多种生物过程[1],其在皮肤瘢痕化及后续瘢痕癌变中的作用值得进一步研究.基因芯片杂交测序检测RNA的原理是将一组已知序列的核酸探针固定在一块基片表面,将样本中RNA使用引物方法放大并转录成带荧光的cRNA,当溶液中带有荧光标记的cRNA与芯片上的探针杂交互补匹配时,根据芯片探针位置和荧光强度分析得出样本的核酸序列.本研究利用高通量基因芯片技术,比较瘢痕癌患者正常皮肤组织、未癌变瘢痕组织及癌变瘢痕组织中差异表达的LncRNA、mRNA,并进一步分析这些差异表达的lncRNA、mRNA,以探讨瘢痕及瘢痕癌变发病的可能分子机制.
1 材料和方法
1.1 标本的采集和保存
实验标本取自中南大学湘雅医院烧伤重建外科且经病理确诊的瘢痕癌患者,所取标本包括患者正常皮肤组织、未癌变瘢痕组织及癌变瘢痕组织.所有研究病例均通过中南大学湘雅医院医学伦理委员会批准,并于术前签署知情同意书.
1.2 RNA的提取、标记、杂交
将组织样品置入装有液氮的无菌研钵中,并在液氮条件下研磨成粉末状,随后装入离心管,加入TRIZOL试剂,提取总RNA.应用NanoDrop ND-1000的紫外分光光度计评估所提取的RNA量及质量,标准的变性凝胶电泳检测RNA的完整性,采用Arraystar人类LncRNAV3.0芯片(Arraystar公司,美国)检测样本中LncRNAs的表达.根据Agilent One-Color Microarray-Based Gene Expression Analysis实验方案进行样品标记和基因芯片杂交:1)从总RNA中移除rRNA,得到mRNA;2)反转录合成双链cDNA,转录成带荧光的cRNA;3)根据RNeasymini Kit总RNA试剂盒检测纯化标记的cRNAs,应用NanoDrop ND-1000检测其浓度和活性;4)芯片杂交;5)洗涤、固定并扫描杂交芯片.
1.3 分析方法
通过Agilent Feature Extraction软件获得不同组别的芯片图,并获得原始数据,进一步使用GeneSpring GX V12.1软件对所获得的原始数据进行Quantile标准化及数据处理.样品间具有统计学意义的差异表达LncRNA或mRNA通过P-value进行FDR筛选,参选标准:组间基因表达差异倍数2倍以上(P<0.05,中国上海康成生物公司完成上述数据分析).对位于差异lncRNA附近(<100 kb),且差异表达的蛋白编码基因进行基因本体论(Gene Ontology,GO)分析和信号通路(Pathway)分析.
1.4 RT-PCR验证部分筛选的LncRNA
为进一步验证LncRNAs在不同组别标本中存在差异表达,我们选取实验中发现的部分差异表达的LncRNAs(ENST00000457834,ENST00000552486,ENST00000414600,ENST00000582505,ENST00000432 694,TCONS-00006917,TCONS-00023477,uc021uyg.1,TCONS-00020439),以实时定量PCR方法进一步检测他们在正常皮肤组织、瘢痕组织以及瘢痕癌组织中的表达情况.在50 mg组织样品中加入1 mL的TRIZOL试剂,然后提取总RNA.根据Super Script TM III Reverse Transcriptase试剂盒RNA酶抑制剂的使用说明,对抽提的样品RNA进一步行cDNA合成,再行PCR反应,并以管家基因β-actin作内参.
1.5 统计学分析
应用SPSS 16.0对数据进行处理与统计学分析,两组间比较采用独立样本t检验,以P<0.05为差异具有统计学意义.
2 结 果
2.1 样品RNA电泳分析
本实验中共提取9个样品的RNA,其中有8个样品的纯度和总量符合芯片实验要求.电泳图显示其中一瘢痕癌组样品降解相对严重,替换了新的样品,RNA纯度和总量均达到实验要求.总RNA质检参数(核酸纯度指示值)的OD260/OD280≥1.8,琼脂糖凝胶电泳检测有清晰的18S和28S rRNA条带,28S rRNA亮度约为18S rRNA的1~2倍.见图1.
2.2 LncRNAs与mRNA的差异表达
瘢痕癌组织与邻近未癌变瘢痕组织比较有477种LncRNA表达上升,1 576种表达下降(差异倍数fold≥2.0,P<0.05).瘢痕癌组织与正常皮肤组织比较有1 753种LncRNA表达上升,2 435种表达下降(差异倍数fold≥2.0,P<0.05).见表1~2,图2.其中有125种LncRNA在正常皮肤组织、瘢痕组织、瘢痕癌组织的表达呈递增式上升,324种LncRNA呈递减式下降(差异倍数fold≥2.0,P<0.05).瘢痕癌组织与邻近未癌变瘢痕组织比较,有2 353种mRNA表达上升,1 588种表达下降(差异倍数fold≥2.0,P<0.05).瘢痕癌组织与邻近正常皮肤组织比较,有5 321种mRNA表达上升,1 879种表达下降(差异倍数fold≥2.0,P<0.05).见图2.其中有220种mRNA在正常皮肤组织、瘢痕组织、瘢痕癌组织表达呈递增式上升,206种mRNA呈递减式下降(差异倍数fold≥2.0,P<0.05).

表1 瘢痕癌组织与瘢痕组织上调和下调前10位的lncRNA
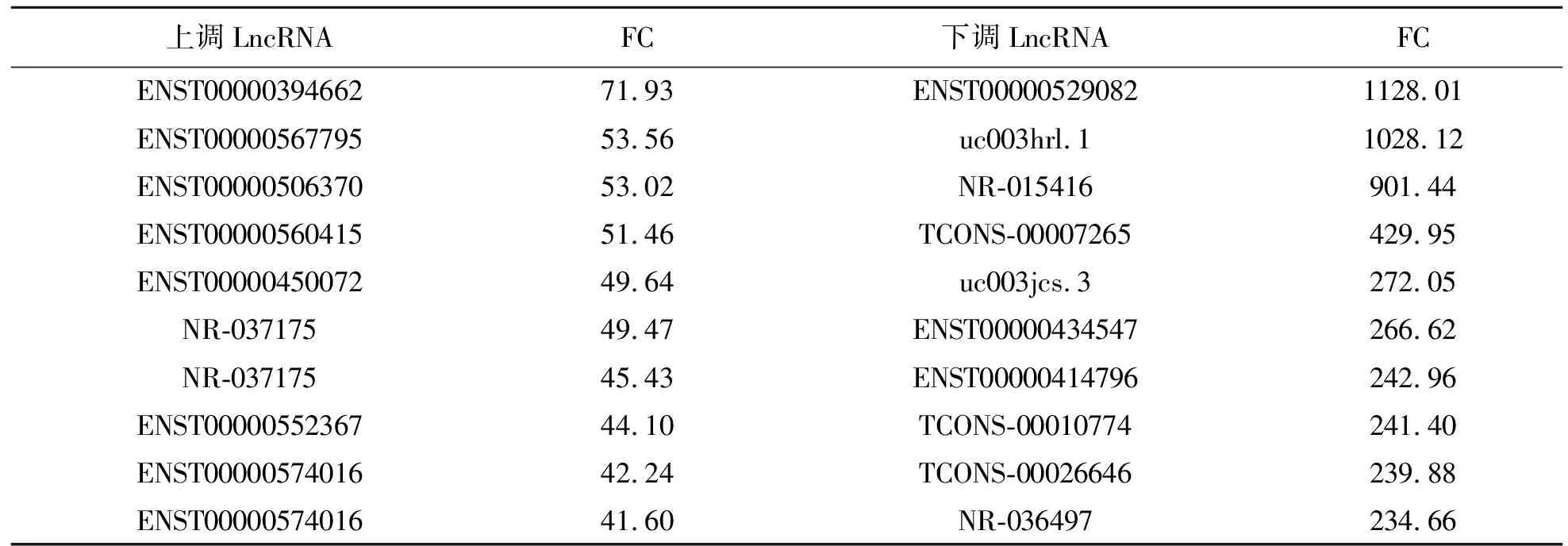
表2 瘢痕癌组织与正常皮肤组织上调和下调前 10 位的 lncRNA
2.3 基因本体论分析和信号通路分析
瘢痕癌组织与邻近未癌变瘢痕组织比较,差异表达的lncRNA功能预测较为富集的是免疫反应、趋化因子活性、细胞周期、蛋白结合.瘢痕癌组织与正常皮肤组织比较,差异表达的lncRNA功能预测较为富集的是生长调节、硫化物结合、蛋白质代谢、蛋白质结合.信号通路(Pathway)分析发现:瘢痕癌组织与邻近未癌变瘢痕组织比较,43条信号通路表达上升,其中富集积分最高的是肿瘤蛋白p53信号通路,44条信号通路表达下降,其中富集积分最高的是趋化因子信号通路.瘢痕癌组织与正常皮肤组织比较,89条信号通路表达上升,其中富集积分最高的是内质网蛋白加工过程,44条信号通路表达下降,其中富集积分最高的是黑素合成.
分析肿瘤相关基因发现:癌基因MDM2、Annexin A2 mRNA表达在正常皮肤组织、瘢痕组织、瘢痕癌组织中呈渐进性上升趋势,而Annexin A9 mRNA表达则呈渐进性下降趋势.Annexin A 差异表达与LncRNA TCONS-00001679N表达密切相关,分析胶原合成相关基因发现:TGF-βmRNA在正常皮肤组织、瘢痕组织、瘢痕癌组织呈递增式上升,LncRNA NR-046268的表达下降与TGF-β表达上升密切相关.
2.4 RT-PCR验证芯片结果
从正常皮肤组织、瘢痕组织及瘢痕癌组织中选择差异表达基因,以管家基因β-actin作为内参进行RT-PCR反应,得到结果与预期一致,RT-PCR验证分析得到的结果与基因芯片筛选的差异基因表达一致.部分LncRNAs正常皮肤组织、瘢痕组织以及瘢痕癌组织中的表达呈递增性或递减性改变.见图3.
3 讨 论
瘢痕癌是发生于皮肤瘢痕组织的恶性肿瘤,尤其是一些深Ⅱ度、Ⅲ度烧伤或创伤后久治不愈、反复溃烂的瘢痕组织其癌变率为1%~2%[2-3].瘢痕癌发病机制并不十分清楚,主要观点认为其多发生于反复破溃合并感染的创面,与长期慢性炎症刺激有关;也有观点认为与瘢痕组织局部血液循环差、免疫缺陷、机体对肿瘤细胞监控减弱有关.许多蛋白编码基因在瘢痕癌发生中都出现了异常表达[2-4],lncRNA是一类长度超过200个核苷酸的非编码RNA分子,参与了多种生理功能及疾病的调控.尽管目前对lncRNA的功能了解很少,但根据已有的研究发现其对机体稳态的维持非常重要,它参与了X染色体沉默、染色体修饰、转录激活、干扰等重要调控过程[4-6].越来越多的研究[4-6]发现:lncRNA与人类多种肿瘤的发生密切相关,在皮肤疾病的发生发展中同样具有重要的调控作用.但目前关于lncRNA与瘢痕癌相关关系的研究不多.
本研究结果显示:正常皮肤组织、瘢痕组织、瘢痕癌组织之间部分lncRNA表达存在显著差异(差异倍数fold≥ 2.0倍,P<0.05),一些lncRNA在正常皮肤组织、瘢痕组织、瘢痕癌组织之间表达存在递增式或递减式变化(差异倍数fold≥ 2.0倍,P<0.05),说明lncRNA与烧伤后皮肤瘢痕增生、瘢痕癌变密切相关.
转录调节因子p53是一种抑癌基因,可诱导细胞凋亡、分化以及DNA修复[7].而癌基因MDM2编码的蛋白质通过与p53的17~22位氨基酸残基相结合,阻断p53的转录调控通路,或者与p53特异的泛素酶共同作用,促进p53蛋白降解,使野生型p53基因的抑癌功能失活.Annexin A蛋白同样在p53介导的细胞凋亡通路中具有重要作用[8-9].本研究发现:瘢痕癌组织中癌基因MDM2、Annexin A2 mRNA的表达较瘢痕组织、正常皮肤组织显著增高(差异倍数fold≥ 2.0,P<0.05),而且在正常皮肤组织、瘢痕组织、瘢痕癌组织中表达存在渐进性上升趋势.Annexin A家族中另一个重要成员Annexin A9 mRNA表达则在正常皮肤组织、瘢痕组织、瘢痕癌组织中存在渐进性下降趋势.Annexin A 差异表达与LncRNA TCONS-00001679N表达密切相关,说明LncRNA TCONS-00001679N极可能参与p53 signaling pathway所导致的组织癌变.TGF-β是已知的与胶原代谢、瘢痕形成最为密切的影响因子之一,它促进了细胞增殖、细胞外基质形成,同时也抑制蛋白酶和基质酶的活性.在瘢痕尤其是病理性瘢痕的发生发展中具有重要作用[10].TGF-β也参与肿瘤发生发展,对正常细胞而言,TGF-β 具有抑制肿瘤的作用,而在恶性肿瘤细胞中,TGF-β则具有促进肿瘤生长的作用[10].本研究结果显示:TGF-βmRNA在正常皮肤组织、瘢痕组织、瘢痕癌组织表达存在显著性差异,呈递增式上升(差异倍数fold≥2.0,P<0.05).LncRNA NR-046268表达下降与TGF-βmRNA表达上升密切相关,说明极可能参与了TGF-β在损伤后瘢痕增生及随后的瘢痕癌变.
正常皮肤组织、瘢痕组织、瘢痕癌组织中lncRNA存在差异表达,LncRNA的差异表达与临近蛋白编码基因(肿瘤相关编码基因)表达密切相关.进一步研究LncRNA的差异表达与临近蛋白编码基因的关系,将有助于我们进一步了解皮肤瘢痕增生及瘢痕癌变的发生机制.

