脑小血管病总负荷评分与静脉溶栓治疗急性缺血性卒中患者1年预后相关性研究
杨苗娟,曾思琳,徐铅辉,方俊林,王颖,郭毅
脑小血管病(cerebral small vessel disease,CSVD)是一组由不同病因累及脑内微、小动脉,毛细血管及微小静脉,引发血管内皮细胞损伤、血脑屏障破坏、脑组织缺血等一系列病理生理改变,导致相应的临床和影像综合征。其主要特点为脑深部灰质和白质的结构损害,临床上主要表现为反复卒中发作、认知功能下降、步态不稳等。MRI被认为是诊断CSVD金标准,CSVD在MRI成像上表现多样,主要包括:脑白质病变(white matter hyperintensities,WMH)、扩大的血管周围间隙(enlarged perivascular spaces,ePVS)、腔隙性脑梗死(lacunar infarcts,LI)、脑微出血(cerebral microbleeds,CMBs)和脑萎缩[1]。大部分CSVD与急性缺血性卒中(acute ischemic stroke,AIS)具有相同的危险因素,如年龄、高血压等[2],目前临床研究主要集中在单一CSVD对AIS预后的影响方面。鉴于CSVD是具有不同成像表型的综合结果,研究其单一成像特点而忽略其他影像表现类型,不能全面地评估CSVD影像。为全面评估各种类型CSVD累积效应,研究者提出了CSVD总负荷评分的概念[3],部分研究已探讨了其与AIS临床预后的相关性[4-6]。rt-PA静脉溶栓治疗发病3~4.5 h的AIS疗效明确[7],有益于AIS患者长期预后[8-9]。合并CSVD对AIS患者静脉溶栓治疗临床预后影响值得研究探讨,但目前的研究主要集中在CSVD对其90 d内短期预后影响,缺乏长期影响研究。本文利用CSVD总负荷评分进一步探讨CSVD对AIS患者rt-PA静脉溶栓1年预后的影响,为临床、预防工作提供参考。
1 研究对象与方法
1.1 研究对象 本研究为前瞻性研究,连续纳入2017年1月-2018年12月于深圳市人民医院神经内科住院并接受rt-PA静脉溶栓治疗的AIS患者。纳入标准:①年龄18~80岁,符合AIS静脉溶栓适应证并完成静脉溶栓患者;②溶栓后24 h内复查头颅CT评估有无出血转化,发病1周内完善MRI检查(包括但不限于T1WI、T2WI、DWI、FLAIR,SWI序列)。排除标准:①静脉溶栓禁忌证;②溶栓后进行动脉内治疗桥接患者;③发病前mRS评分≥2分;④合并恶性肿瘤影响生命周期。
溶栓治疗方案按照《中国急性缺血性脑卒中诊治指南2014》[7]执行,rt-PA为德国勃林格英格翰公司生产干粉制剂,规格为每支50 mg。本研究所有患者签署知情同意书,并且通过深圳市人民医院伦理委员会认证。
1.2 临床资料收集 收集患者的基线资料,包括性别、年龄、发病至溶栓治疗时间(onset to needle time,ONT)、入院至静脉溶栓时间(door to needle time,DNT)、基线NIHSS评分、既往病史(包括卒中、高血压病、糖尿病、高脂血症、心房颤动、卵圆孔未闭或心脏瓣膜病,吸烟史等)、相关实验室数据(空腹血糖、糖化血红蛋白、血脂等)、住院天数、出院NIHSS评分等。将吸烟≥1支/天,且吸烟时间≥1年者定义为有吸烟史。
1.3 脑小血管病负荷评分及分组 由1位神经影像科专家对影像资料进行盲评,按照2013年欧洲头颅影像学上脑损伤的间接征象血管变化的神经影像学报告标准(STandards for ReportIng Vascular changes on nEuroimaging,STRIVE)[10]及Staals等[3]的CSVD总负荷评分量表进行评分:①WMH为脑白质异常信号,T1WI低信号或等信号,T2WI、FLAIR上高信号,大小不等;根据Fazeka直观评分量表,定义WMH≥2级记为1分;②LI为存在直径为3~15 mm,无症状的皮质下圆形、类圆形病灶且DWI呈低信号,FLAIR上有高信号环绕,存在则记为1分;③ePVS为直径<3 mm,呈圆形或线条状包绕血管、沿着血管走行的充满液体信号的间隙,MRI各序列呈脑脊液等信号,当ePVS个数≥11个记为1分;④CMBs定义为在SWI上出现在幕下、深部或脑叶,呈圆形或类圆形、直径2~5 mm的低信号区域,周围无水肿,记为1分。CSVD总负荷评分为0~4分,按照评分分为5组。
1.4 预后评定指标 采用mRS量表作为评定AIS患者静脉溶栓后1年不良预后的工具。通过电话随访,定义mRS评分3~6分为预后不良。
1.5 统计学方法 使用SPSS 20.0统计分析软件进行数据分析。正态分布计量资料采用表示,两组采用t检验,多组采用方差分析(ANOVA)、SNK检验进行整体组间比较;非正态分布计量资料用中位数(四分位数间距)表示,两组采用Mann-Whitney检验,多组采用Kruskal-Wallis检验进行组间整体组间比较;计数资料采用频数(%)表示,采用χ2检验或Fisher精确概率法进行组间比较。将单因素分析中P<0.05的变量作为自变量纳入多因素Logistic回归模型,分析1年预后的独立影响因素。利用ROC曲线分析独立影响因素对AIS静脉溶栓后1年不良预后的预测价值,P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 最终共纳入135例静脉溶栓的AIS患者,平均年龄为61.56±12.64岁,男性94例(69.6%),溶栓前NIHSS评分为5(3~10)分,ONT为149.24±40.38 min,平均住院天数为9(7~12)d。其中CVSD总负荷评分0分者17例(12.59%),1分者44例(32.59%),2分者38例(28.15%),3分者30例(22.22%),4分者6例(4.44%)。CSVD各亚型中WMH为37例(27.4%)、LI为107例(79.3%)、ePVS为46例(34.1%)、CMBs为39例(28.9%)(表1)。
2.2 不同脑小血管病总负荷评分组基线资料根据CSVD总负荷评分(0~4分)将所有入组患者分为5组,结果发现患者年龄、高血压病史、吸烟史各组间差异具有统计学意义,其他基线资料组间差异无统计学意义(表1)。
2.3 1年后功能预后的影响因素 完成1年随访132例,失访3例,其中mRS评分0分者44例(33.3%)、1分者24例(18.2%),2分者23例(17.4%)、3分者12例(9.1%)、4分者8例(6.1%)、5分者8例(6.1%),死亡(mRS评分6分)13例(9.8%)。预后不良组(mRS评分3~6分)41例,预后良好组(mRS评分0~2分)91例,两组间CSVD总负荷评分分布差异具有统计学意义(P=0.001)(图1)。
2.3.1 功能预后不良的单因素分析 单因素分析结果显示,预后不良组患者年龄更大,吸烟比例更高,空腹血糖水平更高,溶栓前NIHSS评分、CSVD总负荷评分更高,WMH、ePVS、CMBs患者比例更高,差异均有统计学意义(表2)。
2.3.2 功能预后不良的多因素分析 将单因素分析中P<0.05的变量(年龄、吸烟、空腹血糖、溶栓前NIHSS评分、WMH、ePVS、CMBs、CSVD总负荷评分)作为自变量纳入多因素模型中,发现溶栓前NIHSS评分(OR1.615,95%CI1.209~2.157,P=0.001)、CSVD总负荷评分(OR1.570,95%CI1.095~4.094,P=0.026)为AIS静脉溶栓患者1年功能预后不良的独立危险因素。
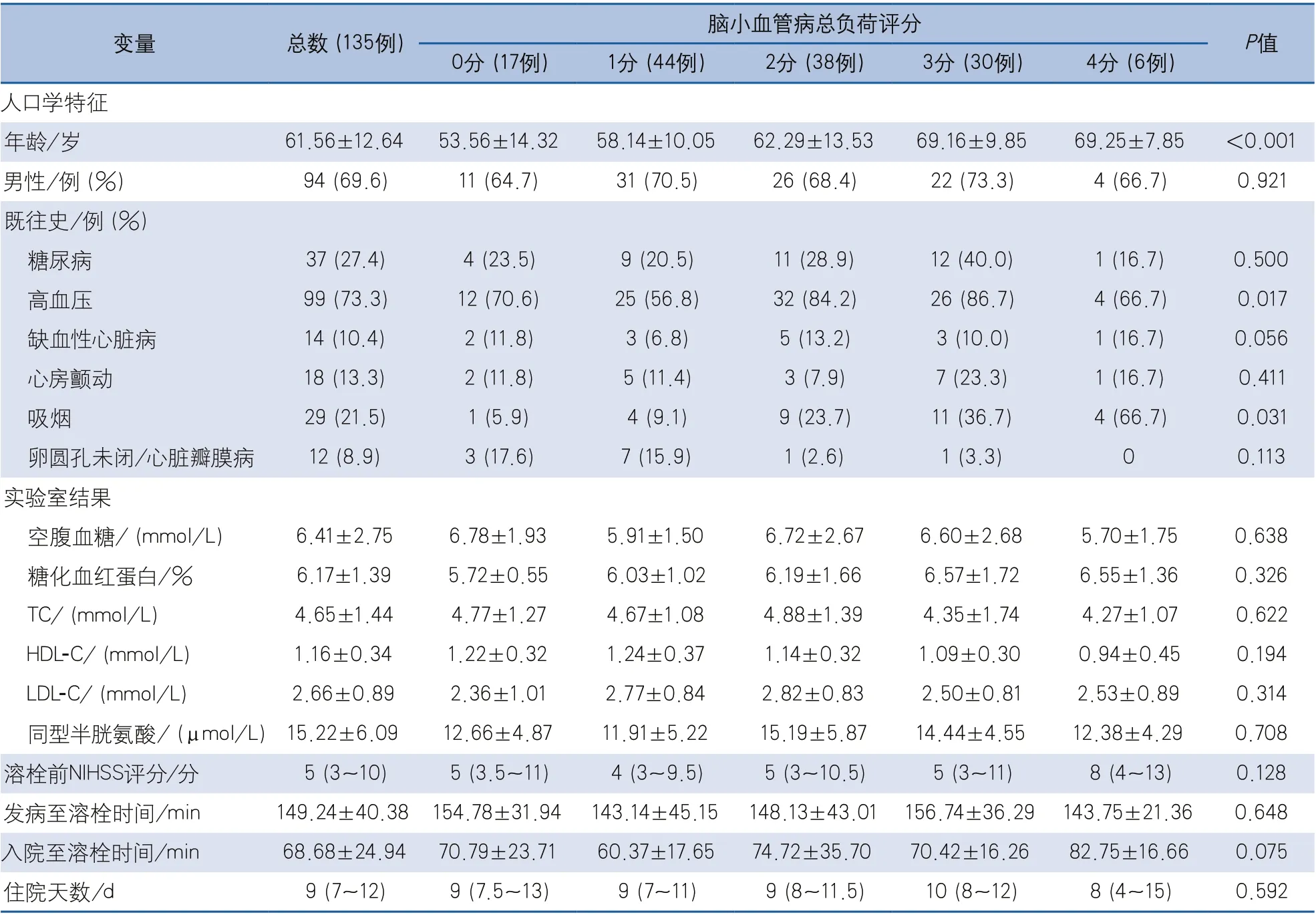
表1 脑小血管病总负荷评分临床资料

图1 预后良好与预后不良患者CSVD总负荷评分分布情况
2.3.3 ROC曲线分析独立影响因素对1年不良预后的预测价值 在ROC曲线分析中,CSVD总负荷评分2.5分[ROC曲线下面积(area under the ROC curve,AUC)0.735,95%CI0.641~0.828,P<0.001]是评估AIS静脉溶栓后1年预后最佳临界值。CSVD总负荷评分最佳临界值的敏感度为52%,特异度为83%。溶栓前NIHSS评分6.5分是评估预后的最佳临界值(AUC 0.773,95%CI0.684~0.862,P<0.001),其相应的敏感度为66%,特异度为72%(图2)。

表2 预后不良的单因素分析
3 讨论
CSVD是一种常见的与年龄相关的脑血管疾病,是导致老年群体功能丧失、残疾和认知能力下降的主要原因之一。CSVD病因以与年龄及血管危险因素相关的小动脉硬化最常见,占缺血性卒中病因的25%~50%[11]。无论是WMH还是CMBs,CSVD患病率均随着年龄增长逐年增加[12]。本研究结果也证实不同CSVD总负荷评分患者年龄存在差异。

图2 ROC曲线分析CSVD总负荷评分与溶栓前NIHSS评分对1年预后不良的预测价值
合并CSVD的AIS患者静脉溶栓治疗后发生出血转化及临床预后逐渐被研究者关注。目前研究主要集中在单一类型CSVD与静脉溶栓后缺血性卒中患者出血转化及临床预后相关性,结论并不统一。2016年Stroke杂志发表一项荟萃分析表明,脑白质疏松症不仅增加急性卒中患者静脉溶栓后出血转化风险,而且与患者3~6个月预后不良相关[13]。临床中急性卒中患者可能不同类型CSVD共存,因此为全面评估患者CSVD负荷情况,Staals等[3]根据影像学特点提出CSVD总负荷评分量表。2017年Song等[5]发现CSVD总负荷评分是预测AIS患者死亡率的标志物。
目前CSVD总负荷评分量表与AIS患者rt-PA静脉溶栓后临床预后关系的研究较少。刘雪云等[14]评估了CSVD总负荷评分与AIS静脉溶栓治疗后出血转化及90 d预后相关性,结果表明CVSD总负荷评分不仅是静脉溶栓出血转化的预测因素,也是90 d不良预后的独立危险因素(OR3.157,95%CI2.120~4.703)[15]。较多的临床试验结果已表明rt-PA静脉溶栓治疗有利于改善AIS患者长期预后[9,16-18],1年内预后良好(mRS评分0~1分)达41%[9],1年死亡率为24%、3年死亡率为34%,4年死亡率为47%,均较非rt-PA静脉溶栓治疗预后良好[18]。目前,CSVD与rt-PA静脉溶栓后AIS患者长期预后的关系研究很少,本研究对此类患者1年预后的随访发现,溶栓前NIHSS评分、CSVD总负荷评分是1年功能预后不良的独立危险因素,CSVD总负荷评分≥3分患者更可能出现rt-PA静脉溶栓治疗后1年功能预后不良,其敏感度为52%,特异度为83%。敏感度和特异度较低可能是由于本研究的样本少有关。
本研究还发现,入院时NIHSS评分≥7分患者更可能出现1年功能预后不良,与之前的研究相似[19]。CMBs、WMH、LI和ePVS与预后不良相关性有待进一步扩大样本量进行研究。因CSVD的各种亚型可并存于同一患者,CSVD总负荷评分能较好评估脑小血管损伤的全脑累积效应。CSVD总负荷评分预测功能预后优于单一CSVD的评价。
AIS后CSVD总负荷影响功能结局的机制尚不完全清楚。CSVD总负荷反映全脑小血管损伤的长期累积结果,反映脑内神经储备功能下降,可能是脑组织对缺血缺氧和其他损伤易感性增加的标志[2,20]。较重的CSVD总负荷合并AIS可能破坏脑白质的微观结构,破坏大脑的神经网络结构,从而损害大脑的可塑性和代偿机制,减缓卒中后神经功能的恢复[21-22]。当CSVD破坏大脑认知、运动网络时,可影响患者学习能力、神经功能恢复,最终影响神经功能长期预后[23]。越来越多的证据表明,较重的CSVD总负荷可独立导致患者进行性认知障碍、痴呆和步态/平衡障碍[24-25]。CSVD相关的认知及执行功能障碍不仅会损害患者的运动和学习功能,还会损害患者参与康复和遵守治疗的依从性,从而导致功能恢复不良。
综上所述,本研究结果表明CSVD总负荷评分与经rt-PA静脉溶栓AIS患者1年功能不良预后相关,相比单一CSVD,CSVD总负荷评分对AIS静脉溶栓后长期预后评估更具价值。本研究尚存不足:本研究为单中心小样本研究,部分患者因病情严重或其他因素未入组,可能存在选择偏倚。下一步将进一步扩大样本量,评估CSVD总负荷对AIS患者静脉溶栓后出血转化及其他缺血事件的影响。

