蛛网膜下腔出血相关性肺炎发生的危险因素分析及对住院结局的影响
邓永梅,李子孝,苗亚杰,赵性泉
作者单位
100070 北京首都医科大学附属北京天坛医院神经病学中心
最新全球疾病负担数据显示,我国卒中的发病率居于全球首位[1-4]。蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是出血性卒中最严重的一种类型,30 d死亡率为18%~40%[5-7]。Hilker[8]于2003年提出了卒中相关性肺炎的概念,国内外对卒中相关性肺炎的研究大多分析缺血性卒中和自发性脑出血患者的流行病学数据,对SAH患者的肺炎报道相对较少[9]。本研究旨在描述目前临床SAH相关性肺炎的危险因素以及肺炎对SAH患者住院结局的影响,为SAH疾病管理实践提供依据。
1 研究对象与方法
1.1 研究对象 回顾性纳入2015年5月-2018年11月首都医科大学附属北京天坛医院收治的SAH患者。纳入标准:①年龄≥18岁;②符合中华医学会第四届全国脑血管学术会议通过的SAH诊断标准,并经头颅MRI或CT证实。排除标准:①继发性蛛网膜下腔出血,如创伤、脑实质出血破入或脑室出血等;②入院时合并肺部感染、急性肺损伤等肺部并发症;③发病前有影响吞咽功能的疾病史,包括卒中、帕金森、多发性硬化症、运动神经元病和痴呆等。
1.2 数据收集 收集患者基线资料,包括性别、年龄、既往史(高血压、糖尿病、血脂异常、心房颤动、冠心病、心肌梗死、慢性阻塞性肺疾病、吸烟、饮酒)、吞咽障碍、入院时CT Fisher分级和Barthel指数等;住院结局指标,包括院内死亡、住院天数、住院总费用、自付金额、康复费用、西药费、抗菌药物费用等。
1.3 诊断标准及分组 患者入院后出现呼吸道感染的临床表现和实验室指标异常(如发热、咳嗽、听诊呼吸音粗或啰音、新的脓性痰或痰培养阳性),同时有典型的胸部X线或CT检查结果支持,临床诊断为SAH相关性肺炎。根据患者住院期间是否发生SAH相关性肺炎分为肺炎组和无肺炎组。
1.4 统计学方法 采用SAS 9.4软件进行统计分析,符合正态分布的计量资料以表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用Mann-WhitneyU检验。计数资料用百分比(%)表示,组间比较采用χ2检验或确切概率法。以发生肺炎为因变量,将单因素分析差异有统计学意义的变量再结合临床知识加入性别作为自变量,纳入多因素Logistic回归模型,使用后退法筛选变量,确定SAH患者发生肺炎的危险因素。将住院天数、住院费用等住院结局指标等连续型变量转化为二分类变量(与均值比较),采用多因素Logistic回归分析肺炎对住院结局的影响。双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线资料比较 共纳入457例SAH患者,年龄范围19~86岁,平均年龄54.3±11.2岁,男性219例(47.9%)。肺炎组76例(16.6%),非肺炎组381例(83.4%)。肺炎组年龄高于非肺炎组,高血压、糖尿病、冠心病等既往病史和吞咽障碍的发生率均高于非肺炎组,差异均有统计学意义;另外,两组的Barthel指数和CT Fisher分级差异也具有统计学意义(表1)。
2.2 SAH患者发生肺炎的危险因素分析 多因素Logistic回归分析显示,男性(OR2.31,95%CI1.17~4.58,P=0.016)、吞咽障碍(OR6.06,95%CI1.09~33.70,P=0.039)及Barthel指数0~20分(OR15.58,95%CI4.17~58.23,P<0.001)是SAH患者发生肺炎的独立危险因素(表2)。
2.3 SAH患者发生肺炎对住院结局的影响 多因素Logistic回归分析显示,SAH患者发生肺炎与院内死亡、住院天数、住院总费用、自付金额、康复费均无关;但肺炎组患者西药费用、抗菌药物费用高于非肺炎组(均P<0.001)(表3)。
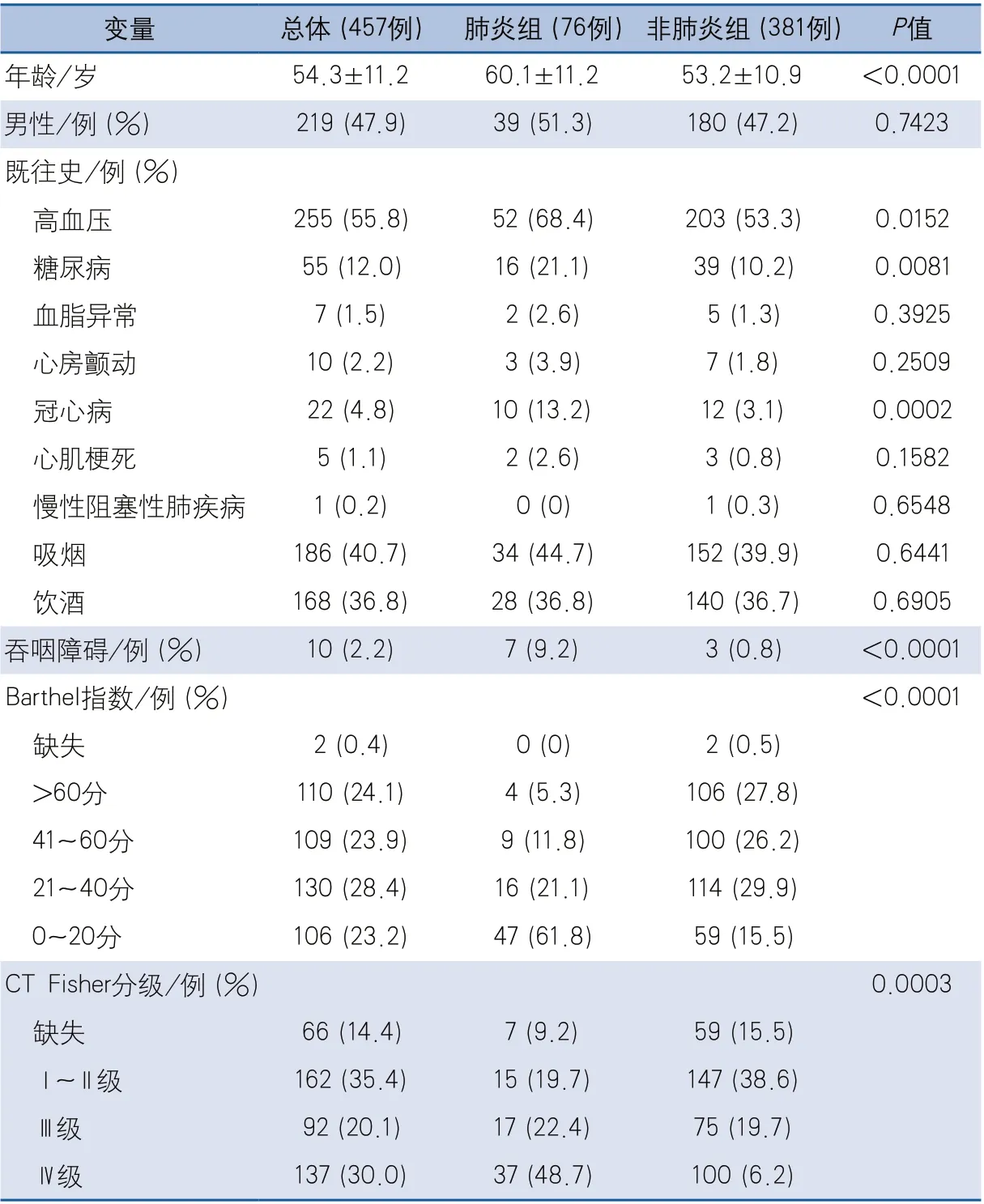
表1 蛛网膜下腔出血基线资料比较
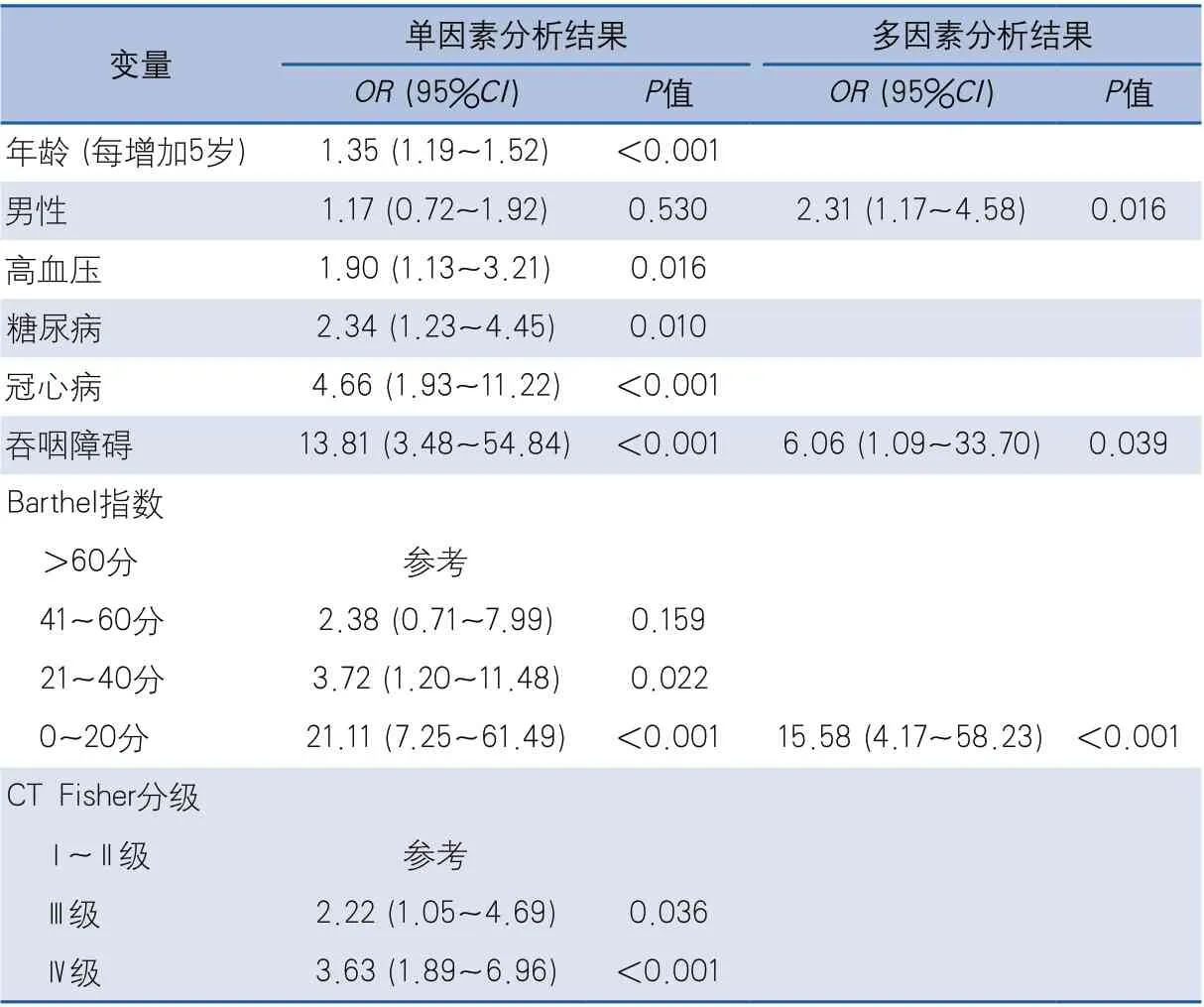
表2 蛛网膜下腔出血患者发生肺炎危险因素分析
3 讨论
肺炎是SAH患者常见和主要的并发症之一,本研究SAH患者肺炎发生率为16.6%,高于我国报道的缺血性卒中的肺炎发生率[10],略低于文献报道的出血性卒中患者16.9%的发生率[9]。临床认为误吸、吞咽困难、运动能力差等是导致患者发生肺炎的主要原因,卒中导致的细胞免疫功能低下是肺炎发生的重要内在机制[11]。
SAH因水肿和出血刺激下丘脑,更易引起T淋巴细胞功能异常和免疫功能下降,使肺炎发生率增加。对于SAH患者,进行CT Fisher分级,可根据出血范围预测脑血管痉挛发生可能性,级别越高代表出血范围越广泛或血肿越明显,预示脑血管痉挛发生可能性越高[12]。高分级SAH患者可出现全身炎症反应综合征导致免疫抑制,从而引起肺炎[13-14]。本研究显示,CT Fisher分级Ⅲ级和Ⅳ级的SAH患者比Ⅰ、Ⅱ级患者发生肺炎的风险高,与以往研究一致[15]。此外,雌激素可减轻SAH后脑皮质的神经炎性反应[16],也可通过影响炎症反应标记物激活降低早期炎症反应因子的转录水平[17],因此女性SAH患者的肺炎发生率低于男性,与本研究结果一致。既往研究也证实,动脉瘤性蛛网膜下腔出血(aneurymal subarachnoid hemorrhage,aSAH)手术治疗的男性患者肺炎发生率显著高于女性[18]。
吞咽功能障碍也会影响SAH患者肺炎的发生,目前对于吞咽障碍尚无特效药物和治愈方法,做好吞咽障碍的早期识别、饮食管理和康复管理是预防吸入性肺炎,维护患者健康,促进康复的主要途径[19-22]。因此,需构建科学、规范的SAH患者吞咽功能评价流程以及临床管理方案,为给予针对性诊疗、护理、康复、营养管理提供决策依据,促进卒中护理、医疗质量提升,改善SAH患者临床结局。
除此之外,既往研究发现高血压、糖尿病、慢性阻塞性肺疾病是aSAH相关性肺炎的影响因素[17],本研究多因素结果并未显示高血压、糖尿病、冠心病等既往史与SAH相关性肺炎发生独立相关,仍需进一步的研究证实其与肺炎的关系。Barthel指数在0~20分提示患者病情较重,生活完全不能自理,反流和误吸风险增加,SAH相关性肺炎的发生风险高。
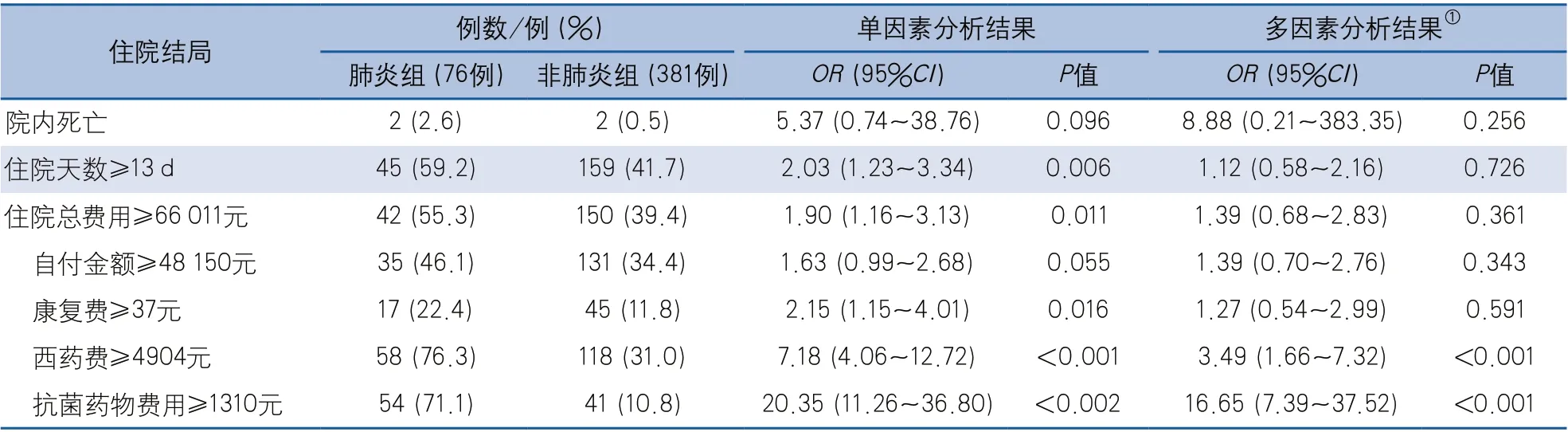
表3 蛛网膜下腔出血患者发生肺炎对住院结局的影响
本研究结果显示,肺炎组患者西药费和抗菌药物费用远高于非肺炎组,这与肺炎的治疗用药有关,但肺炎的发生并未增加患者的住院时长、住院总费用,这可能与近年来SAH相关的疾病管理指南的制定与发布,SAH诊疗水平不断提升有关;也可能与aSAH治疗手段有关,aSAH外科手术治疗患者肺炎发生率高于介入治疗患者,而外科手术治疗患者的住院时长高于介入治疗,但本研究设计并未将SAH治疗手段纳入及分析,有待进一步研究针对SAH治疗手段进行亚组分析,证实SAH治疗手段与肺炎发生及住院结局的关系。
本研究的局限性在于:未对SAH治疗手段纳入分析,尚不能了解介入治疗、外科夹闭治疗、保守治疗对于SAH相关性肺炎的影响[24-25];仅以CT Fisher分级作为疾病严重程度判断标准,单因素显示分级不同肺炎发生情况有统计学差异,但多因素结果并未证实该因素与肺炎发生独立相关,尚不能较好地解释疾病严重程度与肺炎发生的关系;仅分析肺炎对院内死亡发生的影响,未考虑肺炎对患者出院时残障情况的影响。探讨发生肺炎的SAH患者临床特点及相关因素,对SAH患者肺炎的预防和诊治有一定临床意义。目前,我国已有学者基于中国卒中人群数据库,建立急性缺血性卒中相关性肺炎和自发性脑出血相关性肺炎的风险预测模型,并得到相关验证[9,23],但SAH相关性肺炎的风险预测模型尚未建立。希望未来能有多中心、大样本量、纳入更多流行病学资料的SAH相关性肺炎研究,构建基于我国人群特征的SAH相关性肺炎风险预测模型。

