鸟苷酸结合蛋白4在多种肿瘤中的作用及分子机制研究进展
张枝倩 王娟 王伟
由于全球人口的增长和老龄化,以及社会发展伴随而来的既定危险因素如环境污染、肥胖、感染等,恶性肿瘤逐渐成为危害人类生命健康的一大顽疾,并对社会产生了巨大的负担[1]。近年来,分子靶向治疗基于其特异性优势逐渐成为抗肿瘤领域的研究热点。鸟苷酸结合蛋白(GTP-binding proteins,GTPBP)4作为 GTPBP 家族成员之一,近年来因与某些特定肿瘤的发生、预后等密切相关而受到广泛关注。本文将对GTPBP4基因的分子特征,及其蛋白产物在多种肿瘤发生、发展过程中的作用和分子机制作一综述。
1 GTPBP4简介
GTPBP又称G蛋白,具有GTP水解酶活性,为一种分子开关,由 α亚基(45kDa)、β 亚基(35kDa)和 γ亚基(7kDa)三个亚基组成[2-3]。其中,α亚基是决定G蛋白功能的主要亚基,具有GTP水解酶活性。G蛋白存在两种构象:当与二磷酸鸟苷(GDP)结合时,α和βγ二聚体结合形成异源三聚体,此时G蛋白呈失活状态;而当一个细胞外配体与G蛋白偶联受体(GPCRs)结合,受体就会改变构象,打开G蛋白三聚体,使α亚基与βγ二聚体解离,进而释放GDP,结合GTP,同时激活下游信号通路,见图1[4-6]。此外,α亚基上存在内源性GTP酶可分解GTP生成GDP,使活化的G蛋白再次失活,并与上述G蛋白的两种构象改变过程共同构成G蛋白循环[4]。G蛋白在通常意义上主要分为两大类:一类是异三聚体G蛋白,另一类则是小G蛋白[7-8]。GTPBP从其分子量、蛋白结构、生物学性状等角度比较分析发现不属于上述两大类,但该蛋白在GTP结合区域和序列与Obg、DRG蛋白相似,故又命名为一种新的G蛋白亚家族,即ODN家族[9]。
GTPBP4又被称为慢性肾功能衰竭基因(CRFG)、核仁G蛋白-1基因(NOG1)、神经纤维瘤病2型(neurofibromatosis type 2,NF2)相关 GTP 结合蛋白基因(NGB),是一种新的GTPase,属于鸟苷酸结合蛋白家族[9-11]。人类GTPBP4基因,主要位于细胞核内,定位于染色体10p15-14,与核糖体60S亚基的生物合成密切相关,并可影响肾病末期患者的病势走向[12-14]。研究显示,GTPBP4为一种分子开关,可调控蛋白质合成,细胞生长和增殖及信号转导通路等多种生物学过程[10,15]。GTPBP4表达的蛋白产物还可作为中心枢纽蛋白与多种远端重塑因子和核糖体RNA序列相结合,在核糖体结构重塑和核孔输出中起着关键作用[16]。
2 GTPBP4基因在多种肿瘤中的表达变化及分子机制
2.1 GTPBP4基因在肝细胞癌(hepatocellular carcinoma,HCC)中的表达及分子机制 肝癌是我国常见的恶性肿瘤之一,又以HCC为主。研究发现,GTPBP4基因在HCC肿瘤组织中的表达水平明显高于配对的癌旁组织[17]。通过RNA干扰(RNAi)等技术沉默肿瘤细胞如人肝癌HepG2细胞中GTPBP4基因的表达后发现,细胞的增殖能力明显下降、集落形成能力受损,细胞周期延长,并停滞于G2/M期[18]。研究显示,GTPBP4基因表达水平与HCC患者的病理分级有关[19]。此外,还发现GTPBP4基因的表达水平和患者预后密切相关,GTPBP4基因高表达的患者生存期较短[18]。所以GTPBP4可成为用于HCC患者病理分级、预后判断的一个指标,并可能成为HCC治疗的一个潜在靶点。
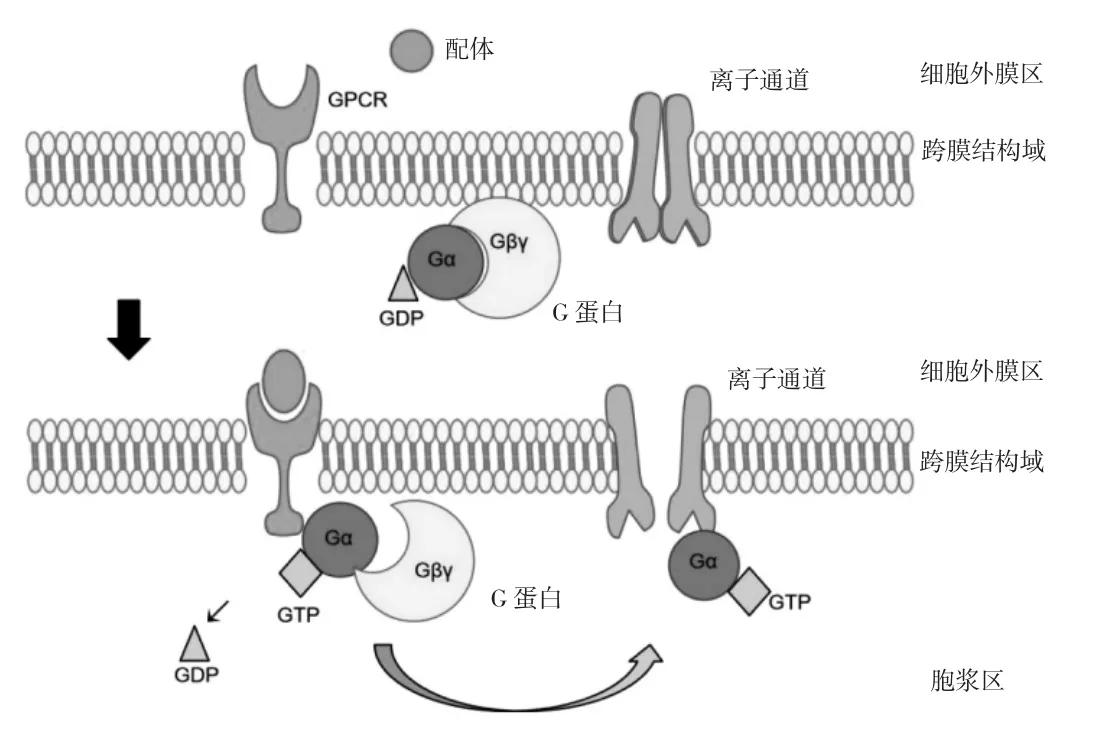
图1 配体诱导的G蛋白活化型/非活化型构象变化示意图
为进一步研究GTPBP4基因高表达促进HCC发展进程的作用机制,研究人员对其相关通路和下游基因表达情况做了深入分析。在通路富集分析中发现,GTPBP4基因的异常表达使得与肿瘤发生、细胞生存相关的ErbB信号通路有显著改变且关系最为密切[18,20]。对一些与细胞凋亡、增殖相关的关键性基因如CDKN1A、CDKN1B和MDM2进行研究发现,在用GTPBP4小干扰RNA重组慢病毒沉默肿瘤细胞GTPBP4基因后,CDKN1A和CDKN1B基因的表达水平增加,MDM2的表达水平降低[18]。CDKN1A受抑癌基因p53的严密调控,并介导依赖p53的细胞周期G1期阻滞,进而引发各种应激刺激[21]。CDKN1B则编码结合蛋白来阻止cyclin ECDK2或cyclin D-CDK复合物的激活,从而控制细胞周期进程[22]。而MDM2可介导p53/TP53泛素化,通过蛋白酶体抑制p53/TP53和p73/TP73介导的细胞周期阻滞和细胞凋亡,进而使细胞降解[23]。此外,研究还证实了,沉默GTPBP4可在核仁未破裂的情况下引起p53的积累和激活[11]。因此,GTPBP4可能通过介导ErbB信号通路异常及凋亡相关基因如CDKN1A、CDKN1B、MDM2、p53等的异常表达,从而使HCC肿瘤细胞发生异常增殖,最终影响患者疾病发生、发展和预后。
2.2 GTPBP4 基因在结肠癌(colon cancer,CC)中的表达及及分子机制 CC是消化系统好发的恶性肿瘤之一,临床上对CC的治疗多以手术联合放化疗为主,但一些患者在确诊时已无手术指征,靶向基因治疗有望成为CC治疗的突破点,靶向基因检测可以提高CC早期检出率及准确性[24]。有研究发现,在CC细胞株RKO中,沉默GTPBP4基因后,细胞周期显著抑制,并停滞于S期[25]。进一步研究发现,GTPBP4能结合p53,从而抑制p53的功能。而当GTPBP4基因被沉默后,p53基因表达水平和转录活性均显著升高,其下游靶基因p21、Hdm2和Puma mRNA的表达水平也明显升高[11,25]。p53为重要的抑癌基因,GTPBP4为p53的负性调控因子,故而GTPBP4基因可能为促癌基因,通过调节p53信号通路来调节细胞周期,进而促进肿瘤细胞增殖、抑制细胞凋亡来促进CC的发生、发展。
唐丹等[12]在对CC细胞株HT29的研究中,同样发现了GTPBP4基因具有负向调控p53因子的功能,可使p53的抑癌功能减弱。在沉默GTPBP4基因后,发现肿瘤细胞克隆增殖能力减低、细胞周期阻滞,凋亡率增加,p53表达上调。除此之外,还发现GTPBP4基因沉默后肿瘤细胞的侵袭能力减弱,Survivin蛋白表达降低。Survivin属于凋亡抑制蛋白家族成员之一,具有促进肿瘤细胞增殖、血管生成、抗凋亡等多种功能[26]。故此,CC的发生、发展可能是GTPBP4与p53、Survivin存在相互作用的结果。
另外,有研究者发现,GTPBP4基因高表达可促使CC的迁移、侵袭及转移能力增加,对应患者预后较差,用K-M分析和多线性Cox回归分析表明,GTPBP4基因是CC的一个独立预后因子[27]。其中,GTPBP4诱导CC细胞转移主要通过抑制RhoA信号来破坏激动蛋白的细胞骨架,沉默GTPBP4基因则显示可以减少裸鼠模型肺转移灶的大小和数量,以及丝状激动蛋白的皮层定位。
2.3 GTPBP4 基因在胃癌(gastric cancer,GC)中的表达及分子机制 GC具有高发病率、高死亡率及高复发风险等特点[28-29]。早期诊断和治疗对GC患者来说非常重要,故寻找一种可靠的预测和治疗靶点具有重大意义。
有研究比较了正常胃上皮细胞GES-1和4种不同的 GC 细胞:MKN-45、AGS、BGC-823 和 MGC-803 中GTPBP4基因的表达量,发现这4种GC细胞均较正常胃上皮细胞GTPBP4蛋白高表达,且差异有统计学意义[30]。将GC组织和癌旁组织进行对比研究则发现,GC组织中不仅GTPBP4的表达量较癌旁组织明显增加,更有其它20种基因如ATP1B3、MLLT11、CHN1等显示表达量明显增加[31]。进一步深入分析GTPBP4基因在GC发生、发展过程中的作用机制,发现GTPBP4和p53基因存在相互作用关系,即GTPBP4与p53可互相结合作用,从而抑制p53发挥其凋亡保护功能,更甚有发现过表达的GTPBP4可诱导GC细胞顺铂(cisplatin)耐药。此外,还发现GTPBP4的表达水平与游离型p53及其下游因子 PTEN、CDKN1AV、TNFRSF10B、MDM2、Fas、Bax 等的表达水平呈负相关,与因子Bcl-2、CCND1表达呈正相关。依据文献报道,CCND1基因可促进细胞增殖,CCND1基因异常则可影响正常的细胞周期和增殖,是多种肿瘤发生的原因[32]。MDM2是一原癌基因,参与细胞生长、抑制、凋亡等多种生物学过程,野生型p53与其存在相互反式激活循环并反馈抑制的作用,MDM2/p53之间比率平衡是维持细胞正常生物学功能的基础,MDM2基因异常则将导致细胞转化和肿瘤发生[33-34]。Fas及其配体FasL是细胞凋亡相关的一种膜表面分子,生理状态下在维持脏器免疫自稳、免疫特赦等中发挥重要作用,异常表达时还与肿瘤细胞的免疫逃逸和免疫耐受密切相关[35]。
因此,GC的发生、发展一部分可能是由于过表达的GTPBP4直接结合p53因子从而抑制其凋亡保护功能;也可能是作用于p53因子的下游信号通路,并通过下游相关因子来影响GC的发生、发展过程。
2.4 GTPBP4在乳腺癌(breast cancer,BC)中的表达及及分子机制 BC是影响女性生命健康的恶性肿瘤之一,具有高死亡率和发病率[36]。研究发现,在BC中以p53基因突变最为常见[37-39],突变的频率则与该BC的生化特征、组织学特性相关,并决定了其分子亚型,如三阴性BC患者p53基因的突变率为80%[40]。此外,研究发现p53的表达与特定型别如管腔A/B型BC和三阴性BC的无病生存期和总生存期存在对应关系[41],即可通过患者体内p53含量来预测一些特定型别BC患者的预后。Lunardi等[11]对人类p53网络节点进行探索发现,BC细胞经GTPBP4 siRNA转染后能够在未破坏核仁的前提下引起p53的聚集和激活,并可使p53的靶基因p21、Hdm2和Puma的表达水平升高。在对NKI、Pawitian和Miller三大数据库中BC患者相关数据进行Cox单因素回归分析发现,GTPBP4表达增加与患者生存率降低有关,且差异有统计学意义(PNKI=0.00025,PPawitian=0.00024,PMiller=0.0015)[42-44]。
因此,GTPBP4可能通过抑制p53因子及其下游通路的活化,从而影响BC的疾病进展,而检测患者机体GTPBP4表达量可能为临床对患者分型判断、预后评估等提供可靠的理论依据,并有望通过调节患者体内GTPBP4表达来治疗BC,从而为广大患者带来福音。
2.5 GTPBP4基因在NF2中的表达及分子机制 NF2是一种典型的遗传性疾病,特点是易发展为中枢神经系统的多种良性肿瘤[45]。NGB属于GTP结合蛋白的一种。研究发现,NGB与前述肿瘤患者体内表达的GTPBP4有所不同,它可通过其赖氨酸-395/精氨酸-394位点与Merlin蛋白进行结合,并通过调节Merlin从而抑制细胞周期蛋白D1(cyclin D1)的表达及其致瘤性,从而抑制肿瘤细胞的增殖,即此类GTP结合蛋白在患者体内对肿瘤生长、增殖起抑制作用[9]。而在神经胶质瘤中,肿瘤的发生、发展有赖于NGB及其与Merlin蛋白的结合位点发生突变,丧失了抑癌活性。因此,NGB的正常表达和其与Merlin蛋白结合位点的修复可能成为该病的潜在治疗靶点。
3 小结
总体而言,GTPBP4在大部分恶性肿瘤的发生、发展过程起促进作用。在HCC、GC、BC、CC中,研究发现GTPBP4在肿瘤组织中高表达,且患者体内GTPBP4的高水平表达往往预示着疾病的较差预后,生存率相对低下。在肿瘤细胞中,转染GTPBP4 siRNA后发现,在未破坏核仁的前提下,沉默GTPBP4基因可使p53发生聚集和激活,并使得细胞集落增殖能力减弱,细胞周期阻滞,侵袭、迁移能力降低,凋亡率上升,血管生成能力也明显降低。我们猜测上述肿瘤的发生、发展可能是通过异常高表达的GTPBP4直接结合p53或通过影响p53间接影响其下游因子如MDM2、p21、Fas等,从而抑制细胞的凋亡保护作用;也可能是通过影响核糖体的生物合成进而影响细胞的正常生物学过程发生的,其主要通过影响核糖体-Mdm2-p53途径来阻碍MDM2与p53结合,致使p53泛素化降解,从而影响细胞的凋亡、自噬等能力[46]。然而,比较特殊的是,研究者发现该GTPBP4蛋白在神经胶质瘤细胞中具有抑瘤特性。GTPBP4主要通过与Merlin蛋白结合,抑制cyclin D1的表达,从而抑制肿瘤细胞的生长和侵袭,以起到抑癌作用。该类型肿瘤的发生、发展则有赖于GTPBP4的突变也即GTPBP4与Merlin蛋白结合位点的突变。
因此,GTPBP4作为相关恶性肿瘤治疗的关键点尚待大量试验研究探索和验证,尤其对于该基因和它表达的蛋白在人体内的抑癌或促癌作用亟待进一步明确。GTPBP4及其表达的蛋白还与人体多种因子和通路有着网络联系,故而对上述涉及到的通路、因子也需进一步探索。
综上所述,GTPBP4在多种常见肿瘤的发生、发展中起着重要作用,有望成为临床上相关肿瘤诊断、治疗及评估的潜在靶点或关键节点,可能为临床靶向治疗肿瘤提供新的思路。然而,目前GTPBP4相关的国内外文献仍尚少,亟待研究人员进一步深入探索以期获取更多理论证据。

