体外培育熊胆粉对小鼠中枢神经系统作用的一般药理学研究
陆锦遥,王琼,王优杰,谷颖敏,章鑫,谢家骏,张小利,田雪松*
(1.上海中医药大学创新中药研究院,上海 201203;2.上海凯宝药业股份有限公司,上海 201401)
熊胆是传统名贵中药,熊胆粉为熊科动物黑熊(Selenaretos thibetanus Cuvier)经胆囊手术引流胆汁而得的干燥品,具有清热、平肝、明目等功效,用于治疗惊风抽搐,目赤肿痛,咽喉肿痛[1-3]。限于天然熊胆粉来源的特殊性和稀缺性,其相关中药制剂的开发和使用受到了严重阻碍,因此通过合成或生物技术的手段寻找安全有效的熊胆粉替代品迫在眉睫[4-5]。上海中医药大学、上海凯宝药业股份有限公司及重庆大学协作建立了熊胆粉体外培育生物转化技术,将家禽鸡胆粉体外转化为熊胆粉,以期替代天然熊胆粉应用于临床。为进一步探究基于该技术生产的体外培育熊胆粉的安全性,本实验按照《中药、天然药物一般药理学研究技术指导原则》对其进行一般药理学研究,观察其对小鼠中枢神经系统的影响,为临床应用提供安全性评价实验数据,并为进一步研发提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 动物 ICR小鼠160 只,雌雄各半,体质量16~18 g,SPF 级,购于上海西普尔-必凯实验动物有限公司,实验动物合格证号:SCXK (沪) 2013-0016。所有动物均饲养于上海中医药大学SPF 级动物房,环境温度23~24 ℃,相对湿度42%~63%,换气次数≥15次/h。人工控制照明,昼夜交替时间为12 h/12 h。所有动物实验严格遵守上海中医药大学实验动物伦理委员会的要求。
1.1.2 药物与试剂 体外培育熊胆粉(上海凯宝药业股份有限公司,黄色至深棕色碎片、颗粒或粉末,含量:牛磺熊去氧胆酸31.1%,牛磺鹅去氧胆酸13.3%,批号:20160801),临用时,0.5%羧甲基纤维素钠溶液溶解配置成所需浓度的溶液;地西泮(上海信谊药厂有限公司,规格:2.5 mg/片,批号:1416030)。羧甲基纤维素钠(CMC-Na,国药集团化学试剂有限公司,微黄色纤维状粉末,批号:20150421),用前配制成0.5% (W/V)溶液。戊巴比妥钠(德国进口分装,白色粉末,纯度:≥98%,批号:WS20141110)。上述药品均密封,避光,置阴凉干燥处保存。
1.1.3 主要仪器 ME203型电子天平(仪器编号:20131673,梅特勒-托利多有限公司);YLS-1A多功能小鼠自主活动记录仪(仪器编号:20020620、20061560,济南益延科技发展有限公司)。
1.2 实验方法
1.2.1 小鼠一般行为和自发活动实验 取检疫合格的小鼠60 只,按给药前自发活动数随机分为5 组,每组12只,雌雄各半,分别为溶剂对照组、体外培育熊胆粉低剂量组、中剂量组、高剂量组和阳性对照组。低、中、高剂量组分别灌胃体外培育熊胆粉为0.8、2.5、8.0 g·kg-1;阳性对照组灌胃地西泮2.0 mg·kg-1;溶剂对照组灌胃等容量20 mL·kg-1的0.5% CMC-Na溶液。给药前各组禁食3~5 h,观察给药后2.5 h内的一般行为变化(姿态、步态、流涎、流汗、肌颤及瞳孔变化等)。多功能小鼠自主活动记录仪记录给药前及给药后30、60、90、120及150 min小鼠的自发活动次数。每次记录前先将小鼠置于自主活动仪中适应3 min,记录5 min 内小鼠的自发活动次数。
1.2.2 小鼠协调运动实验 给药前两天,每天用一根表面光滑、垂直竖立的金属棒(直径为1.5 cm,长度80.0 cm),训练小鼠爬竿,每天3次。给药当天,按协调运动障碍评级标准(见表1),挑取检疫合格且评分0.0级小鼠50 只,体质量随机分为5 组,每组10只,雌雄各半,分别为溶剂对照组、体外培育熊胆粉低剂量组、中剂量组、高剂量组和阳性对照组(除给予阳性对照组地西泮3.0 mg·kg-1外,其他给药方法与剂量同自发活动实验)。给药前各组禁食3~5 h,分别于给药前及给药后30、60、90、120及150 min将小鼠头朝下放在棒的顶端,任小鼠自然向下爬行,以测定协调运动情况。

表1 协调运动障碍评级标准
1.2.3 阈下睡眠剂量戊巴比妥钠协同作用实验[6]取检疫合格的小鼠50 只,按体质量随机分为5 组,每组10只,雌雄各半,分别为溶剂对照组、体外培育熊胆粉低剂量组、中剂量组、高剂量组和阳性对照组(给药方法与剂量同小鼠协调运动实验)。给药前各组禁食3~5 h,给予溶剂及体外培育熊胆粉后60 min(阳性对照组灌胃3.0 mg·kg-1地西泮后30 min),小鼠腹腔立即注射戊巴比妥钠30 mg·kg-1,以翻正反射消失达1 min以上者计为发生睡眠,计算各组睡眠发生百分率。
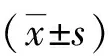
2 结果
2.1 体外培育熊胆粉对小鼠一般行为和自发活动的影响 各剂量组的体外培育熊胆粉对小鼠姿态、步态、流涎、流汗、肌颤及瞳孔变化等一般行为无明显影响。在自发活动方面,低剂量、高剂量组与溶剂对照组在各时间点相比差异无统计学意义(P>0.05)。中剂量组给药后60 min自发活动减少,与溶剂对照组相比差异有统计学意义(P<0.05),其余时间点相比差异无统计学意义(P>0.05)。阳性对照组给药后各时间点小鼠活动均减少,与溶剂对照组相比差异均有统计学意义(P<0.001),结果见表2。
表2 体外培育熊胆粉对小鼠自发活动的影响
注:与溶剂对照组比较,*P<0.05,**P<0.001
2.2 体外培育熊胆粉对小鼠协调运动的影响 各剂量组给药后各时间点与溶剂对照组相比,无显著性差异(P>0.05)。与溶剂对照组比较,阳性对照组小鼠协调运动障碍的评级明显升高,在给药后各时间点差异均有统计学意义(P<0.001),结果见表3。
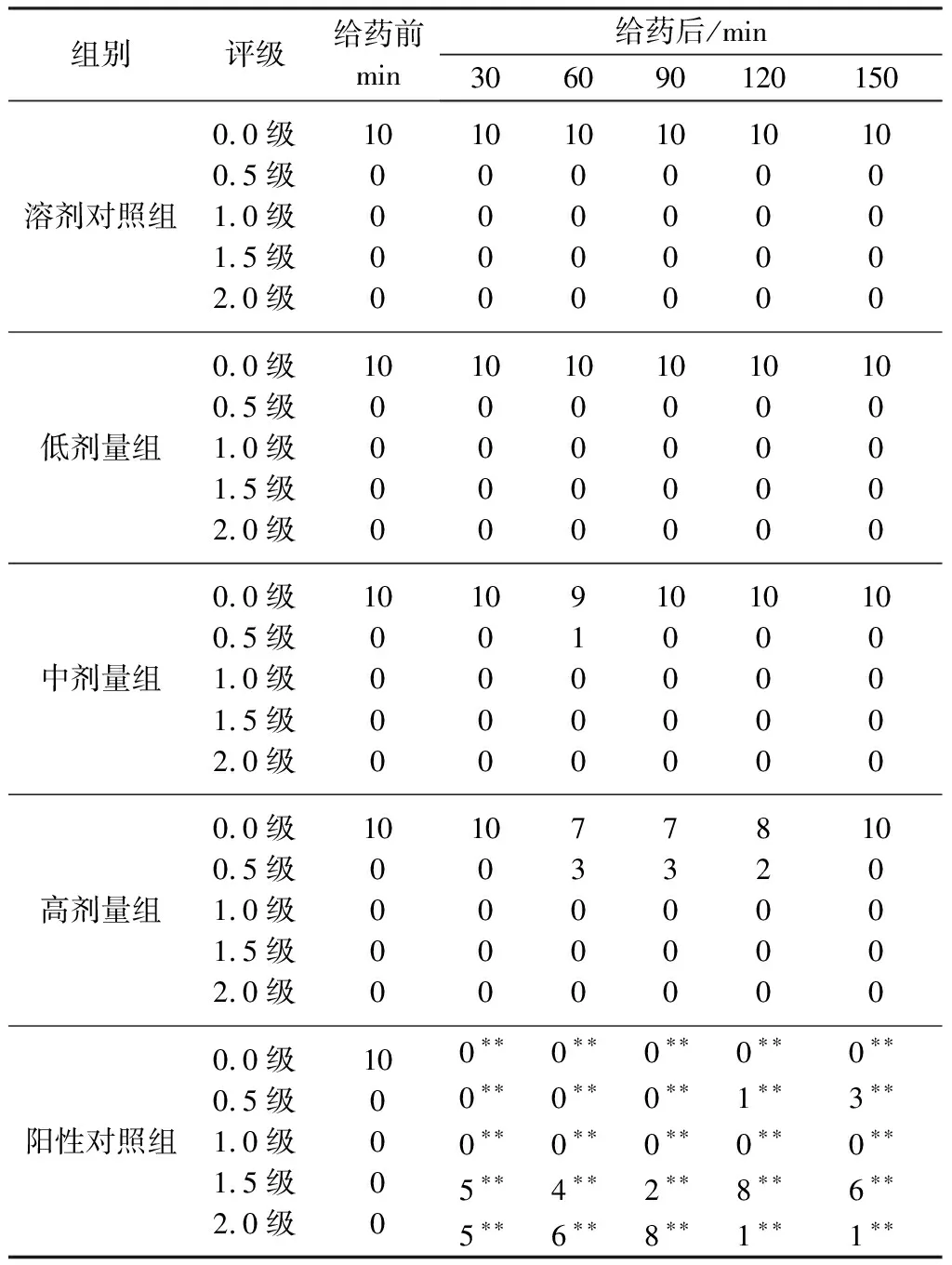
表3 体外培育熊胆粉对小鼠协调运动的影响(n=10)
注:与溶剂对照组比较,**P<0.001
2.3 体外培育熊胆粉对阈下睡眠剂量戊巴比妥钠协同作用的影响 溶剂对照组(无小鼠睡眠)、低剂量(无小鼠睡眠)、中剂量[10只小鼠1只(雌性)睡眠]、高剂量[10只小鼠1只(雄性)睡眠],睡眠发生的百分率与溶剂对照组相比,无统计学意义(P>0.05)。给予阳性对照品30 min时,腹腔注射阈下睡眠剂量的戊巴比妥钠,小鼠全部睡眠(5雌性,5雄性),睡眠发生的百分率与溶剂对照组相比有统计学意义(P<0.001),结果见表4。

表4 体外培育熊胆粉与阈下睡眠剂量的戊巴比妥钠协同作用对小鼠睡眠的影响(n=10)
注:与溶剂对照组比较,**P<0.001
3 讨论
体外培育熊胆粉拟临床用于替代天然熊胆粉,但是其对中枢神经系统的影响尚未进行研究,其临床安全性及潜在受累器官均不清楚。前期实验显示,体外培育熊胆粉大鼠药效学有效剂量为0.3 mg·kg-1,按照安全药理学试验的剂量设定原则“应包括或超过主要药效学的有效剂量或治疗范围”,故本次实验低剂量设定为0.8 g·kg-1,中、高剂量分别按等比设定为2.5和8.0 g·kg-1[7]。此外文献报道,大鼠灌胃熊胆粉提取物后,熊去氧胆酸Tmax为(55.0±7.7)min,t1/2为(97.5±17.7)min,鹅去氧胆酸Tmax为(52.5±8.2)min,t1/2为(113.8±21.5)min。故本次实验记录给药后30、60、90、120及150 min,涵盖了体外培育熊胆粉主要组分的Tmax及t1/2[8]。
本实验结果显示,各剂量组的体外培育熊胆粉对小鼠一般行为无明显影响,但在自发活动方面,低、高剂量组与溶剂对照组相比差异无统计学意义;中剂量组在给药后60 min自发活动减少,其余各时间点均差异无统计学意义,因该时间点一般行为无明显改变,协调运动亦差异无统计学意义,且高剂量组无类似改变,故认为此变化与药物毒性作用无关;阳性对照组给药后各时间点自发活动均减少,差异有统计学意义。在协调运动实验,低、中及高剂量的体外培育熊胆粉在各时间点对小鼠协调运动无明显影响,阳性对照组与溶剂对照组相比在各时间点差异均有统计学意义。在阈下睡眠剂量戊巴比妥钠实验,低剂量组无睡眠出现,中、高剂
量组各有1只睡眠,但无统计学差异;阳性对照组则全部睡眠,与溶剂对照组相比差异均有统计学意义,表明具有协同作用。
综合考虑认为,小鼠灌胃设计剂量的体外培育熊胆粉对中枢神经系统无明显影响。本实验进一步补充和完善了体外培育熊胆粉安全性实验数据,为其在临床上的应用提供了实验依据。

