乳癌相关淋巴水肿的诊治研究进展
郑圣齐 何林 吕杨 宋玉华
[摘要]许多乳癌诊疗措施在提高病人生存率的同时也会引起乳癌相关淋巴水肿(BCRL)的发生。体质量超标、肥胖、过多的阳性淋巴结数以及包膜肿瘤侵犯等也是BCRL的危险因素。越早开始临床干预和治疗,就越能有效地减少患肢的水肿体积和改善病人的生活质量。目前,治疗BCRL的方法主要包括综合消肿治疗、气动压缩装置辅助治疗、体育锻炼、显微外科手术和抽脂术等,但是尚未发现能治疗淋巴水肿的有效药物,近期在动物模型上应用的分子治疗的成功可能会弥补这一缺陷。有初步研究显示,自体干细胞移植可以减小患肢的体积且不会出现水肿的反弹,这可能为治疗BCRL提供了新的方法。本文主要综述了BCRL的发病机制、临床表现、风险因素、预防、诊断工具和监视方法、常规和新型治疗模式的特点等方面研究进展。
[关键词]乳腺癌淋巴水肿;诊断;治疗;综述
[中图分类号] R737.9[文献标志码] A[文章编号] 2096-5532(2020)04-0495-05
doi:10.11712/jms.2096-5532.2020.56.124
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20200611.2037.005.html;2020-06-15 09:10
RESEARCH ADVANCES IN THE DIAGNOSIS AND TREATMENT OF BREAST CANCER-RELATED LYMPHEDEMA
ZHENG Shengqi, HE Lin, Lü Yang, SONG Yuhua
(Department of Oncology Third Ward, The PLA Navy Anqing Hospital, Anqing 246000, China)
[ABSTRACT]Most diagnostic and treatment strategies for breast cancer patients can improve the survival rate of patients, but they may also lead to breast cancer-related lymphedema (BCRL). Overweight, obesity, excessive number of positive lymph nodes, and capsular tumor invasion are risk factors for BCRL. Earlier clinical intervention and treatment can more effectively reduce edema volume of affected limbs and improve patients quality of life. At present, major treatment methods for BCRL include comprehensive detumescence treatment, adjuvant therapy with pneumatic compression device, physical exercise, microsurgery, and liposuction; however, no effective drugs have been found for the treatment of lymphedema, while the success of molecular therapy applied to animal models will compensate for this defect. In addition, some preliminary studies have showed that autologous stem cell transplantation can reduce the excessive volume of affected limbs without the recurrence of swelling, which may provide a new method for the treatment of BCRL. This article reviews the pathogenesis, clinical manifestations, risk factors, prevention, diagnostic and monitoring tools, and conventional and new treatment paradigms for BCRL.
[KEY WORDS] breast cancer lymphedema; diagnosis; therapy; review
越来越多的乳癌诊疗措施在大幅提高病人总体生存率的同时也带来了一些诊疗相关的并发症,例如乳癌相关淋巴水肿(BCRL)。BCRL常由创伤、感染、放疗损伤、手术所致,尤其是淋巴结切除术的最常见的不良后果,表现为局部淋巴脉管系统的破坏和受累肢体体积增大≥10%[1]。它给病人的生活方式、职业角色、功能状态、社会心理和经济等方面造成了许多负面的影响。乳癌病人终生都会面临发生BCRL的风险,大多数的BCRL发生在治疗完成后的14.4个月内[2-3],发生概率为14%~40%[4]。为提高对该病的认识,本文主要就BCRL的发病机制、临床表现、风险因素、预防、诊断工具、监视方法以及常规和新型治疗模式的特点等进行综述。
1 发病机制和临床表现
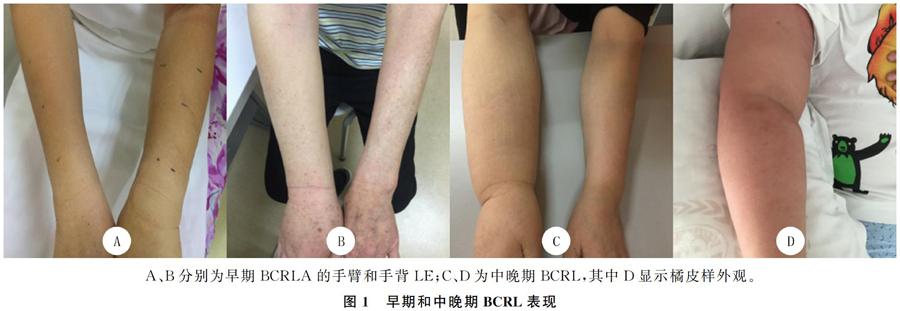
不论是急性还是慢性发展的淋巴水肿(LE),其严重程度与受累淋巴管内富含蛋白质液体的异常充盈程度有关[5]。LE的臨床表现各异,包括肿胀、疼痛、不适、关节灵活性下降以及感染等。在BCRL的早期阶段,病人的手背或手臂的表面会出现轻微的肿胀,并伴有肢体沉重感、模糊感、不适感等(图1A、B)。早期水肿可在受到外部压力后消失,前臂是首发肿胀的最常见部位,其次是腋窝、肩胛区和乳房。在疾病的中晚期,抬高肢体或者施加外压并不能缓解肿胀,且受累范围会进一步扩大,甚至出现橘皮样外观(图1C、D)。
2 危险因素
目前,虽然没有明确哪些病人容易发生LE,但是已经明确很多与LE发生相关的危险因素,包括腋窝淋巴结清扫(ALND,与早期BCRL的发生有关)[6]、区域淋巴结放疗(与中晚期BCRL的发生有关)[3]、乳癌确诊时过高的体质量指数(BMI,≥25 kg/m2)[7]、过多的阳性淋巴结数(>8)以及包膜的肿瘤侵犯等[8]。
为了减少和避免BCRL的发生,2012年,美国National Lymphedema Network提出的一项声明指出,病人应避免飞行、患部受创、皮肤穿刺(如采血)、患肢受压(如测量血压)、皮肤感染、接受极端的温度等[9]。然而,有临床调查研究发现,注射、飞行、采血和测量血压与患肢体积的增加无关[10],表明它们并不是BCRL的危险因素。而CLARK等[10]认为皮肤穿刺是发生BCRL的高危因素。上述研究结论不一致,尚需更多的研究来促成共识。
3 预防
在治疗乳癌的初始阶段,尤其是在术前通过评估BCRL的危险因素来选择合适的手术方案,可以预防BCRL的发生。例如,接受乳房包块切除术的病人发生BCRL的概率明显低于接受乳房全切除术或改良根治术的病人[11]。以往认为,孕妇、男性病人、炎性乳癌病人、接受乳房全切除手术的病人以及接受系统性新辅助化疗的病人都需要进行ALND手术。近年的研究则认为,腋窝淋巴结活检(ALNB)可替代ALND用于评价系统性新辅助化疗后或乳房包块切除术后病人的残余淋巴结状态,这不会增加LE的发生率;而对于接受乳房全切术的病人,也只需进行前哨淋巴结清扫术即可[12]。此外,用腋窝放疗来代替ALND同样可以起到控制乳癌术后肿瘤复發和转移的作用。
2007年,有临床研究提出了一种绘制腋窝区域淋巴引流的新技术,称为腋窝反向绘图(aARM)[13]。在ALND手术过程中,将蓝色染料注入手臂来辨别上肢淋巴管和乳房淋巴管,可以彻底地去除乳房淋巴管而保留上肢淋巴管,从而避免了因摘除上肢淋巴管而引起的LE。越来越多的临床试验已经证实,在ALND手术过程中进行aARM发生BCRL的概率明显低于只接受ALND手术者[14-15]。然而,当保留上肢淋巴管时,必须考虑肿瘤转移的安全性,特别是对于前哨淋巴结阳性的病人,因为上肢淋巴结和前哨淋巴结的重合率高达27%[16]。当然,如果这些病人接受了新辅助化疗,便会大大降低发生肿瘤转移的风险。
4 诊断和监视
诊断BCRL的发生要基于病人的风险评估、身体状况以及客观的检查结果。虽然BCRL常见的临床症状有疼痛、肿胀、麻木、手臂沉重、受累节段的僵硬和关节活动受损等,但并非所有的病人都会表现出来,因此对高危人群仍需通过客观的身体检查来明确疾病的发生。目前已经有很多技术和仪器用来诊断BCRL,如肢体测量、生物阻抗谱(BIS)[17]、磁共振成像(MRI)[18]、放射性淋巴系统闪烁造影术以及吲哚菁绿(ICG)淋巴造影术[19]。
临床通过测量肿胀肢体的变形程度来诊断BCRL,标准方法包括测压法、肢体周长法和排水量法。2018年,ENGIN等[20]使用一种新的容积仪来测量患肢的排水量,即“easy volumeter”,该法是专门为家用而设计的,比标准的容积仪更耐用、更轻、更容易清洗。
如果上述的标准方法都不能做出明确的诊断,放射性淋巴系统闪烁造影术是标准的替代方法。这种核医学成像技术通过在手部皮下注射放射性硫磺胶体,使手部到腋窝的淋巴管可视化[21]。若发生LE,则会使腋窝淋巴结可视化延迟并伴有真皮淋巴管扩张症[21]。虽然这种技术能诊断出早期的BCRL,但仍有许多不足之处,包括辐射暴露、侵入性操作、低分辨率和高花费等。
ICG淋巴造影术是一种较新的观察患肢水肿及淋巴循环系统的方法[17]。与放射性淋巴系统闪烁造影术相比,它没有辐射暴露,且特异度和灵敏度更高,跟踪时间更长,能够涵盖到前临床阶段到疾病的晚期,最大的优点是能够在手术期间实时监测淋巴脉管系统[22]。唯一的缺点是无法观测皮下组织厚度超过2 cm的淋巴管。
MRI可用来诊断LE并发脂肪组织水肿,它比放射性淋巴系统闪烁造影术的特异度更高 (85.7% vs. 66.7%)、灵敏度更好(100% vs. 83.3%)[23]。除此之外,MRI还能明确淋巴管中断或阻塞的原因和皮下组织过量的水潴留。但是,它的费用较高且无法进行实时监测。
[CM(23*2]BIS从2000年便开始应用于诊断LE,它通过测量人体对外加电流的反应而产生的细胞外液体积变化来明确诊断。其测量结果与传统方法比较更客观、特异度更高(80%~99%),但灵敏度波动范围大(30%~100%)[24-26]、假阴性率偏高(36%)[17]。另外,BIS能够对BCRL的前临床阶段做出诊断并可持续追踪病情进展,为疾病的及时干预和有效治疗提供方便。如果能在前临床阶段及时干预BCRL的进展,可将疾病的发生率降低32%[27]。
目前,BCRL的监视技术主要有以下4种。①排水量法:耗时长,不适用于大样本量的持续监视;②测压法:一种利用光学原理来评估患肢体积的方法,耗时短但花费较高;③张力测量法:一种通过测量受累组织中的电解质水平和评估其含水量的无创性检查手段,可以发现前临床阶段的间质水肿[28];④BIS:该方法灵敏度高但缺乏特异性,是目前最常用的方法[17]。
5 治疗
5.1 综合治疗
综合消肿治疗(CDT)是有效缓解LE的最佳治疗模式,包括手动淋巴引流(MLD)、皮肤护理、体育锻炼、长期LE自我管理教育、压迫绷带、压迫套袖或压迫长袜等方法。一种由地奥司明、香豆素和熊果苷混合而成的名为Linfadren的药品能进一步提高CDT的疗效,而且未观察到任何不良反应[29]。但需要注意的是,肥胖是影响CDT疗效的一个不利因素。
MLD是一种使用特殊的节奏脉动进行按摩的技术,能够通过轻柔地、有针对性地拉伸皮肤来按摩患肢并刺激淋巴收缩力,从而改善淋巴引流。然而一项Meta分析表明,与包括锻炼、皮肤护理和压迫绷带等方法相比,额外增加的MLD并未能显著地缩小患肢的多余体积[30]。相比之下,一项基于Cochrane数据库的系统综述的亚组分析表明,MLD结合压迫绷带在缓解患肢肿胀方面明显优于单纯的压迫绷带,特别在轻中度水肿的病人中效果更好[31]。用压迫绷带来缓解LE同样有效,一旦患肢的水肿缩小到最低,病人可以开始自我护理。总之,CDT治疗BCRL有很多优点,除可以缩小患肢的体积外,还能减轻疼痛强度和手臂的沉重感,增强淋巴功能,提高生活质量以及降低蜂窝织炎的发生率。
辅助工具如气动压缩装置(PCD)的使用彻底缓解了因BCRL而门诊就诊和住院的压力。使用PCD缩小患肢体积后再穿上合适的弹力压缩服,可以维持患肢在很长时间内不出现水肿的反弹。目前,最先进的PCD也是为家用而设计的,它比普通的PCD多安装了一台梯度压缩机,具有更高的可调节性和可编程性。这种新型PCD的使用明显降低了BCRL病人蜂窝织炎的发生率,减少了手动治疗频次和门诊就诊量。
众所周知,久坐不动的生活方式会导致体质量超标甚至肥胖,这些因素都会增加BCRL的发生率[32]。乳癌病人在治疗期间和治疗后参加体育锻炼,可以改善其心理状态和身体状况,从而使其生活更积极、生存期更长。以往认为患有BCRL或有BCRL发生相关高危因素的病人应该取消体育锻炼。现在的一些初步研究证明,运动既不会导致BCRL也不会加重其病情进展[33]。与不运动相比,缓慢渐进式的运动如举重、有氧运动、抗阻训练、伸展运动、瑜伽、气功和普拉提等都不会增加BCRL的发生率。
5.2 手术治疗
治疗BCRL的手术方法包括减压手术、抽脂术、淋巴静脉“端端”吻合术(LVA)和血管化的淋巴结(VLN)移植术。LVA通常仅适用于疾病的早期[34],能够缩小创伤和降低并发症的发生风险,并可在局麻下操作。对接受LVA治疗的女性随访1年发现,超过56.5%的吻合管仍然保持通畅[35]。若在ALND手术过程中进行LVA治疗,能将BCRL的发生率降低到4.05%[36]。有研究提出了另一种有关LVA的革新技术,即在术前先对前臂进行动态成像,确定切入点后再进行LVA手术,称之为动态淋巴静脉吻合术[37]。这种新型手术方式比传统的LVA更显著地缩小了患肢体积,且术后去除压缩服随访1年也未发现水肿的反弹。
治疗中晚期BCRL一般使用VLN移植术,该手术能降低疾病的临床分级,缩短肢体的周长,降低蜂窝织炎的发生率以及改善病人的生活质量。术后需要严密观察移植部位,因为供体LE是术后最严重的并发症。因此,选择合适的病人、术前仔细评估供体和受体部位是VLN移植术成功的重要因素。血管化的腹股沟淋巴结(VGLN)皮瓣移植术可让医生和病人摆脱这种担忧,因为它不会引发供体部位任何医源性的LE,但是该术式不能实施在有下肢LE高危因素(如肥胖、既往有下肢水肿或有盆腔手术史等)的病人身上[38]。
由于压缩很难缩小脂肪组织的体积,所以不能用CDT来治疗伴有多余脂肪组织的严重的慢性BCRL;此外,慢性的非点状BCRL病人皮下持续形成的新的脂肪组织难以被切除,所以显微外科手术通常也不能完全地恢复患肢的体积。抽脂术的普及解决了这一难题,它可以去除多余的脂肪组织,从而为患肢体积的完全恢复创造了条件。研究表明,抽脂术能在1~3个月内使严重的慢性非点状BCRL病人的患肢体积完全复原,长期的随访观察也未发现患肢水肿的反弹。此外,抽脂术还能改善淋巴流动,将皮肤的血流量提升到接近正常手臂的水平,并且不会损伤现有的淋巴管,从而极大地降低了丹毒和蜂窝织炎的发生率。
5.3 新型治疗
既往的任何药物都不能治疗LE,因为它们都不能改善淋巴循环。随着越来越多控制淋巴功能的分子机制的发现,这种情况可能会逆转。据报道,治疗LE的第一种药物已经进入了第一阶段临床试验[39]。很多治疗LE药物的前临床研究都是直接建立在动物模型上,通过腺病毒将VEGF-C或VEGF-D编码基因转移到表达VEGF-C的蛋白中,从而使动物的患肢中形成许多新生毛细淋巴管并促进淋巴的外渗,达到減轻水肿的目的[40]。小鼠模型接受VEGF-C分子治疗后,患肢受损的集合淋巴管会出现毛细淋巴管的再生,紧接着这些毛细淋巴管会进行内在重塑、分化和成熟为有功能的淋巴管。在猪模型上还发现了VEGF-C分子治疗能修复手术引起的淋巴管损伤,并提高VLN移植术后转移淋巴管的功能和结构稳定性[41]。相信这种VLN移植术后联合VEGF-C分子治疗的方案同样能够促进人体淋巴与微血管的吻合。
前临床研究发现,移植脂肪组织、肌肉和骨髓中的自体间充质干细胞(MSCs)能有效缓解LE[42]。两项初步临床研究结果显示,在BCRL病人腋窝区注射脂肪源性的MSCs并联合抽脂术,术后病人的耐受性良好,仅出现少量与抽脂术相关的短暂不良事件,继续随访6~12个月,患肢LE得到了很好的缓解,且没有发生肢体水肿的反弹[43-44]。
6 小论
BCRL对乳癌病人的生活质量造成了巨大的负面影响,越早开始LE监视和使用有效工具诊断,越能为疾病的前临床或早期阶段提供更多干预和治疗的机会,尤其是对伴有明确的高危因素的病人。在各种治疗模式中,CDT是必不可少的,在此基础上联合辅助PCD和适当的身体锻炼,更有利于减小患肢体积和提高病人的生活质量。在手术方法中,LVA适用于早期BCRL,VLN移植术侧重于中晚期BCRL,而抽脂术则适用于BCLR伴有赘余的脂肪组织。VEGF-C分子治疗和MSCs移植术的成功,可能会为BCRL的治疗提供新选择。
[参考文献]
[1]ARMER J M, BALLMAN K V, MCCALL L, et al. Lymphedema symptoms and limb measurement changes in breast cancer survivors treated with neoadjuvant chemotherapy and axillary dissection:results of American College of Surgeons Oncology Group (ACOSOG) Z1071 (Alliance) substudy[J]. Supportive Care in Cancer, 2019,27(2):495-503.
[2]DISIPIO T, RYE S, NEWMAN B, et al. Incidence of unila-teral arm lymphoedema after breast cancer: a systematic review and meta-analysis[J]. The Lancet Oncology, 2013,14(6):500-515.
[3]SPECHT M C, MILLER C L, RUSSELL T A, et al. Defining a threshold for intervention in breast cancer-related lymphe-dema: what level of arm volume increase predicts progression[J]? Breast Cancer Research and Treatment, 2013,140(3):485-494.
[4]ROCKSON S G, RIVERA K K. Estimating the population burden of lymphedema[J]. Annals of the New York Academy of Sciences, 2008,1131(1):147-154.
[5]MORTIMER P S. The pathophysiology of lymphedema[J]. Cancer, 1998,83(S12B):2798-2802.
[6]SHIH Y C T, XU Y, CORMIER J N, et al. Incidence, treatment costs, and complications of lymphedema after breast cancer among women of working age: a 2-year follow-up study[J]. Journal of Clinical Oncology, 2009,27(12):2007-2014.
[7]MCDUFF S G R, MINA A I, BRUNELLE C L, et al. Timing of lymphedema after treatment for breast cancer: when are patients most at risk[J]? Int J Radiat Oncol Biol Phys, 2019,103:62-70.
[8]IYIGUN Z E, DUYMAZ T, ILGUN A S, et al. Preoperative lymphedema-related risk factors in early-stage breast cancer[J]. Lymphat Res Biol, 2018,16:28-35.
[9]Position Statement of the National Lymphedema Network. Lymphedema risk reduction practices[Z]. http://www.lymphnet.org/pdfDocs/nlnriskreductionpdf. 2012.
[10]CLARK B, SITZIA J, HARLOW W. Incidence and risk of arm oedema following treatment for breast cancer: a three-year follow-up study[J]. QJM: Mon J Assoc Physicians, 2005,98(5):343-348.
[11]TSAI R J, DENNIS L K, LYNCH C F, et al. The risk of developing arm lymphedema among breast cancer survivors: a meta-analysis of treatment factors[J]. Annals of Surgical Oncology, 2009,16(7):1959-1972.
[12]LYMAN G H, SOMERFIELD M R, BOSSERMAN L D, et al. Sentinel lymph node biopsy for patients with early-stage breast cancer: American society of clinical oncology clinical practice guideline update[J]. Journal of Clinical Oncology, 2017,35(5):561-564.
[13]THOMPSON M, KOROURIAN S, HENRY-TILLMAN R, et al. Axillary reverse mapping (ARM): a new concept to identify and enhance lymphatic preservation[J]. Annals of Surgical Oncology, 2007,14(6):1890-1895.
[14]PASKO J L, GARREAU J, CARL A, et al. Axillary reverse lymphatic mapping reduces patient perceived incidence of lymphedema after axillary dissection in breast cancer[J]. The American Journal of Surgery, 2015,209(5):890-895.
[15]YUE T, ZHUANG D Y, ZHOU P, et al. A prospective study to assess the feasibility of axillary reverse mapping and eva-luate its effect on preventing lymphedema in breast cancer patients[J]. Clinical Breast Cancer, 2015,15(4):301-306.
[16]NOGUCHI M, NOGUCHI M, OHNO Y, et al. Feasibility study of axillary reverse mapping for patients with clinically node-negative breast cancer[J]. European Journal of Surgical Oncology (EJSO), 2016,42(5):650-656.
[17]QIN E S, BOWEN M J, CHEN W F. Diagnostic accuracy of bioimpedance spectroscopy in patients with lymphedema: a retrospective cohort analysis[J]. Journal of Plastic, Reconstructive & Aesthetic Surgery, 2018,71(7):1041-1050.
[18]DUEWELL S, HAGSPIEL K D, ZUBER J, et al. Swollen lower extremity: role of MR imaging[J]. Radiology, 1992,184(1):227-231.
[19]OGATA F, NARUSHIMA M, MIHARA M, et al. Intrao-perative lymphography using indocyanine green dye for nea-rinfrared fluorescence labeling in lymphedema[J]. Annals of Plastic Surgery, 2007,59(2):180-184.
[20]ENGIN O, AKALIN E, SARIBAY E, et al. Easy volumeterin detection of breast cancer-related lymphedema: a validity study[J]. Lymphatic Research and Biology, 2019,17(5):543-549.
[21]ROCKSON S G. Lymphedema after breast cancer treatment[J]. New England Journal of Medicine, 2018,379(20):1937-1944.
[22]MIHARA M, HARA H, ARAKI J, et al. Indocyanine green (ICG) lymphography is superior to lymphoscintigraphy for diagnostic imaging of early lymphedema of the upper limbs[J]. PLoS One, 2012,7(6):e38182.
[23]BAE J S, YOO R E, CHOI S H, et al. Evaluation of lymphedema in upper extremities by MR lymphangiography:Comparison with lymphoscintigraphy[J]. Magnetic Resonance Imaging, 2018,49:63-70.
[24]BUNDRED N J, STOCKTON C, KEELEY V, et al. Comparison of multi-frequency bioimpedance with perometry for the early detection and intervention of lymphoedema after axillary node clearance for breast cancer[J]. Breast Cancer Research and Treatment, 2015,151(1):121-129.
[25]FU M R, CLELAND C M, GUTH A A, et al. L-dex ratio in detecting breast cancer-related lymphedema: reliability, sensitivity, and specificity[J]. Lymphology, 2013,46:85-96.
[26]BARRIO A V, EATON A, FRAZIER T G. A prospective validation study of bioimpedance with volume displacement in early-stage breast cancer patients at risk for lymphedema[J]. Annals of Surgical Oncology, 2015,22(S3):S370-S375.
[27]SORAN A, OZMEN T, MCGUIRE K P, et al. The importance of detection of subclinical lymphedema for the prevention of breast cancer-related clinical lymphedema after axillary lymph node dissection; a prospective observational study[J]. Lymphatic Research and Biology, 2014,12(4):289-294.
[28]CZERNIEC S A, WARD L C, KILBREATH S L. Assessment of breast cancer-related lymphedema: a comparison of moisture meter and spot bioimpedance measurement[J]. Lymphatic Research and Biology, 2015,13(1):10-19.
[29]CACCHIO A, PRENCIPE R, BERTONE M, et al. Effectiveness and safety of a product containing diosmin, coumarin, and arbutin (Linfadren) in addition to complex decongestive therapy on management of breast cancer-related lymphedema[J]. Supportive Care in Cancer, 2019,27(4):1471-1480.
[30]HUANG T W, SENG S H, LIN C C, et al. Effects of manual lymphatic drainage on breast cancer-related lymphedema: a systematic review and meta-analysis of randomized controlled trials[J]. World Journal of Surgical Oncology, 2013,11(1):15.
[31]EZZO J, MANHEIMER E, MCNEELY M L, et al. Manual lymphatic drainage for lymphedema following breast cancer treatment[J]. Cochrane Database of Systematic Reviews, 2015:CD003475. doi:10.1002/14651858.cd003475.
[32]HAYES S, CORNISH B, NEWMAN B. Comparison of me-thods to diagnose lymphoedema among breast cancer survivors:6-month follow-up[J]. Breast Cancer Research and Treatment, 2005,89(3):221-226.
[33]AHMED R L, THOMAS W, YEE D, et al. Randomized controlled trial of weight training and lymphedema in breast can-cer survivors[J]. Journal of Clinical Oncology, 2006,24(18):2765-2772.
[34]KETTERER C. Surgical options for lymphedema following breast cancer treatment[J]. Plastic Surgical Nursing, 2014,34(2):82-85.
[35]WINTERS H, TIELEMANS H J P, VERHULST A C, et al. The long-term patency of lymphaticovenular anastomosis in breast cancer-related lymphedema[J]. Annals of Plastic Surgery, 2019,82(2):196-200.
[36]BOCCARDO F, CASABONA F, DECIAN F, et al. Lympha-tic Microsurgical Preventing Healing Approach (LYMPHA) for primary surgical prevention of breast cancer-related lymphedema: over 4 years follow-up[J]. Microsurgery, 2014,34(6):421-424.
[37]KHAN A A, HERNAN I, ADAMTHWAITE J A, et al. Feasibility study of combined dynamic imaging and lymphaticovenous anastomosis surgery for breast cancer-related lym-phoedema[J]. British Journal of Surgery, 2019,106(1):100-110.
[38]LIU H L, PANG S Y, LEE C C. Donor limb assessment after vascularized groin lymph node transfer for the treatment of breast cancer-related lymphedema: clinical and lymphoscintigraphy findings[J]. Journal of Plastic, Reconstructive & Aesthetic Surgery, 2019,72(2):216-224.
[39]ALITALO K. The lymphatic vasculature in disease[J]. Nature Medicine, 2011,17(11):1371-1380.
[40]KRIEDERMAN B M, MYLOYDE T L, WITTE M H, et al. FOXC2 haploinsufficient mice are a model for human autosomal dominant lymphedema-distichiasis syndrome[J]. Hum Mol Genet, 2003,12:1179-1185.
[41]LHTEENVUO M, HONKONEN K, TERVALA T, et al. Growth factor therapy and autologous lymph node transfer in lymphedema[J]. Circulation, 2011,123(6):613-620.
[42]TOYSERKANI N M, CHRISTENSEN M L, SHEIKH S P, et al. Stem cells show promising results for lymphoedema treatment-a literature review[J]. Journal of Plastic Surgery and Hand Surgery, 2015,49(2):65-71.
[43]TOYSERKANI N M, JENSEN C H, ANDERSEN D C, et al. Treatment of breast cancer-related lymphedema with adipose-derived regenerative cells and fat grafts: a feasibility and safety study[J]. Stem Cells Translational Medicine, 2017,6(8):1666-1672.
[44]TOYSERKANI N M, JENSEN C H, TABATABAEIFAR S, et al. Adipose-derived regenerative cells and fat grafting for treating breast cancer-related lymphedema: lymphoscintigraphic evaluation with 1 year of follow-up[J]. Journal of Plastic, Reconstructive & Aesthetic Surgery, 2019,72(1):71-77.
(本文編辑 马伟平)
[收稿日期]2019-06-12; [修订日期]2020-05-06
[基金项目]山东省医药卫生科技发展计划项目(2016WSB-26051)
[第一作者]郑圣齐(1980-),男,主治医师。
[通信作者]宋玉华(1971-),女,博士,副主任医师,硕士生导师。E-mail:qdsongyh@126.com。

