纳米银对河口潮滩硝酸盐异化还原成铵过程的影响
张梦霞 郑艳玲 尹国宇 董宏坡 韩平 高娟 刘程 常永凯 刘敏 侯立军


摘要:人类活动会导致纳米银(AgNPs)毒性污染物在河口海岸环境富集,但AgNPs赋存和累积对河口氮转化过程的影响尚不清楚,为此,以长江口作为研究区域,对不同粒径(10nm、30nm和100nm)及不同浓度(0.1mg/L、5mg/L和10mg/L)的AgNPs进行暴露实验,探究AgNPs对河口潮滩硝酸盐异化还原成铵(DNRA)的影响,结果表明,添加AgNPs对不同盐度沉积物DNRA速率均产生一定程度的抑制效应,但其抑制率并没有随时间增长而明显增大,受沉积物理化性质的影响,AgNPs对中盐度(8.0%)沉积物DNRA速率抑制效应总体上高于其余盐度沉积物,沉积物环境中AgNPs的粒径及浓度均是影响其毒性的重要因素:当浓度不超过5mg/L时,10nm粒径AgNPs毒性大于30nm和100nm粒径,其在不同盐度沉积物中抑制率最高达16.03%、20.27%和15.36%;但当AgNPs浓度为10mg/L时,30nm和100nm粒径的AgNPs对DNRA速率抑制程度明显增大,毒性效应大于10nm粒径AgNPs,不同盐度沉积物中最大抑制率分别为17.48%、33.18%和26.45%,AgNPs释放的Ag+浓度与DNRA速率的抑制率未存在显著的正相关关系(p>0.05),反映AgNPs释放的Ag+对DNRA存在一定的抑制作用,但并不能完全解释AgNPs的毒性作用特征,研究結果对于客观评价金属纳米材料对河口氮循环的潜在影响具有重要科学意义。
关键词:纳米银:硝酸盐异化还原为铵;粒径;盐度:长江口
中图分类号:X171.1文献标志码:A DOI:10.3969/j,issn,1000-5641.201941005
0引言
氮素是河口生态系统重要的生源要素之一,近年来,随着工农业活动的发展,大量活性氮(硝酸盐为主)的输入增加了河口地区氮负荷,造成诸如有害藻类赤潮暴发和季节性低氧区等一系列生态环境问题,氮素迁移转化过程研究已然成为当今国际河口海岸科学研究领域内的热点问题,硝酸盐异化还原成铵(DNRA)主要指厌氧微生物将硝态氮异化还原为铵盐的过程,在调控河口湿地氮的归宿中扮演重要作用,因此,关于河口湿地DNRA过程的研究引起了国内外学者的广泛关注。
纳米银(AgNPs)是指粒径在1~100nm之间的单质银粒子,由于良好的光电、催化、超导性能和杀菌消毒活性,AgNPs被广泛应用于众多领域和消费产品中,全世界含有AgNPs的商品种类超过400种,目前,全球每年AgNPs的产量大约为500t,预测至2020年AgNPs的年产量将达到1216t,AgNPs的大量使用使其不断进入环境中并产生累积,在有氧条件下,AgNPs极易被氧化并释放出Ag+,而Ag是具有高毒性的重金属之一,会对环境生态系统构成潜在威胁,有学者研究发现,AgNPs(10mg/L)进入序批式活性污泥(sBR)水处理系统后,其抗菌性会抑制活性污泥中微生物生长,影响脱氮和除磷相关的微生物群落结构,削弱系统脱氮除磷效果,Liang等在污水处理系统中连续12h通人AgNPs(1mg/L),发现系统中氨氮和亚硝酸盐不断积累,并抑制了氨氧化菌、亚硝酸盐氧化菌和硝化菌属的数量,且抑制作用持续时间长达1个月以上,张汝嘉等采用浓度0.12~4.82mg/LAgNPs悬浊溶液也证实了其对氨氧化细菌有显著的抑制作用,此外,许多研究还关注了AgNPs粒径与毒性效应的关系,并指出不同粒径AgNPs对硝化细菌的影响有所不同,AgNPs毒性对不同盐度的响应也有所差异,当AgNPs进入复杂的河口沉积物环境中,耦合多变的理化性质会影响其毒性作用,目前,关于环境中AgNPs毒理效应和致毒机制研究还处于探索阶段,而且AgNPs对氮循环过程影响的研究大多集中于硝化和反硝化过程及相关的微生物活性,对DNRA过程的影响还鲜见报道,
AgNPs大规模商业化应用创造了大量经济效益的同时,也通过各种途径进入了环境中,其安全性受到国内外众多学者的广泛关注,河口潮滩湿地是海陆交互的重要过渡地带,也是全球氮库的重要组成部分,此外,河口地区又是人类活动高度密集的地区之一,人类活动对河口地区的生态环境造成很大影响,其中,长江口位于中国经济最发达,人口密度最大的区域,氮负荷增强给长江口及近岸生态系统带来巨大的影响,因此研究AgNPs对长江口DNRA过程的影响也就显得尤为重要,基于此,以长江口为研究区域,分别选取3个不同盐度湿地沉积物为研究对象,探讨不同粒径及浓度的AgNPs对DNRA过程的影响,以期为评价金属纳米材料对河口氮循环的潜在影响提供科学借鉴,
1材料与方法
1.1样品采集及实验室预处理
以长江口为研究区域,沿盐度梯度,选取浏河口(LHK,盐度为0.2%0),东海农场(DHNC,盐度为8.0%0)和金山(Js,盐度为20%0)为采样点(见图1),于2017年7月,分别在3个采样点采集深约10cm,直径为7cm的沉积物柱状样,并现场测定站位潮水盐度,样品采集完后于4℃培养箱保存并在2h内运回实验室,在实验室内,将沉积物柱状样置于培养箱内,使用蠕动泵持续通人含不同粒径AgNPs的人工海水(盐度与各采样点潮水相同,含接近环境背景的硝态氮和铵态氮,约为:NaN0380umol/L,NH4CI30umol/L和KH2PO46umol/L),AgNPs浓度设置为0mg/L、0.1mg/L、5mg/L和10mg/L的浓度梯度,各样点均分为10个处理组,包括空白组(0mg/L AgNPs),10nm粒径组(分别为0.1mg/L、5mg/L和10mg/L AgNPs),30nm粒径组(分别为0.1mg/L、5mg/L和10mg/LAgNPs)和100nm粒径组(分别为0.1mg/L、5mg/L和10mg/L AgNPs),每个处理组设置3个重复,3种粒径AgNPs均购自苏州冷石纳米材料科技有限公司,全程实验温度控制在20℃,培养30d,并且分别在实验的第1、6、10、15和30天采集表层沉积物样品,用于分析潜在的DNRA速率,并测定沉积物理化性质和AgNPs释放的Ag+浓度。
1.2潜在DNRA速率的测定
基于泥浆培养和同位素示踪技术测定沉积物潜在DNRA速率,首先将沉积物样品和相应盐度的人工海水按照1:7的比例充分搅拌成均质泥浆,通人氦气曝气30min,以排净泥浆中的氧气,将曝气后的泥浆转移至一系列12mL顶空瓶中,进行24h预培养以消耗背景硝态氮(N03)和亚硝态氮(N02-),预培养结束后,向每个顶空瓶中加入15N03-,震荡均匀,然后将所有的顶空瓶分为2组,一组作为起始样品加入200ul饱和ZnCl2溶液抑制剂,另一组设置为终止样,继续震荡培养8h后加入抑制剂,随后,利用次溴酸氧化与膜人口质谱仪(MIMS)联用技术测定DNRA过程中15NH4+的产生量,并依据以下公式计算潜在DNRA速率:
1.3理化参数分析
沉积物铵盐(NH4+)、亚硝酸盐(NO2-)和硝酸盐(NO3-)用2mol·L-3KCI浸提后,利用Skalar营养盐自动分析仪(sAN plus)分析测定,硫化物的测定是先将沉积物加入1mol·L-1HCl酸化,酸化后沉积物中硫化物转化为硫化氢气体,将产生的硫化氢气体收集通入到显色溶液对氨基二甲基苯胺中,显色后利用分光光度计测定,沉积物中有机质含量采用重铬酸钾法进行测量,沉积物粒度采用Ls 13320粒度仪进行测定,沉积物含水率采用烘干法测定,Ag+浓度的测定,是将表层沉积物孔隙水加入Amicon Ultra-15超滤管(3kDa,Millipore)中在14000r/min下离心40min,滤出液经2%硝酸酸化后用ICP-MS(Agilent 7700inductively coupled plasma mass spectrometer)进行检测,以上所有理化因子的测定均设置3个平行,取平均值作为最终测定结果,
1.4统计分析方法
测定结果与环境因素的相关性分析及实验数据的多因素方差分析用SPSS 18.0统计软件完成,显著水平设定为p<0.05.文中插图用Origin 9.0制作。
2结果与分析
2.1Ag+浓度的变化
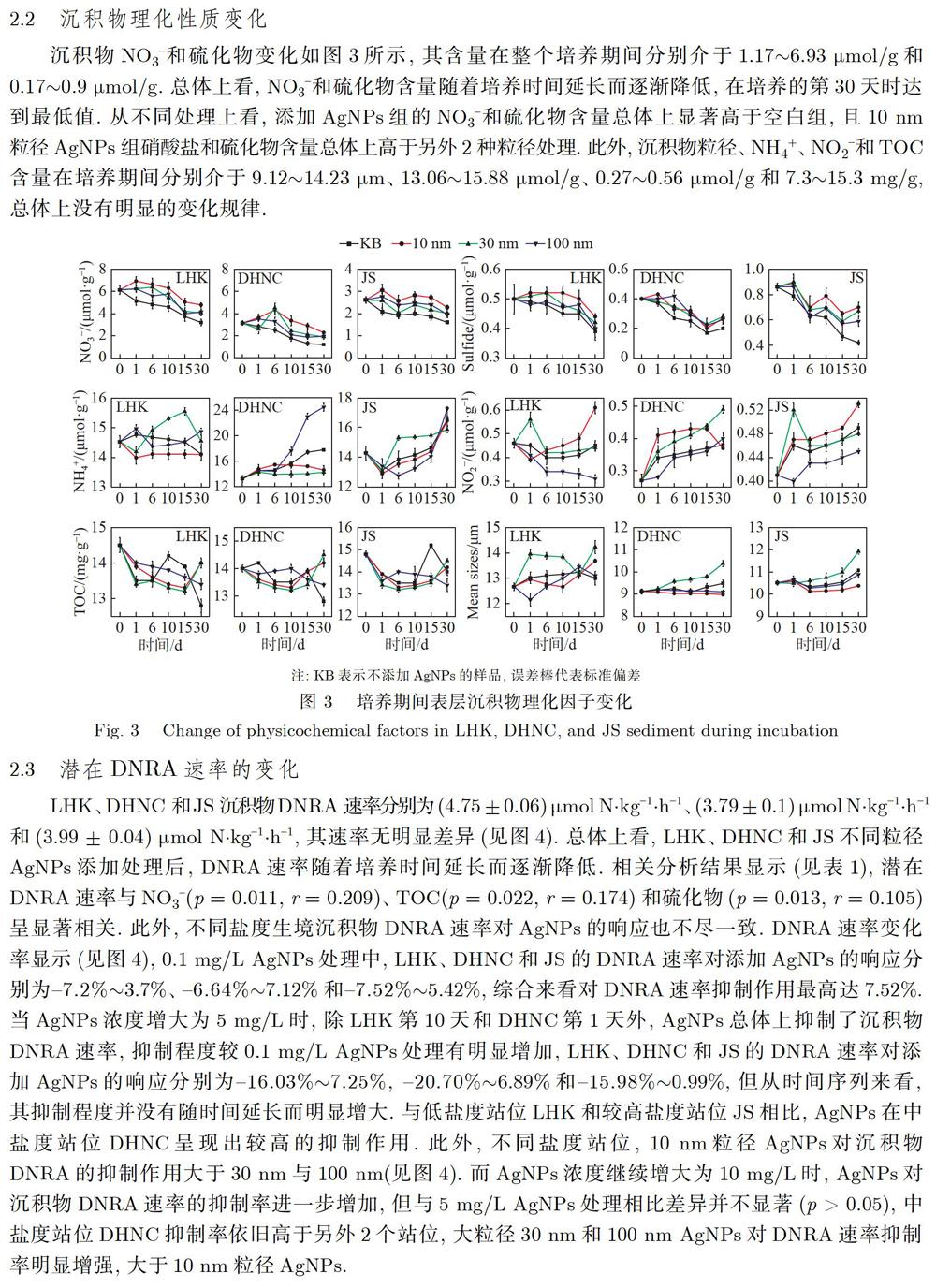
为期30d培养,LHK、DHNC和Js不同粒径AgNPs处理中Ag+释放浓度分别介于0.91~40ug/L、10~150ug/L和10~390ug/L(见图2),其中,低盐度样点LHK的Ag+释放浓度总体上低于中盐度样点DHNC和高盐度样点Js,此外,在培养初期(第1天),各站点10am相较于30am和100am呈现出更多的Ag释放,但随着培养时间延长,其Ag+释放浓度总体上无显著增加,而30am和100am的Ag+释放浓度随着培养时间延长而增加,释放总量更大,且在DHNC和Js表現较为明显(见图2)。
多因素方差分析结果显示(见表2),沉积物盐度、AgNPs粒径、AgNPs浓度的交互作用对DNRA速率变化率影响不显著,而AgNPs粒径、AgNPs浓度交互作用对DNRA速率变化率具有显著影响,高浓度(10mg/L和5mg/L)AgNPs处理组的DNRA抑制率显著高于低浓度(0.1mg/L)AgNPs处理组(分别介于-33.18%~0.05%、-20.71%~7.25%、-7.52%~7.12%),浓度≤5mg/L时,10nmAgNPs处理组的DNRA抑制率显著高于30BE和100nm AgNPs处理组(p<0.05),其在LHK、DHNC和Js不同盐度站位沉积物中最大抑制率分别为16.03%、20.27%和15.36%,而AgNPs浓度为10mg/L时,大粒径(30BE和100BE)AgNPs对DNRA速率抑制率更高,不同盐度站位沉积物中抑制率最高达17.48%、33.18%和26.45%,说明相同盐度条件下,AgNPs毒性取决于其粒径大小和浓度,此外,AgNPs浓度与沉积物盐度的交互作用对DNRA速率变化率也具有显著影响,不同盐度站位沉积物对添加AgNPs的响应分别介于-17.48%~7.25%、-33.18%~6.89%和-26.45%~0.99%,且不同浓度AgNPs均在中盐度站位DHNC具有较大的DNRA速率抑制率。
3讨论
本研究探讨了不同粒径及不同浓度AgNPs添加对河口沉积物DNRA过程的影响,研究发现,AgNPs处理下3个不同盐度站位DNRA速率均受到不同程度的抑制(见图4),已有大量研究证实了AgNPs对硝化及反硝化过程的毒性作用,1mg/L的AgNPs可以导致硝化细菌数量减少,削减60%的硝化速率,Choi和Hu研究表明,1mg/L的AgNPs对实验室富集培养硝化细菌的硝化抑制率达到70%,且其EC50(引起50%硝化抑制率的AgNPs浓度)为0.14mg/L,较低的AgNPs浓度(小于1mg/L)即可以抑制反硝化模式菌株施氏假单胞菌50%的生物活性12引,但近期有研究发现,在土壤环境中AgNPs毒性会显著降低,Liu等采用不同浓度和种类的AgNPs溶液探究其对太湖沉积物中反硝化微生物的影响,实验结果显示,1mg/L的AgNPs在8h培养周期内对太湖沉积物反硝化过程没有显著影响,另外,VandeVoort等研究中也出现类似结果,分析认为产生这种现象的原因可能是AgNPs进入土壤环境中后,通过和环境中无机阴离子(例如C1等)以及其他常见配体的络合,导致AgNPs及其释放的Ag+的生物可利用度降低,毒性降低,目前,关于AgNPs对DNRA过程的影响还鲜有报道,关于低浓度长期暴露条件下AgNPs对河口沉积物DNRA速率影响情况所知甚少,本研究结果表明,30d实验周期内0.1mg/L的AgNPs对河口沉积物DNRA速率抑制作用最高达7.52%,而5mg/L的AgNPs即可对沉积物DNRA过程产生明显抑制效应,最大抑制率为20.27%(产生于中盐度沉积物10nm粒径AgNPs),一定程度上说明长期暴露下环境中不断累积的AgNPs会带来潜在生态风险,此外,Chen等研究发现,0.5mg/L AgNPs显著影响了活性污泥中反硝化功能微生物群落结构,10mg/L AgNPs使得nirK型及nosZ型反硝化微生物群落组成中副球菌(Paracoccu8)的相对丰度明显降低,白洁等探究了不同浓度AgNPs对河口区沉积物反硝化酶活性及功能基因丰度的影响,结果表明AgNPs对沉积物中还原酶活性及功能基因narG和nirS的基因丰度均具有浓度抑制效应,且AgNPs主要是通过对narG基因丰度的抑制来实现对N03还原过程的影响,而对N02还原酶的抑制程度则明显大于nirS基因丰度,以此抑制NO2还原过程,鉴于近年来纳米材料的广泛使用,AgNPs潜在的环境危害不容忽视,仍需要在生态系统,群落,以及基因蛋白等不同层次上探讨AgNPs对河口区氮循环微生物的影响和毒性作用机制。
然而,在培养初期还发现AgNPs添加对DNRA过程产生了一定的促进作用,这可能与AgNPs的毒物兴奋效应有关,一定浓度范围内的AgNPs可能会刺激微生物的生长,加快DNRA反应速率,有研究指出,低剂量的AgNPs可提高大肠杆菌活性,其他纳米材料(如ZnO和Ti02)的亚致死水平也会产生刺激作用,但这种刺激是否可以通过加快微生物呼吸速率并获得更多能量,以有效地修复损伤和应对AgNPs所带来的胁迫,这仍有待确定。
根据AgNPs释放的Ag+浓度变化规律(见图2)可知,随着盐度的增加,释放的Ag+浓度总体上也趋于增加,这可能是因为环境配体包括C1、S2等可以与AgNPs释放的Ag+反应,使得AgNPs释放Ag+速率随着CI/Ag的增加而增大,一般认为AgNPs的毒性与其释放的Ag+浓度有很大关系,释放的Ag+可以产生活性氧(ROS)、破坏细胞膜完整性、与细胞内含硫蛋白结合、引起DNA损伤和功能蛋白质失活等,AgNPs在较高盐度站位Js释放的Ag+浓度相对较高,根据前人研究结果,AgNPs对Js的DNRA速率的抑制率应该最为显著,然而,本研究实验结果发现,尽管沉积物盐度对DNRA速率变化率影响不显著(p>0.05.见表2),但相比较于LHK和Js站位,AgNPs对中盐度站位DHNC的DNRA速率抑制率总体相对较高(见图4),这种现象可能与Js和DHNC站位不同理化性质的差异有关,有学者研究指出在硫化物(h2s、s2-)或单质s的氧化驱动下,通过无机化能自养硫细菌氧化,将NO3还原为NH4+,可以进行化能自养型的DNRA过程,本研究中,Js站位硫化物含量显著高于DHNC站位,且随培养时间延长而不断降低,这表明在培养过程中硫化物被不断消耗,可能与自养硫细菌消耗硫化物耦合进行DNRA过程有关,因此在Js站位相对富硫的环境中,充足的硫化物使得自养硫细菌更易于抵抗AgNPs的毒性,DNRA速率与硫化物显著相关关系(p=0.013.r=0.105)也证实了这一结果(见表1),研究表明AgNPs硫化也会使其毒性降低,另外,Beddow等实验中发现AgNPs在较高盐度下Zeta电位值明显小于低盐度,在高盐度中AgNPs更容易团聚,团聚后AgNPs毒性明显降低,这也进一步导致Js站位沉积物DNRA速率受AgNPs毒性抑制作用的降低,
本研究还发现,AgNPs粒径对DNRA速率变化率具有显著影响(p<0.05.见表2),AgNPs浓度≤5mg/L时,与30am和100am相比较,10am粒径AgNPs对不同盐度站位沉积物DNRA速率均表现出相对较高的抑制率(见图4),与大粒径相比,小粒径AgNPs更容易穿透生物膜进入细胞内,直接攻击DNA、蛋白质或酶,其较大的比表面积生成更多的活性氧(ROS),更容易导致细胞损伤,纳米级粒径的量子尺寸效应占主导地位,这可能是导致出现这一结果的重要原因,然而,当AgNPs浓度为10mg/L时,30nm和100nm粒径的AgNPs对DNRA速率抑制率显著增大,这与大粒径AgNPs释放的Ag+浓度明显高于10nm粒径AgNPs有关,AgNPs释放的Ag+毒性作用优于其粒径效应,且随AgNPs浓度增加,小粒径AgNPs团聚更严重其粒径的优势被削弱,对DNRA速率抑制程度降低,目前关于AgNPs粒径与其毒性作用的研究还未有统一的结论,尽管大多数的研究表明AgNPs毒性与其粒径成反比关系,但仍有部分研究认为金属纳米颗粒的毒性与其尺寸没有依赖关系,且不同环境及微生物菌群也会影响AgNPs粒径毒性。
本研究中未发现AgNPs释放的Ag+浓度和DNRA速率抑制率间存在显著相关关系(p>0.05),且10mg/L AgNPs处理与5mg/L处理对DNRA速率抑制程度的差异并不显著(p>0.05),表明沉积物环境中AgNPs毒性不能仅仅归因于Ag+毒性,更可能受释放的Ag+毒性、纳米粒子效应和环境理化因子的综合影响,自然环境中,影响AgNPs毒性效应和环境行为的因素和过程极其复杂,且AgNPs進入环境后会通过多种途径改变其存在形态,而河口复杂的沉积物环境加大了AgNPs毒理辨别的复杂性,后续工作可进一步探究AgNPs对DNRA过程功能基因及菌群结构的影响,以明晰AgNPs对DNRA过程的微生物影响机制。
4结论
(1)AgNPs对不同盐度沉积物DNRA速率均产生抑制作用,但其抑制程度并未随时间延长而明显增大,AgNPs对沉积物DNRA速率的抑制作用并不仅仅取决于其释放的Ag+毒性作用。
(2)不同盐度条件下AgNPs对DNRA速率的影响结果表明,AgNPs对中盐度(8.0‰)站位沉积物产生的抑制率相对较高。
(3)沉积物环境中,AgNPs粒径、浓度均是影响其毒性的重要因素,相同盐度下,AgNPs浓度≤5mg/L时,小粒径AgNPs(10nm)比30nm和100nm粒径具有更强的毒性,纳米粒子效应占主导地位,而当AgNPs浓度为10mg/L时,30nm和100nm粒径的AgNPs对DNRA速率抑制率显著增大,AgNPs释放的Ag+毒性作用优于其粒径效应。

