无症状颈动脉粥样硬化斑块内出血与冠状动脉支架植入手术后脑梗塞和死亡的分析
李万春, 高岩升
据报道,6%~21%的心血管外科患者(如冠心病、瓣膜病和主动脉瘤)存在颈动脉狭窄[1,2]。无症状颈动脉狭窄(ACS)患者的年卒中风险为0.6%~1.3%,而伴有ACS的患者围手术期卒中风险增加1.5%~9.0%[3,4]。但与ACS相关的脑梗塞的风险是否增加还存在争议,如一些报告指出脑梗塞与颈动脉狭窄的严重程度没有相关性[5,6]。与颈动脉狭窄相关的斑块内出血(intraplaque hemorrhage,IPH)被认为是继发性脑梗塞的危险因素[7,8],先前的研究表明,超过50%的ACS与同侧脑梗塞的高发病率相关[9]。本研究的目的是研究冠状动脉支架植入术的术前检查中发现的ACS患者发生脑梗塞和死亡的风险。
1 材料与方法
1.1 研究对象
选择2012年3月至2015年8月间实施冠状动脉支架植入手术的患者。所有患者术前均接受常规颈动脉超声检查,在短轴二维超声图像对狭窄区域的评价中,颈动脉面积狭窄达50%或以上的心脏病患者被纳入研究系列。所有患者在术前均接受颈部斑块的MRI检查。患者的基线资料见表1。
1.2 IPH征象的MRI检查
采用1.5T磁共振扫描。以颈动脉分叉为中心,扫描范围为颈动脉分叉上下3 cm。颈动脉斑块信号高低评价均以同侧胸锁乳突肌为参照,扫描序列及主要扫描参数如下。常规序列:3D⁃TOF(TR 20 ms,TE 6.5 ms,层数48)、T2 WI(TR 4800 ms,TE 50 ms,层数 16)、T1 WI(TR 800 ms,TE 10 ms,层数16)、PDWI(TR 4800 ms,TE 10 ms,层数16);3D⁃MPRAGE序列(TR 8.8 ms,TE 5.3 ms,层数48);DWI序列(TR 2500 ms,TE 46 ms,16层);体素1.5 mm×1.5 mm,矩阵为250×192。横截面TOF⁃MRA上的斑块内高强度信号被认为是IPH的征象。
1.3 数据收集方法、程序与条件
①首先通过病案室临床病例收集纳入研究系列患者:颈动脉面积狭窄达50%或以上和实施冠状动脉支架植入术;②记录门诊复查和住院登记关于患者就诊和再入院的临床资料;③患者电话联系;④记录随诊过程中颈动脉超声和核磁共振检查结果;⑤术后新发神经功能缺损,则诊断为脑梗塞,并经神经科医师及相关检查确诊;⑥仅发生在颈动脉狭窄侧的脑梗塞被确定为同侧脑梗塞;⑦死亡定义为任何原因;⑧收集资料截止时期为2019年11月1日。
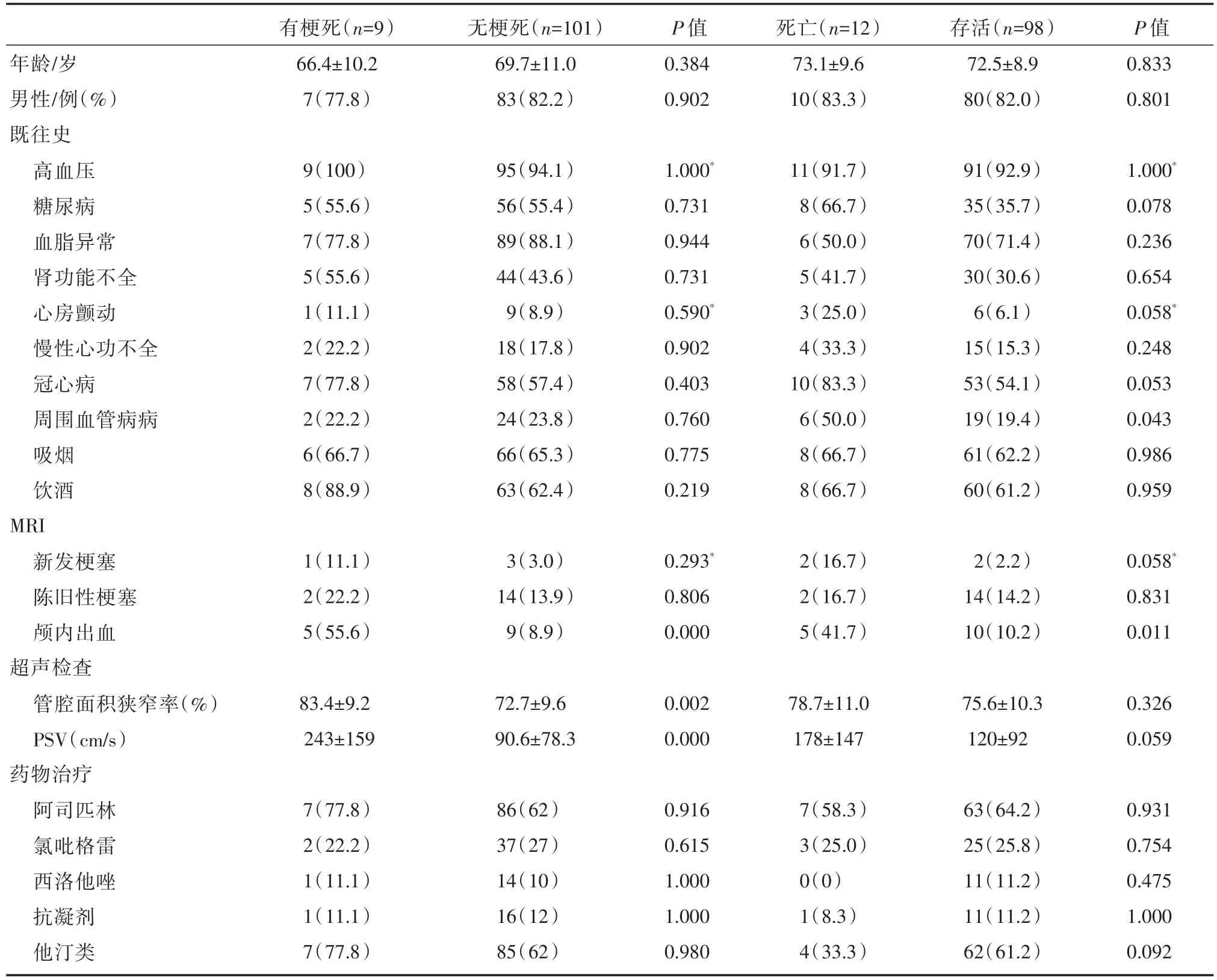
表1 同侧脑梗塞和死亡患者的基线特征
1.3 统计学分析
所有分析均采用SPSS 23.0统计软件进行分析。计量数据采用均数±标准差表示,分类变量采用检验或Fisher精确检验,连续变量采用Mann⁃WhitneyU检验。单因素分析以确定与术后脑梗塞和死亡率相关的因素。采用Kaplan⁃Meier方法和Cox比例风险模型分析晚期存活率。P值<0.05被认为具有统计学意义。
2 结果
表1总结了患者的临床特征。共收集到资料比较完整的病例110例,包括84例男性和26例女性,其中包括16患者IPH患者。随访时间3年。术后发生同侧缺血性脑卒中10例(9.1%,表2)。5个病人(4.5%)在手术后30天内发生脑梗塞。6个病人(5.4%)术后随访心血管手术后同侧脑梗塞。共12例患者(10.9%)在随访期间死亡,死因是与心脏相关的疾病。
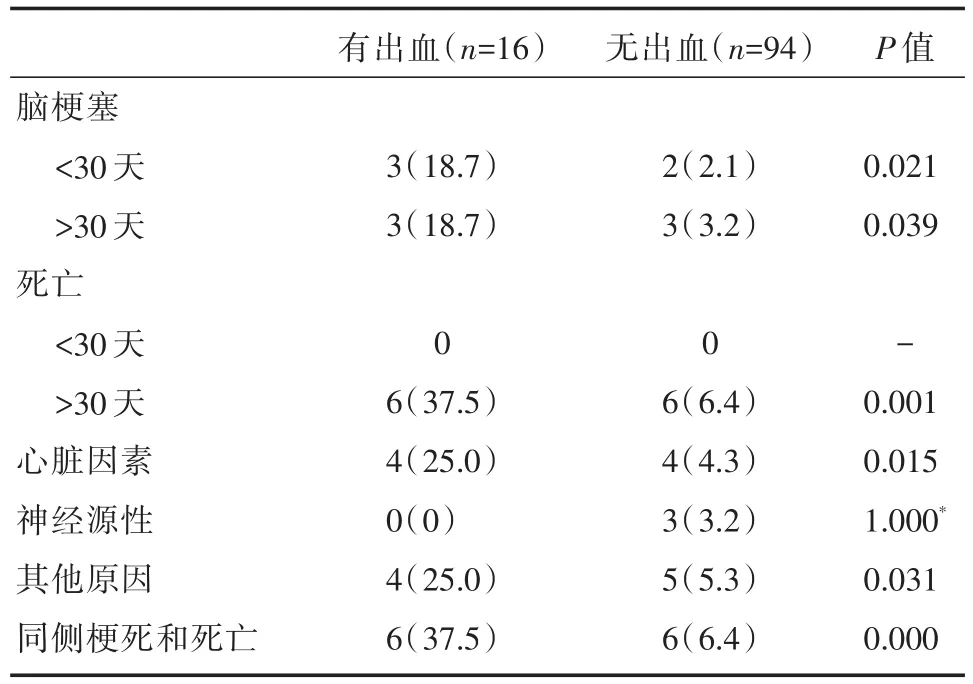
表2 斑块内出血临床结果
在对同侧脑梗塞的单变量分析中,IPH、面积狭窄和PSV与随后的缺血性卒中显著相关(P<0.05;表1),其中IPH和PSV与同侧脑梗塞有显著相关性,HR分别为 21.31(95%CI:5.14~76.08,P<0.001)和1.01(95%CI:1.002~1.013,P=0.011)(表3)。
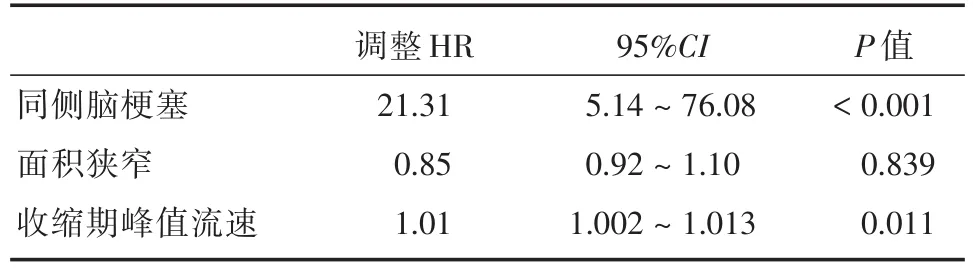
表3 脑梗塞的多因素分析
对于死亡原因,单变量分析显示糖尿病、血脂异常、肾功能不全、房颤、冠状动脉疾病、外周血管疾病、新发脑梗塞、IPH和服用他汀类药物与死亡率相关(P<0.05;表1)。多变量Cox风险分析显示血脂异常(HR=0.256,95%CI:0.049~0.789,P=0.035)、冠心病(HR=3.929,95%CI:1.437~15.445,P=0.009)、外周动脉疾病(HR=2.443,95%CI:1.121~6.386,P=0.039)和IPH(HR=4.262,95%CI:1.481~11.767,P=0.016)与死亡率相关(表4)。
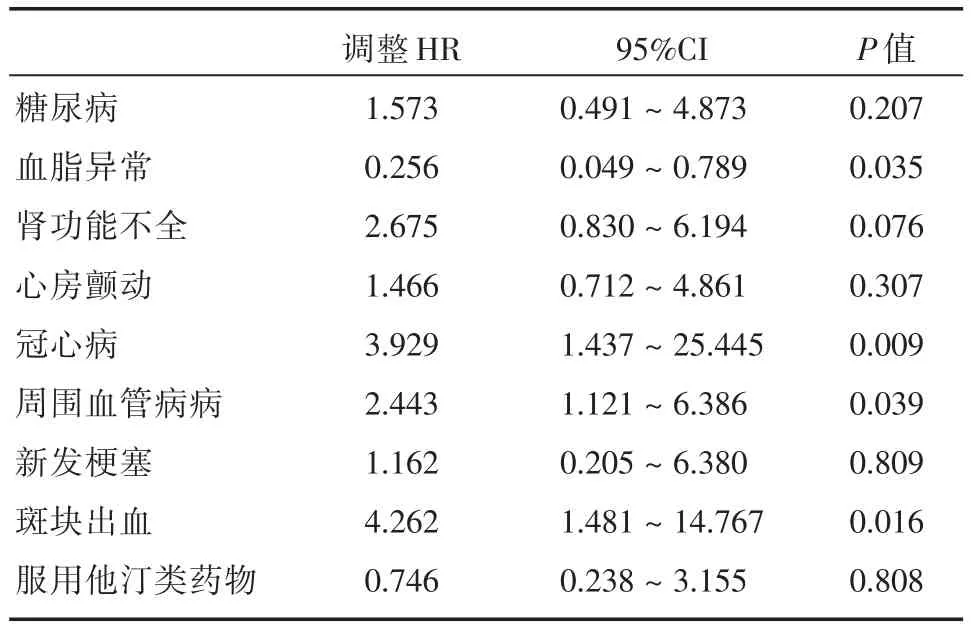
表4 死亡率的多元分析
3 讨论
本文结果显示冠状动脉介入手术患者伴有ACS是脑梗塞和死亡的危险因素。16例IPH患者中有6例(37.5%)发生术后同侧脑梗塞,这是缺血性卒中的危险因素,但有6例(6.4%)死于非脑梗塞。IPH也被认为是死亡率的危险因素,也被认为是症状性颈动脉狭窄的危险因素[10,11]。IPH是由斑块内脆弱和扭曲的新生血管破裂引起的,并导致斑块不稳定和血栓栓塞性卒中,这由经颈动脉内膜切除术(CEA)获得的斑块标本证实。MRI检测出IPH的灵敏度较颈动脉超声和增强CT高,文献报道达到 90%[13,14]。因此 MRI检查颈动脉斑块可作为心血管疾病的常规检查。
在本研究中,冠状动脉介入手术围手术期同侧脑梗塞的发生率为9.1%,略高于文献报道[15]。IPH患者围手术期同侧脑梗塞发生率明显高于非IPH患者(表2)。由于IPH也是同侧脑梗塞的一个危险因素,在发现IPH的患者中,围手术期颈动脉血运重建可能会降低围手术期同侧脑梗塞的风险。然而,冠状动脉搭桥术(CABG)术后发生的卒中是多种因素引起的,所有卒中患者颈动脉狭窄部位的同侧发生率为40%~50%,实施颈动脉血管重建术的效果有限[16]。
IPH伴心血管手术的狭窄颈动脉再血管化的决定必须是个体化的,并基于谨慎的临床判断。在这项研究中,根据多变量分析,除IPH外,其他死亡率的危险因素包括血脂异常、冠状动脉疾病和外周血管疾病,这些因素反映了系统性动脉粥样硬化疾病的进展,这类问题已由相关文献报道[17]。
颈动脉超声中PSV升高被报道为ACS相关的同侧脑梗塞的危险因素[9]。随着PSV的增加,ACS相关的脑梗塞的风险往往升高,这种风险尤其是在峰值收缩速度为150 cm/s或更高时增加[9]。在本研究中,PSV达243 cm/s显著增加了脑梗塞的风险,因此,ACS的严重程度被认为是脑梗塞的危险因素。

