FOS样抗原1在头颈鳞癌中的表达及临床意义
高晓琳,修霞,邱萍萍,张杜合一,谢舒乐,林钊宇
头颈鳞癌(head and neck squamous cell carci⁃noma,HNSC)位于全球最常见恶性肿瘤的第八位,每年新发病例超过55万[1]。HNSC具有局部复发率高,易发生淋巴结转移等特点,临床治疗多采用以手术为主,辅以放化疗或免疫疗法,然而头颈鳞癌患者的5年生存率仍低于50%[2,3]。FOS样抗原1(FOS⁃like antigen 1,FOSL1)是FOS家族蛋白的成员,FOSL1和JunB家族蛋白形成异质二聚体,共同组成肿瘤内重要的转录因子——活化蛋白⁃1(activator protein⁃1,AP⁃1)[4]。目前研究证实FOSL1具有多种功能,如沉默FOSL1抑制了骨肉瘤细胞的增殖、迁移和侵袭;FOSL1抑制了Ⅰ型干扰素对疟疾和病毒感染的反应[5,6]。然而,关于FOSL1蛋白在头颈鳞癌中的表达及其作用的报道尚未发现。本研究通过查询数据库及免疫组化等方法检测FOSL1在头颈鳞癌患者的表达水平,并分析其临床意义。
1 资料与方法
1.1 一般资料
收集中山大学孙逸仙纪念医院口腔颌面外科2010年3月至2014年8月根治性手术切除的头颈鳞癌及其癌旁组织共98例。所有头颈鳞癌患者术前均未接受放疗或化疗等治疗。所有标本用4%多聚甲醛固定和石蜡包埋后制备4μm切片。所有患者均已被告知并签署由本院伦理委员会批准的知情同意书。
1.2 UALCAN数据库分析
通过UALCAN数据库(http://ualcan.path.uab.edu/index.html/)获取FOSL1基因在头颈鳞癌内的表达及预后情况,通过Expression选项中sample type、tumor grade、gender等分类预测FOSL1在HNSC中的表达情况;通过Survival模式,以中位数为cut⁃off,预测FOSL1表达与HNSC患者的生存曲线图。
1.3 免疫组化
二甲苯及梯度酒精常规脱蜡,pH6.0枸橼酸微波修复20 min,自然冷却至室温。3%H2O2避光孵育15 min,滴加FOSL1一抗(Santa Cruz公司,sc⁃28310,1∶500)4℃孵育过夜,PBS漂洗后滴加抗鼠IgG二抗(基因科技公司,GK500710)37℃孵育30 min,PBS漂洗后滴加DAB显色剂,苏木素染核,脱水后树胶封片。光学显微镜下观察结果FOSL1的表达情况。
1.4 免疫组化结果评判
FOSL1的表达主要位于细胞核内,在高倍镜下随机选取5个视野,计算阳性细胞的百分比:0分是阳性细胞数<5%,1分是阳性表达细胞数5%~24%,2分是阳性表达细胞数为25%~49%,3分是阳性表达细胞数为50%~74%,4分是阳性表达细胞数≥75%;同时评判染色深度:0分是不着色,1分是淡黄色,2分是棕黄色,3分是棕褐色。最后两项得分相乘,0~3分的标本判定为低表达,4~12分的标本判断为高表达。
1.5 统计学方法
应用SPSS 20.0统计软件,分析FOSL1蛋白表达与患者临床病理指标之间的关系采用卡方检验。采用Kaplan⁃Meier法进行生存分析,绘制生存曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 UALCAN数据库获取FOSL1在头颈鳞癌中的表达
通过UALCAN数据库,我们基于sample type、tumor grade、HPV status和nodal metastasis status等分类对比了FOSL1在HNSC组织的表达。我们发现FOSL1在头颈鳞癌中的表达显著高于癌旁组织(P=0.039)(图1A)。其次,不同病理分级HNSC中FOSL1的表达均比癌旁组织高,其中Grade 2(intermediate grade)和Grade 4(high grade)HNSC中FOSL1显著升高(P<0.001)。不同病理分级HNSC组织内FOSL1的表达呈显著差异:Grade 1⁃vs⁃Grade 2(P=0.032),Grade 1⁃vs⁃Grade 4(P<0.0001),Grade 2⁃vs⁃Grade 3(P=0.0106),Grade 2⁃vs⁃Grade 4(P<0.0001),Grade 3⁃vs⁃Grade 4(P<0.0001)(图 1B)。HPV阳性HNSC患者(p16&ISH检测)中FOSL1的表达显著低于HPV阴性患者(P<0.001)(图1C)。此外,数据显示与无淋巴结转移的患者(N0)相比,仅有N3组HNSC患者(>10个淋巴结转移)中FOSL1表达显著升高(P=0.0017),而N1组较N3组亦显著升高(P=0.0012)(图1D)。
2.2 免疫组化检测FOSL1蛋白在头颈鳞癌标本中的表达
我们发现FOSL1蛋白主要定位于细胞核内。FOSL1在癌旁组织内的阳性率仅为8.1%(8/98),且FOSL1表达呈弱阳性,而大部分癌旁组织FOSL1表达为阴性。然而FOSL1在头颈鳞癌样本中均有表达,其中54例(55.1%)头颈鳞癌FOSL1呈高表达(强阳性),44例(44.9%)头颈鳞癌FOSL1呈低表达(弱阳性)(图2A~D)。
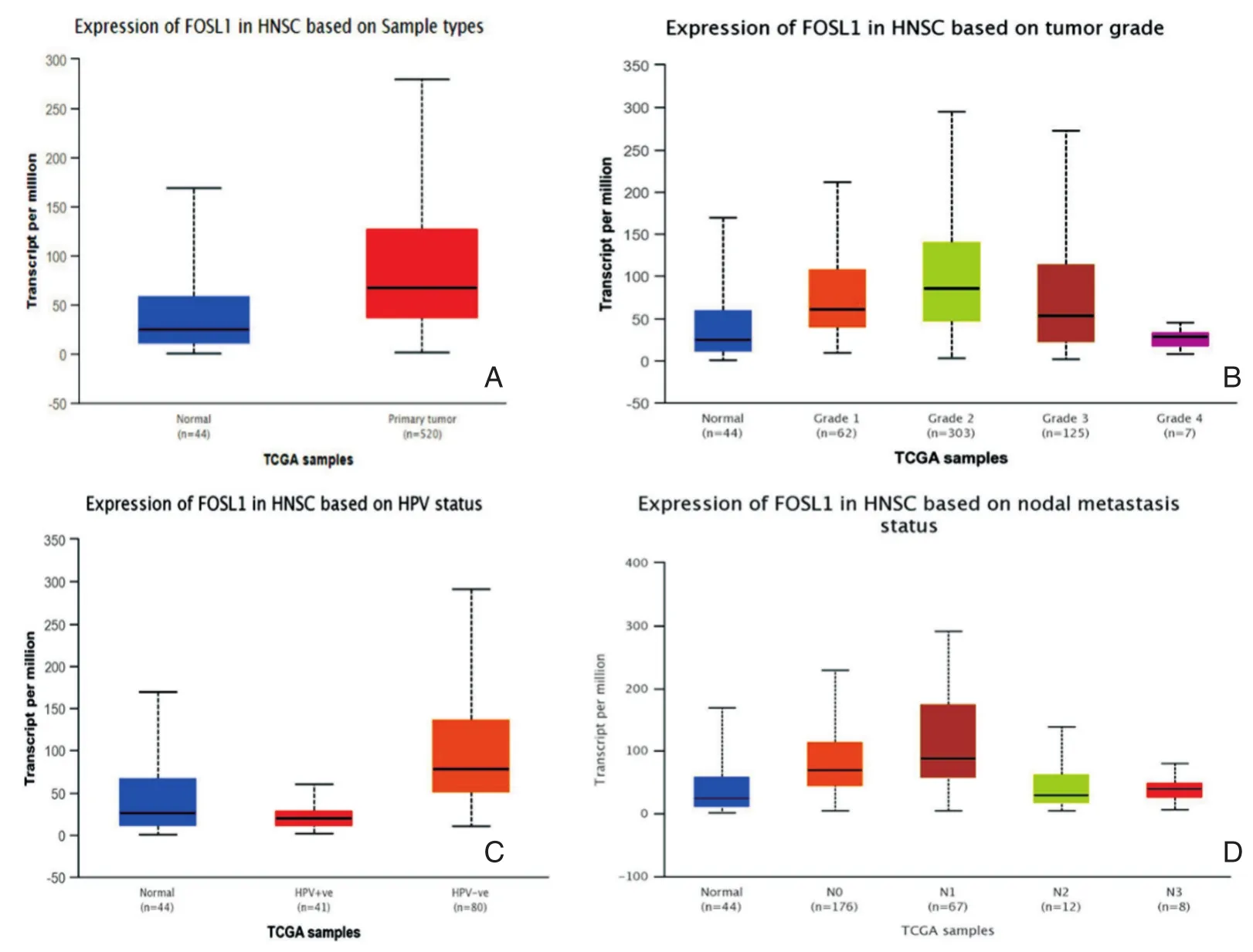
图1 UALCAN数据库检测FOSL1蛋白在HNSC中的表达
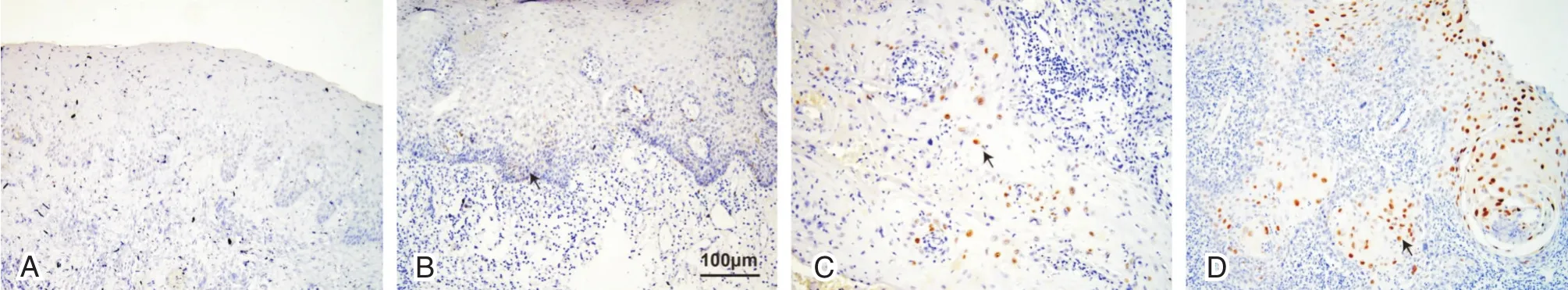
图2 头颈鳞癌及癌旁组织内FOSL1的表达(免疫组化,×200)
2.3 FOSL1的表达与头颈鳞癌患者临床病理指标的关系
FOSL1表达与肿瘤的大小、淋巴结转移、临床分期及病理分化程度显著相关(P<0.05),即高表达FOSL1的头颈鳞癌患者的肿瘤直径更大、分化程度更差、临床分级更高,易发生区域性淋巴结转移。而FOSL1表达水平与患者性别、年龄、远处转移等指标无明显相关性(P>0.05),结果见表1。
2.4 FOSL1 的表达对头颈鳞癌患者预后的影响
UALCAN数据库显示高表达FOSL1的HNSC患者较低表达HNSC预后差,两组之间具有显著差异(P=0.035)(图3A)。此外,我们通过Kaplan⁃Meier法分析FOSL1表达对98例HNSC患者(本院收集)预后的影响。结果发现其中FOSL1低表达组的头颈鳞癌患者中位生存时间为96个月,FOSL1高表达组的头颈鳞癌患者中位生存时间为42个月,差异有统计学意义(P<0.05),见图3B。
3 讨论
目前AP⁃1蛋白被认为调控肿瘤、哮喘和类风湿性关节炎等多种疾病的关键转录因子,它会响应细胞因子、激素和生长因子等各种外界刺激,调控下游基因的表达继而影响细胞的增殖、分化、凋亡等生物学过程[7,8]。AP⁃1是一种由Jun家族蛋白和Fos家族蛋白形成的高度保守的同源或者异源二聚体复合物,其中FOSL1属于FOS蛋白家族的一员,它与Jun家族蛋白形成异源二聚体是众多AP⁃1 复合物中最为稳定的[8,9]。研究表明,AP⁃1主要通过FOSL1调控基质金属蛋白酶家族降解细胞外基质,进而肿瘤的转移和侵袭[7,8]。例如,在人结直肠癌细胞HT⁃29中AP⁃1结合在MMP7的DNA启动子区,促进肠癌的转移和侵袭[10]。此外,FOSL1的调控作用发生在转录和翻译后修饰的水平,而蛋白水平的磷酸化是FOSL1调控翻译后修饰的主要方式[8-10]。FOSL1主要由丝裂原活化蛋白激酶信号途径调控,并被泛素非依赖性蛋白酶体降解[11]。此外,FOSL1可影响肿瘤的增殖、分化、侵袭和凋亡等生物学功能[4-6,11,12]。研究表明,FOSL1在乳腺癌、肺癌、结直肠癌、前列腺癌、鼻咽癌等肿瘤中过表达,而在宫颈癌和卵巢癌中的表达降低,在头颈鳞癌中的表达仍存在争议[11⁃14]。
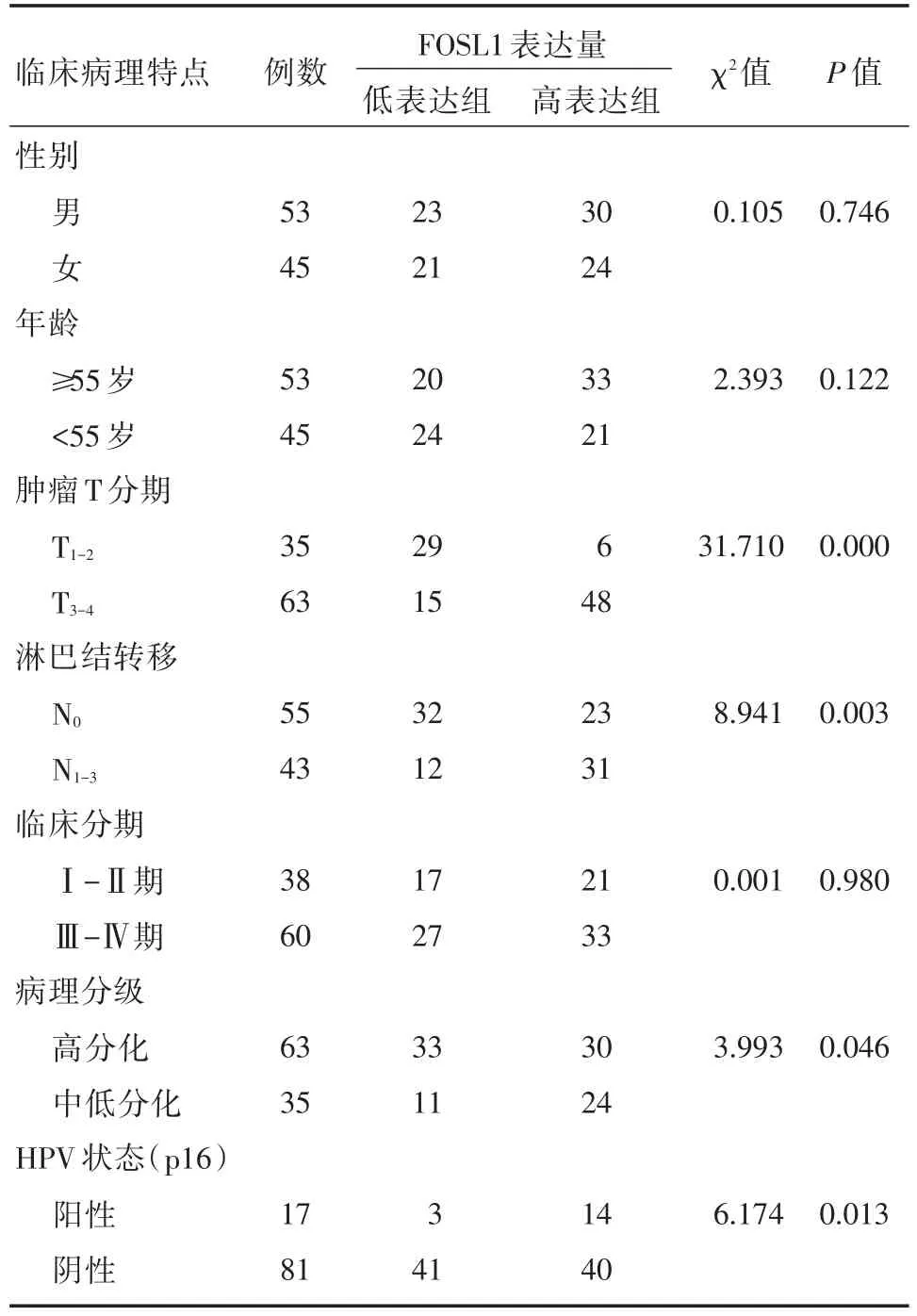
表1 FOSL1蛋白表达与头颈鳞癌临床病理特征的相关性(n)
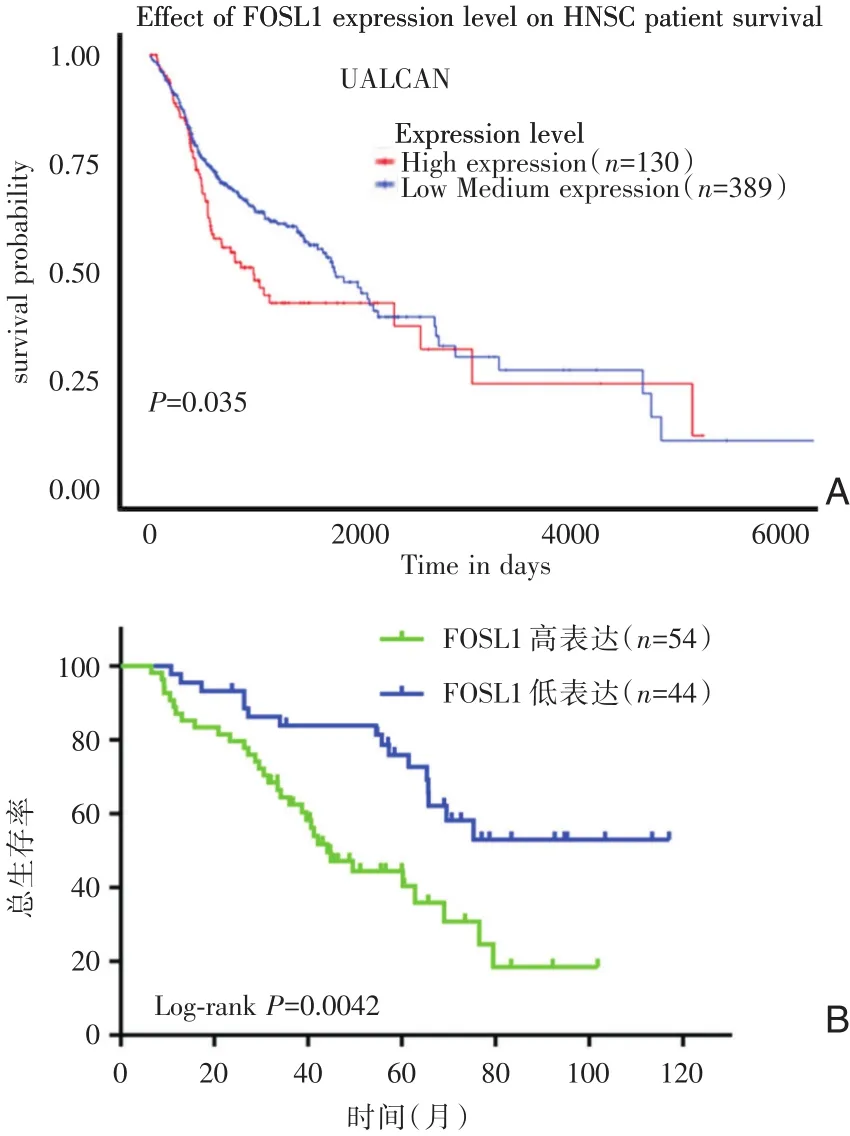
图3 FOSL1的表达与头颈鳞癌患者的预后
目前生物大数据库在细胞生物学的研究中发挥了举足轻重的作用,UALCAN整合了TCGA和MET500来源的数据,用于比较某一基因在特定肿瘤和正常组织、不同病理分类的肿瘤之间和不同类型正常组织内的表达情况,同时还可以基因间的共表达分析、药物敏感性基因筛查等[15]。本实验中我们发现FOSL1在头颈鳞癌中显著高表达,且FOSL1高表达与HNSC患者预后差显著相关(P<0.05)。此外,FOSL1的表达与HNSC患者的病理分级、淋巴结转移和HPV状态密切相关(P<0.05)。
随后我们通过免疫组化验证FOSL1蛋白在头颈鳞癌及癌旁组织中的表达情况。结果发现FOSL1在绝大多数头颈鳞癌中均有表达,且头颈鳞癌组织中FOSL1的表达显著高于癌旁组织。通过卡方检验分析,我们发现FOSL1的表达与肿瘤的大小、淋巴结转移、HPV状态及病理分化程度显著相关(P<0.05)。Kaplan⁃Meier分析表明高表达FOSL1的头颈鳞癌患者生存率明显低于低表达FOSL1的头颈鳞癌患者。以上结果与数据库预测的结果基本一致。本研究显示FOSL1蛋白在头颈鳞癌中显著上调,且与头颈鳞患者临床特征及预后密切相关,提示FOSL1可能在头颈鳞癌的发生发展过程中起到重要作用,它可以作为评估头颈鳞癌患者预后的指标。

