白蛋白/纤维蛋白原比值和抗CCP-Ab联合检测在类风湿关节炎并发间质性肺病中的临床意义
李嘉欣 殷松楼 殷寒秋
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的慢性、全身性自身免疫性疾病,除了可造成疼痛和关节畸形等关节症状外,还会出现许多关节外表现,其中肺部并发症是RA关节外常见的表现之一, 以间质性肺病(interstitial lung disease,ILD)最常见。据Castelino等[1]的研究显示RA患者继发ILD的发生率为20%~30%。RA-ILD的诊断方法主要是依据胸部高分辨CT(HRCT),但对于早期因无明显临床症状、体征而经常被忽略,随着病情的发展晚期可出现肺纤维化,预后极差,可因呼吸衰竭而死亡。因此,RA-ILD的早期诊断对改善预后尤为重要。
C反应蛋白(CRP)、白蛋白(ALB)水平、凝血指标及以中性粒细胞淋巴细胞比率(NLR)为代表的多种复合炎性指标水平可综合反映机体全身性慢性炎症状态。NLR已被认为在多种疾病中可以有效地评估疾病的预后,也可反映系统性风湿性疾病的疾病活动及炎症负担,如多发性肌炎/皮肌炎、系统性硬化症合并ILD等[2]。
文献报道,RA患者的纤维蛋白原(FIB)水平明显升高,ALB水平降低,证明了白蛋白纤维蛋白原比值(AFR)是RA患者疾病活动度的独立预测因子[3]。而AFR与RA患者继发间质性肺病的关系却鲜有报道。本研究将通过分析RA-ILD 组、RA组中的AFR和CCP-Ab水平的不同,以探讨ARF和CCP-Ab联合检测对RA-ILD诊断及病情评估中的意义。
对象与方法
1.研究对象:回顾性分析2015年1月~2018年12月于徐州医科大学附属医院风湿免疫科首诊住院的RA患者共216例。纳入标准:所有患者均符合1987年美国风湿病学会(ACR)或欧洲抗风湿病联盟(EULAR)2009年制定的RA诊断标准;ILD的诊断符合2011年美国胸科协会/欧洲呼吸协会 (ATS/ERS)提出的IPF诊断标准;患者年龄均≥18岁;临床资料完整。排除标准:合并系统性红斑狼疮、干燥综合征等其他全身性结缔组织疾病及血液系统疾病;合并其他肺部疾病,如肺部感染、慢性阻塞性肺部疾病、肺结核、支气管扩张等;排除由药物、粉尘、吸入性有害物质所致的肺间质性疾病;存在慢性心脏、肝脏、肾功能不全者;排除各种急慢性感染、手术及外伤患者;排除肿瘤性疾病。
2.分组:根据IPF的诊断标准将患者分为RA组(130例)和RA-ILD组(86例)。(1)HRCT评分:选取主动脉弓上缘、隆突及膈肌上1cm 3个水平面,计算各个层面肺纤维化占相应肺野面积的百分比,根据3个层面累计的病变范围进行评分。(2)评分标准:根据累及范围为0、1%~25%、26%~50%、51%~75%、>75%,分别对应评分0、1、2、3和4分[4]。
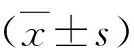
结 果
1.RA组和RA-ILD组患者基本特征及实验室指标差异:共收集RA患者216例,其中RA-ILD组86例,RA组130例。RA-ILD组患者咳嗽咳痰、活动后气短的发生高于 RA组,但差异无统计学意义(P>0.05),RA-ILD组患者年龄高于RA组(P<0.05)。在合并ILD组中,NLR、中性粒细胞计数、FIB、CRP、RF及抗CCP抗体水平显著高于RA组(P<0.05)。AFR、ALB水平明显低于RA组(P<0.05)。两组间ESR、淋巴细胞计数、免疫球蛋白(IgG、IgA、IgM)、补体(C3、C4)比较,差异无统计学意义(P>0.05),详见表1。
2.二元Logistics分析合并ILD的危险因素:以是否合并ILD为因变量,将单因素分析结果中有统计学意义的6个可能影响因素纳入二分类Logistics分析中,分别为患者年龄、NLR、CRP、AFR、RF及CCP-Ab。年龄、AFR及CCP-Ab是RA患者合并ILD的独立预测因素(P<0.05),详见表2。
3.应用ROC曲线评估AFR、CCP-Ab在ILD中的预测价值:采用ROC曲线评估AFR、CCP-Ab在RA-ILD诊断中的临床价值。AFR、CCP-Ab的ROC曲线下面积(AUC)分别为0.780和0.862,截断值分别为8.946和222.26,敏感度为86.1%和79.1%,特异性为69.2%和80.8%,详见图1、表3。
4.血清CCP-Ab、AFR联合检测在RA-ILD中的诊断价值:两种指标联合检测RA-ILD可见AFR与CCP-Ab联合检测的敏感度为69.8%,其特异性为93.1%,准确度为83.8%,与单一CCP-Ab比较,特异性显著升高,详见表4。
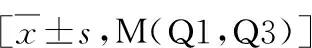
表1 两组患者的基本特征及实验室指标
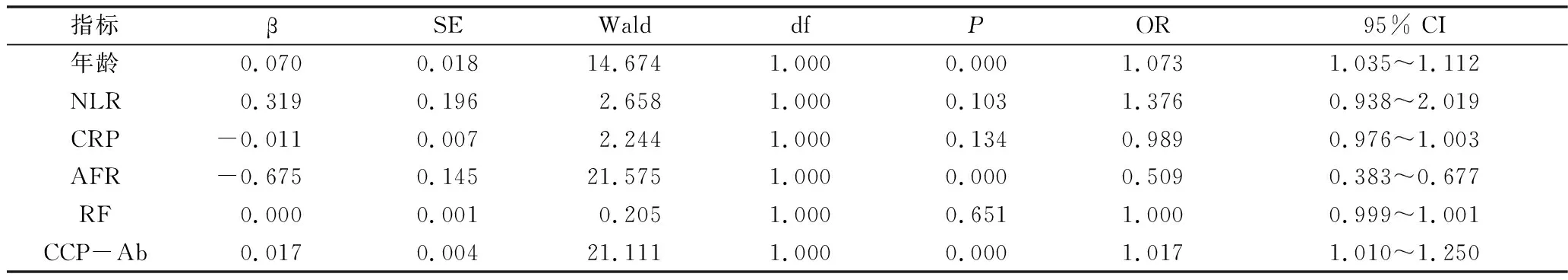
表2 RA患者并发ILD的多因素回归分析
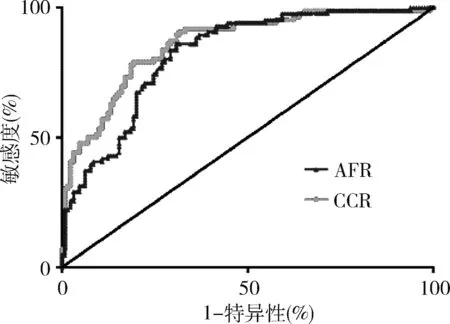
图1 AFR、CCP-Ab评估RA患者是否合并ILD的ROC曲线

表3 AFR、CCP-Ab ROC曲线下的面积及截断值
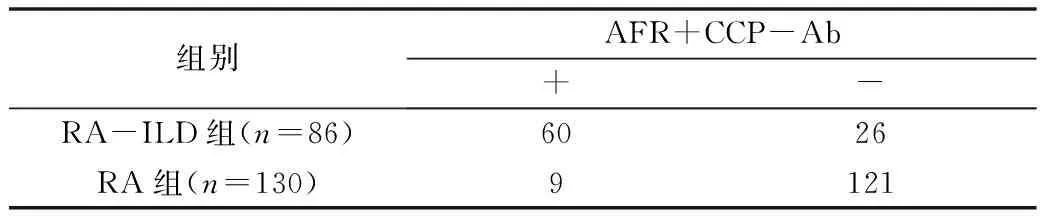
表4 AFR和CCP-Ab联合检测RA-ILD
5.AFR、CCP-Ab与HRCT评分和DLCO的相关性:RA-ILD组患者入院均行HRCT及肺功能检查。相关性分析结果显示,血清CCP-Ab与HRCT评分呈正相关(r=0.410,P=0.000),与DLCO呈负相关(r=-0.342,P=0.001)。AFR水平与HRCT评分呈负相关(r=-0.477,P=0.000),与DLCO呈较弱正相关(r=0.287,P=0.007),详见表5。
讨 论
类风湿关节炎(RA)是一种常见的自身免疫性疾病,不仅引起关节滑膜炎,关节疼痛,还会导致许多关节外表现和并发症,以ILD最为常见。RA-ILD的机制目前仍然不清。RA疾病本身也是纤维化肺病发展的危险因素,慢性免疫的激活和炎症亦可促进异常的纤维增生[5]。一些研究表明,RA-ILD发病的危险因素包括患者年龄较大、男性、吸烟、长期慢性病程、类风湿因子(RF)升高和CCP-Ab高水平[6,7]。本研究结果显示年龄、低水平的AFR、CCP-Ab高水平是ILD的独立危险因素。
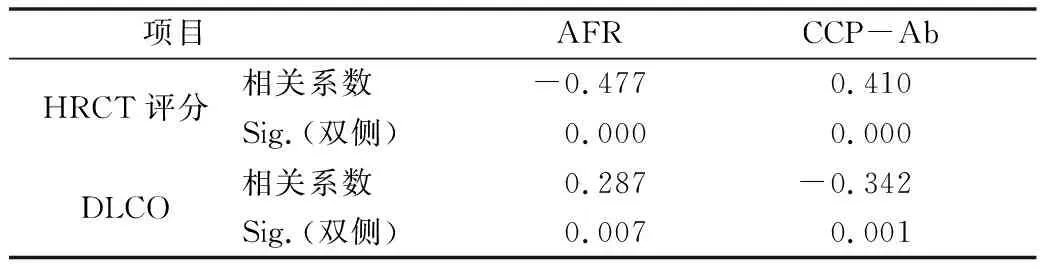
表5 RA-ILD患者AFR、CCP-Ab与HRCT评分及DLCO的相关性
凝血系统参与各种纤维化疾病,包括特发性肺纤维化和系统性硬化症相关的间质性肺纤维化。凝血级联的激活是组织损伤后最早的事件之一,包括肺损伤及纤维化[8,9]。由肝脏合成的纤维蛋白原是一种主要的血浆蛋白质,作为凝血因子直接参与凝血过程。循环纤维蛋白原在凝血酶的介导下可转化为纤维蛋白,促进血小板聚集,是内皮细胞的有效激活剂,充当炎性细胞的化学引诱物,并诱导成纤维细胞分化为肌成纤维细胞,促进肺间质纤维化的进展[10,11]。有文献报道pSS继发ILD的患者FIB水平较无ILD的pSS患者显著升高,表明其可作为临床判断pSS继发ILD患者的病情诊断的非特异性炎性指标[12]。当患者机体存在慢性炎症时,白蛋白减少而纤维蛋白原升高,然而,当患者营养不良时,白蛋白和纤维蛋白原水平均会下降[13]。因此,AFR可能与单一白蛋白或纤维蛋白原比较,能更稳定的预测疾病活动。已发现AFR与RA患者的疾病活动DAS28评分有关[3]。AFR可作为一种新的炎症标志物用于监测RA患者的疾病活动。此外,一些研究表明AFR在肺癌、慢性淋巴细胞白血病及心血管疾病的预后评估中有重要意义[14,15]。本研究发现RA-ILD组患者AFR水平较RA组明显降低(P<0.05),Logistic分析显示其为RA-ILD的独立预测因子。86例合并ILD的患者ARF水平与HRCT评分呈负相关(r=-0.477,P=0.000),与DLCO呈较弱正相关(r=0.287,P=0.007),说明其与ILD的疾病严重程度相关。
大量临床研究报道显示RA患者肺部纤维化与CCP-Ab密切相关,在RA-ILD患者肺泡灌洗液及血清中发现抗CCP抗体[16,17]。本研究结果显示,合并ILD组患者CCP-Ab水平显著高于RA组,其与HRCT评分呈中度正相关,与LDCO呈负相关,证实CCP-Ab与ILD病情严重程度相关。
本研究结果示,CCP-Ab和AFR联合检测特异性与单一CCP-Ab比较,敏感度虽然不及单一CCP-Ab检测水平(69.8% vs 79.1%),但特异性显著升高(93.1% vs 80.8%)。两种指标联合检测降低了单一抗体检测的误诊率。AFR测定方便简单、经济,易于检验,是一种效价比较高的血清学指标,对RA-ILD 早期诊断和病情评估有较高价值。
综上所述,患者年龄大、CCP-Ab水平高、AFR水平低的RA患者更需警惕间质性肺病的存在,尽早行胸部HRCT和肺功能检查,早期干预治疗,控制疾病的发展,改善预后。本研究是一项回顾性研究,研究样本量较小,仍需多中心、扩大样本量进一步证实AFR和CCP-Ab在ILD中的临床价值。

