绵羊GlyCAM-1基因克隆、核苷酸变异及其组织表达分析
郝志云 王继卿 胡 江 刘 秀 李少斌 罗玉柱
(甘肃农业大学动物科学技术学院/甘肃省草食动物生物技术重点实验室/甘肃省牛羊基因改良工程实验室,甘肃兰州 730070)
乳腺是哺乳动物唯一重复经历生长、功能分化和退化的器官,在动物的繁育过程中发挥着至关重要的作用[1]。 乳蛋白是乳汁的重要组成部分,是衡量乳品质的重要指标,主要由酪蛋白、乳清蛋白和乳脂球膜蛋白(milk fat globule membrane proteins,MFGMPs)等组成。 MFGMPs 仅占乳蛋白总含量的1%~2%,但具有抑制癌细胞、抗病毒感染、增强机体免疫等重要功能[2-4]。 糖基化依赖细胞粘附分子(glycosylationdependent cell adhesion molecule 1,GlyCAM-1)属于粘液素(mucin)糖蛋白家族的一员,是MFGMPs 的重要组成部分,具有参与细胞识别、信号转导以及介导白细胞粘附和淋巴细胞归巢等生物学功能,同时在免疫应答和炎症反应等过程中发挥重要作用[5]。 此外,GlyCAM-1 作为胚胎和子宫内膜特异受体的配体,参与整合素介导的粘膜级联反应[6]。 在乳腺中,GlyCAM-1 作为一种受激素调节的MFGMPs 重要组成部分参与乳腺发育及乳汁分泌过程[7-8]。 Suárez Vega 等[9]通过对2 个乳用绵羊品种(Ovis aries)Assaf(年产量400 kg)和Churra(年产量117 kg)在泌乳第10、第50、第120、第150 天的乳体细胞(milk somatic cells,MSC)进行转录组测序发现,GlyCAM-1 在整个泌乳时期均高表达(xFRPM=26 274),但在各时期表达量差异不显著(P>0.05)。 Paten 等[10]在研究罗姆尼母羊时发现,GlyCAM-1 在产后15 d 乳腺组织中的表达量高于妊娠后135 d,表明在乳汁分泌过程中GlyCAM-1 基因的表达量会上升。 由此表明,GlyCAM-1 在家畜泌乳和乳腺发育中发挥了重要作用,但是关于该基因的序列特征、核苷酸序列变异和表达特征尚不清楚。
为了系统研究绵羊GlyCAM-1 基因的核苷酸序列特征及其变异、组织表达特征,本研究以高泌乳量的小尾寒羊(泌乳高峰期和空怀期)和低泌乳量的甘肃高山细毛羊(泌乳高峰期)为对象,应用基因克隆、生物信息学、测序、实时荧光定量PCR (real timequantitative PCR,RT-qPCR)等技术,对该基因进行了CDS 区域克隆、氨基酸序列特征分析,研究了该基因CDS 区的核苷酸序列变异,检测了乳腺、心脏、肝脏、脾脏等8 个组织中该基因的mRNA 表达特征,以期为研究GlyCAM-1 基因的泌乳生物学功能提供基础数据。
1 材料与方法
1.1 试验材料
试验样品采自甘肃省天祝县松山镇金子河绵羊繁育场,选择处于泌乳高峰期(产后第3 周)的高泌乳量小尾寒羊和低泌乳量甘肃高山细毛羊各3 只,另外选择处于空怀期的小尾寒羊3 只,合计9 只试验羊。 要求所有试验羊均为3 岁、第4 胎、在同一饲养条件下饲养管理。 屠宰后立即采取乳腺、心脏、肝脏、肺脏、脾脏、肾脏、卵巢和背最长肌各0.5 g 左右。 乳腺组织样用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水冲洗除去残留的乳汁之后,装入2 mL 冻存管后立即置于液氮中保存,带回实验室后于-80℃保存备用。
1.2 试验方法
按照Trizol Reagent(Invitrogen,CA,USA)说明书要求,提取组织中的总RNA。 提取后的RNA 用1.5%琼脂糖凝胶电泳检测其完整性,用Nanoprop 2000 型超微量分光光度计(塞默飞,美国)检测OD260/OD280及其浓度,质量合格的RNA 保存于-80℃冰箱中备用。 根据天根反转录FastKing RT kit(with gDNase)说明书要求,对RNA 进行反转录,得到的cDNA 按照其浓度稀释成100 ng·μL-1溶液,-20℃冰箱保存备用。
1.3 GLYCAL-1 基因引物设计及克隆
依据GenBank 中预测的绵羊GlyCAM-1 基因的mRNA 序列(XM_012149360.2),利用Primer 5.0 设计P1 和P2 引物,其中P1 引物用于GlyCAM-1 基因CDS区的克隆,P2 引物用于RT-qPCR 分析,β-actin基因为内参引物,引物具体信息见表1。 以小尾寒羊乳腺组织中获得的cDNA 为模板,采用20 μL 反应体系,包括cDNA 0.8 μL(约100 ng·μL-1),5 U·μL-1Taq 预混酶10 μL,0.25 μmol·L-1上、下游引物各0.8 μL,ddH2O补足至20 μL。 PCR 反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,共35 个循环;72℃终延伸7 min;4℃保存。 PCR 产物用1.5%琼脂糖电泳检测。 选择目的条带进行切胶回收并连接至克隆载体pMD19-T,经转化、PCR 鉴定后挑取阳性单克隆穿刺培养,送至上海生工生物科技有限公司进行测序。 以泌乳高峰期小尾寒羊(3 个)和甘肃高山细毛羊(3 个)乳腺组织的cDNA 为模板,扩增P1 引物,将其扩增片段直接测序鉴定其核苷酸序列变异特征。

表1 绵羊GlyCAM-1 基因的扩增引物信息Table 1 Primer information for sheep GlyCAM-1 gene
1.4 GLYCAM-1 基因生物信息学分析
基于克隆获得的绵羊GlyCAM-1 基因序列,利用DNAStar 7.1 软件查找该基因的开放阅读框(open reading frame,ORF),并利用NCBI 中的BLAST 进行验证;用ExPasy 站点上的ProtParam 软件分析绵羊GlyCAM-1 的氨基酸特征;利用ExPaSy 站点上的SOPMA 分析其蛋白结构;用NetPhos 3.1 预测氨基酸序列中潜在的磷酸化位点[11];利用GO 和KEGG 分析其参与的生物学功能和代谢通路,利用String[12]在线分析GlyCAM-1 的蛋白网络互作关系,用MEGA 5.0构建系统进化树。
1.5 GlyCAM-1 基因表达量分析
采用相对定量SYBR Green Ⅰ(TaKaRa,大连)染料法检测GlyCAM-1 基因的组织表达量。 采用20 μL体系,包括cDNA 模板2 μL(<100 ng),0.25 μmol·L-1上下游引物各0.4 μL、10 μmol·L-1SYBR qPCR Master Mix 10 μL、ROX Ⅱ0.4 μL 和RNase-free ddH2O 6.8 μL。 RT-qPCR 反应条件:95℃预变性5 min;95℃变性15 s,60℃退火34 s,72℃延伸30 s,40 个循环。 溶解反应:95℃变性15 s;60℃采集荧光信号60 s。 每个反应设3 个平行对照。 待反应结束后依据结果报告,分析其荧光定量溶解曲线,判断是否存在引物二聚体,以及PCR产物的准确性,收集数据,计算表达量[13]。 反应在Applied Biosystems QuantStudio ® 6 Flex 仪(Thermo Fisher,USA)中进行。
2 结果与分析
2.1 GlyCAM-1 基因的克隆
以小尾寒羊的乳腺cDNA 为模板,用RT-PCR 进行扩增,PCR 产物用1.5%琼脂糖凝胶电泳检测。 结果表明,目的片段条带(465 bp)跟预期结果一致(图1)。 测序后获得该基因的完整CDS 区序列,大小为465 bp,编码154 个氨基酸。 序列已提交至GenBank,登录号为MH917952.1。

图1 绵羊GlyCAM-1 基因PCR 电泳结果Fig.1 Electrophoresis results of GlyCAM-1 gene of sheep
通过BLAST 分析发现,MH917952.1 与山羊的GlyCAM-1 具有较高的序列同源性(98.7%),与黄牛GlyCAM-1 之间的同源性为88.96%。 利用GenBank中山羊(Capra hircus)、野牦牛(Bos mutus)、黄牛(Bos taurus)、藏羚羊(Pantholops hodgsonii)、大鼠(Rattus norvegicus)、 小 鼠(Mus musculus) 和 人 类(Homo sapiens)GlyCAM-1 的氨基酸序列,结合本研究中获得的MH917952.1 构建系统进化树。 由图2 可知,MH917952.1 首先与山羊的GlyCAM-1 序列聚到一支,然后与藏羚羊、野牦牛和黄牛的序列聚到一起,说明获得的MH917952.1 为绵羊的GlyCAM-1 序列。
2.2 GlyCAM-1 蛋白理化性质
绵羊GlyCAM-1 蛋白的原子组成为C749H1234N200O241S4,分子质量为17 025.47,等电点为5.27。 在编码的154 个氨基酸中,根据R 侧链的电荷数和极性,可以分为两类:1)极性氨基酸,占总氨基酸数目的57.15%,包括20 个带正电荷的极性氨基酸(R + K +H)(12.99%),22 个带负电荷的极性氨基酸(D + E)(14.29%)和46 个不带电荷的极性氨基酸(G、S、T、C、Y、N、Q)(29.87%);2)66 个非极性氨基酸(A、Ⅴ、Ⅰ、L、F、 W、 M、 P),占总氨基酸数目的42.85%。GlyCAM-1 的消光系数在280 nm 时为1 490,不稳定系数为49.83,说明该蛋白是一个不稳定蛋白。GlyCAM-1 在哺乳动物网织红细胞内的半衰期为30 h,脂肪系数为95.06,总平均亲水性为-0.442,说明该蛋白是一个可溶性蛋白。
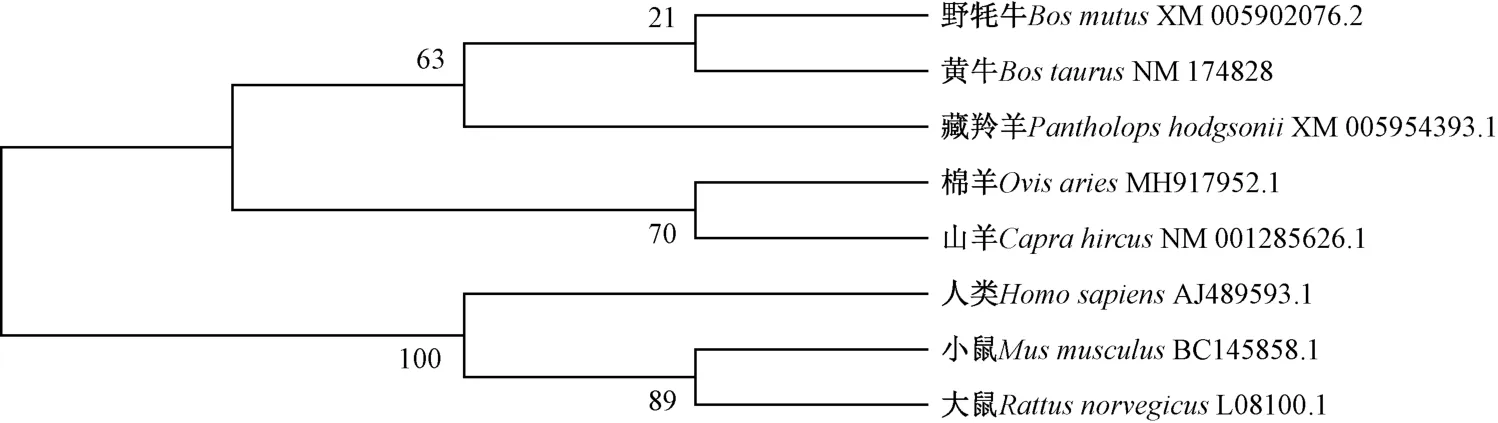
图2 GlyCAM-1 氨基酸序列的同源性分析Fig.2 Homology analysis of the amino acid sequence of GlyCAM-1
绵羊GlyCAM-1 蛋白的二级结构由76 个α-螺旋(helix)(49.35%)、73 个无规则卷曲(coil)(47.40%)和5 个延伸链(extended strand)(3.25%)组成。 磷酸化位点检测结果表明,该蛋白功能区域富含丝氨酸(16 个)和苏氨酸(10 个)磷酸化位点。 GO 功能注释结果表明,GlyCAM-1 基因主要注释到蛋白质结合、离子结合及细胞粘附等生物学过程中。 KEGG 分析结果表明,GlyCAM-1 基因注释到细胞粘附分子代谢通路中。 String 分析结果表明,GlyCAM - 1 同催乳素(prolactin,PRL)蛋白、粘膜血管贴壁细胞黏附分子1(mucosal vascular addressing cell adhesion molecule 1,MadCAM-1)、CD34 和L-选择素(L-selectin)具有直接的联系(图3)。
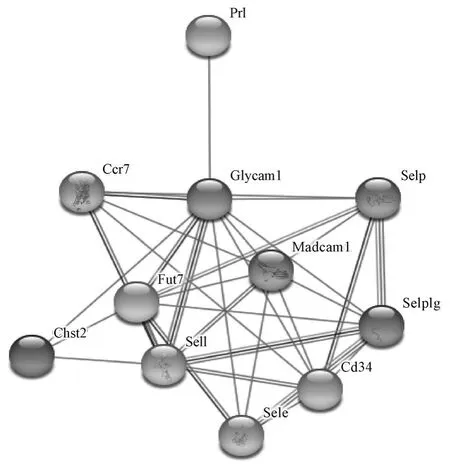
图3 绵羊GlyCAM-1 蛋白网络互作图Fig.3 The protein interaction network of sheep GlyCAM-1
2.3 GlyCAM-1 基因核苷酸序列变异特征分析
测序结果表明,在GlyCAM-1 基因CDS 区检测到7 个SNPs,其中2 个为同义突变:c. 39 C>T(p. A)和c. 258 G>A(p. L);5 个为错义突变,分别为c. 41 C>T(p. A14V)、c. 43 A >G(p. T15A)、c. 279 A >T(p.Q93H)、c. 292 A >T(p. T98S)和c. 371 A >G(p.H124R)。
2.4 GlyCAM-1 基因的表达特征分析
利用RT-qPCR 法检测处于泌乳高峰期的小尾寒羊和甘肃高山细毛羊中GlyCAM-1 基因在心脏、肝脏、脾脏、肺脏、肾脏、背最长肌、卵巢和乳腺组织中的表达量,同时检测该基因在空怀期小尾寒羊乳腺组织中的表达量。 由图4 可知,GlyCAM-1 基因的表达具有明显的组织特异性。 在检测的8 个组织中,GlyCAM-1基因在乳腺中的表达量最高,在肺脏组织中微弱表达,在其他6 个组织中均不表达。 同时GlyCAM-1 的表达也呈现出品种特异性,在泌乳高峰期的乳腺组织中,GlyCAM-1 基因在小尾寒羊中的表达量是甘肃高山细毛羊的1.6 倍(P<0.05)。 此外,不同泌乳时期,GlyCAM-1 的表达量也不同。 小尾寒羊中GlyCAM-1基因在泌乳高峰期中的表达量是空怀期表达量的25倍(P<0.01)。

图4 GlyCAM-1 基因在小尾寒羊和甘肃高山细毛羊不同组织中的表达量Fig.4 Expression of GlyCAM-1 gene in different tissues of Small Tail Han sheep and Gansu alpine merino sheep
3 讨论
3.1 MFGMPs 的生物学功能
MFGMPs 是乳中的一种重要蛋白质,主要以乳脂肪球膜的形式存在,在乳腺分泌细胞内形成并分泌到乳汁中。 尽管MFGMPs 只占牛奶总蛋白质含量的1%~2%,但具有多样性的生物学功能,在幼崽的细胞生长过程及防御机能[3,14]、动物的免疫和发育等过程发挥了重要作用。 此外,Haramizu 等[15]研究发现,MFGMPs 还可以提高小鼠的耐力和肌肉运动能力。 在新生儿的辅食中添加MFGMPs,可减少腹泻的发生[2]。MFGMPs 的数量和含量存在物种差异性,如奶牛[16]、奶山羊[17]和绵羊[4]乳中的MFGMPs 的数量和含量各不相同。 粘液素是粘膜物理屏障的组成部分,可以作为物理屏障防御病原微生物对呼吸道、胃肠道和子宫内膜等部位的感染。 作为MFGMPs 的重要组成成分,GlyCAM-1 同样在免疫保护和细胞粘附方面具有重要的作用[18]。 研究发现,GlyCAM-1 的表达量与乳蛋白含量呈正相关。 Ji 等[19]利用iTRAQ(isobaric tags for relative and absolute quantitation)技术鉴定了牦牛和奶牛的乳脂球膜蛋白,发现在高乳蛋白率(5.16%)的牦牛乳汁中,GlyCAM-1 高度富集,并且是低乳蛋白率(2.79%)奶牛的10.15 倍。 由于绵羊的乳蛋白含量(5.15%)显著高于山羊(4.10%)和奶牛[20-21],推测绵羊乳中GlyCAM-1 表达量可能也高于山羊和奶牛,但还需进一步证实。
3.2 GlyCAM-1 序列特征及生物信息学分析
本研究利用RT-PCR 方法首次克隆了绵羊GlyCAM-1 基因的编码区序列。 序列比对表明,绵羊GlyCAM-1 的氨基酸序列与山羊具有较高的同源性(98.7%),与黄牛之间的同源性为88.96%。 通过直接测序技术在GlyCAM-1 基因中检测到7 个SNPs,表明该基因具有丰富的多态性。 李晶等[22]研究发现,GlyCAM-1 的核苷酸变异与奶牛乳房炎有相关性,GlyCAM-1 第3 外显子2081 处A>T 的变异降低了乳房炎的感染率。 GO 功能注释表明GlyCAM-1 基因主要参与蛋白结合、离子结合等生物学过程,KEGG 结果表明GlyCAM-1 参与细胞分子粘附代谢通路。 细胞粘附分子是在细胞表面表达的糖蛋白,且在包括止血、免疫应答、炎症、胚胎发生等多种生物过程中起关键作用。 在淋巴器官中,GlyCAM-1 作为L-选择蛋白的配体参与了淋巴细胞和内皮细胞之间的相互作用[23],使细胞与细胞间、细胞与基质间,或细胞-基质-细胞间发生粘附,从而参与细胞的识别、活化、信号转导和细胞的增殖与分化。 因此,GlyCAM-1 可以通过该途径调控乳腺细胞的增殖、分化和凋亡[24]。
蛋白互作研究可以在分子水平揭示蛋白质功能以及包括生长、发育、代谢、分化和凋亡在内的细胞活动规律[24]。 通过蛋白-蛋白互作网络分析发现,GlyCAM-1 与PRL、L-Selectin、MadCAM-1 和CD34 蛋白具有直接的作用。 GlyCAM-1、MadCAM-1 和CD34 都是L-选择素的配体,具有粘蛋白样多肽结构和硫酸化的O-连接聚糖[25],它们通过粘附参与细胞的识别、活化、信号转导增殖及凋亡等过程。 蛋白质半衰期与其稳定性有关。 贾浩等[26]发现,蛋白质的半衰期长,其稳定性高。 本研究结果表明,GlyCAM-1 基因编码的蛋白具有较长的半衰期,但属于不稳定蛋白,这可能与该蛋白富含丝氨酸和苏氨酸磷酸化位点有关,磷酸化使得该蛋白的稳定性降低[27-28]。
3.3 GlyCAM-1 基因组织表达特征分析
本研究中,GlyCAM-1 基因的表达具有明显的组织特异性、品种特异性和时空特异性。 在8 个组织中,GlyCAM-1 基因在泌乳期的乳腺组织中高表达,在空怀期乳腺组织和肺脏组织中也有少量表达,其他组织中均不表达,这与前人研究结果相一致。 研究表明,GLYCAM-1 基因在泌乳期奶牛和小鼠的乳腺组织中高度表达,同时在肺脏组织、子宫中也表达[29-31]。GlyCAM-1 在乳腺上皮细胞合成后分泌到乳汁中[7],其表达量受到激素和外源性刺激的调控。 例如催乳素(prolactin,PRL)能诱导GlyCAM-1 的表达,而孕酮则抑制了该基因的表达[32]。 断奶10 d 后,乳腺中的GlyCAM-1 表达量降至极低的水平,表明乳腺中GlyCAM-1 的调节与其他乳蛋白质相似,都需要通过哺乳幼崽等外源性刺激才能继续表达[33]。GlyCAM-1基因在子宫和胚胎着床阶段的表达也进行了较多的研究。 绵羊子宫中GlyCAM-1 mRNA 和蛋白质的水平与处于发情周期的子宫内膜上皮中孕酮受体表达的变化趋势非常相似,这表明黄体酮可能是子宫中GlyCAM-1 的潜在调节因子[31]。 本试验中,GlyCAM-1基因在高泌乳量小尾寒羊乳腺组织中的表达量显著高于低泌乳量甘肃高山细毛羊乳腺组织,说明该基因能促进绵羊的泌乳,这与Romney 绵羊乳腺组织中的研究结果相似[10]。 在产奶量有显著差异的Assaf(400 kg)和Churra(117 kg)绵羊之间,GlyCAM-1 表达量并无显著差异(P>0.05)[9],这可能与研究中不同的RNA 来源有关,本研究分析的是乳腺组织,而Suárez Vega 等[9]采用乳汁中的MSC 检测其各时期的基因表达谱。 Cánovas 等[34]和Wickramasinghe 等[35]已证实奶牛乳腺和MSC 之间基因的表达模式有较大的差异。
本试验结果表明,在空怀期小尾寒羊乳腺组织中,GlyCAM-1 基因的表达量很低,但在乳汁合成过程中,该基因的表达量又上升。 在乳腺的发育及乳汁合成中,该基因的表达量变化趋势与激素分泌有关,GlyCAM-1 基因受到PRL 的诱导才能表达。 PRL 在发情期开始分泌,导致该基因在泌乳高峰期有较高的表达量,而在空怀期表达量很低[36]。 同时,GlyCAM-1 在不同乳腺发育时期的表达量差异可能还与腺泡发育有关[32]。 与空怀期相比,泌乳高峰期的乳腺中含有大量的腺泡,这也导致了该基因在泌乳高峰期有较高的表达量。
4 结论
本研究首次克隆获得了小尾寒羊GlyCAM-1 基因的CDS 全长序列,该基因编码154 个氨基酸。 绵羊的GlyCAM-1 氨基酸序列与山羊和牛的GlyCAM-1 具有较高的序列同源性。 GlyCAM-1 蛋白的二级结构主要以α-螺旋和无规则卷曲为主。 蛋白互作分析结果表明,GlyCAM-1 蛋白与CD34、MadCAM-1 都作为L-选择素的配体发挥作用。 此外,GlyCAM-1 基因的CDS区发现了7 个SNPs(包括2 个同义突变和5 个非同义突变)。GlyCAM-1 基因在绵羊上的表达具有明显的组织特异性、品种特异性和时空特异性。 本研究结果丰富了绵羊基因组数据,为深入研究GlyCAM-1 基因的泌乳生物学功能及其机理提供了基础数据。

