电喷雾-差分电迁移率-粒子计数法绝对定量分析牛血清白蛋白
刘 洋,米 薇,李红梅,胡志上
(1.北京化工大学 生命科学与技术与技术学院,北京 100029;2.中国计量科学研究院,北京 100013)
面对越来越多的蛋白类药物的研发生产以及上市,市场对蛋白质及肽类药物药性分析的需求日益增大,对定量表征技术也提出越来越高的要求。蛋白含量测定是蛋白质药物质量控制中的重要指标之一,准确的蛋白质含量测定对比活性计算、残留杂质的限量控制、产品的分装以及其他理化性质测定均具有重要意义[1]。
与传统的化学小分子药物相比,蛋白质类药物具有结构复杂,相对分子质量较大,存在内源性干扰以及生产工艺复杂等特点,分析检测难度较大。常用的蛋白质定量分析方法包括分光光度法[2]、比色法[3-4]、生物检定法[5]、氨基酸分析[6-7]以及质谱分析技术[8-10]。但现有的蛋白质定量方法存在精度不足、误差较大、费时费力等缺陷,定量分析依赖于内标或外标,对结构复杂、分子量大的蛋白质定量研究的能力不足,定量结果的准确性和重复性亟待提高。因此,建立和丰富准确并快速的蛋白定量技术具有现实意义。
电喷雾-差分电迁移率-粒子计数(Electrospray-differential mobility analysis-condensation particle counter,ES-DMA-CPC)分析技术根据不同大小的带电粒子在电场中迁移率不同,对获得的不同电迁移率直径的粒子进行计数,具有无需样品预处理、灵敏度高、耗时短、耗样量少、检测范围广等优势,在生物领域的应用越来越广泛[11-13]。ES-DMA-CPC目前已经应用于病毒颗粒分析[14]、蛋白颗粒的表征[15-16]、纳米金颗粒研究[17-18]和生物纳米粒子交联[19-20]等方面,同时电喷雾(ES)电离过程产生的液滴诱导聚集效应[21],为蛋白定量提供了新的途径。Bacher等[22]利用该技术分析了20多种不同的蛋白质,Li等[23]提出了生物纳米颗粒非特异性聚集回归模型的绝对量化方法,Clouet-Foraison等[24]在绝对量化方法的基础上将其应用于脂蛋白颗粒浓度测量。
本研究利用该技术,搭建了一套ES-DMA-CPC计量装置,系统考察和优化了实验条件,建立了基于ES-DMA-CPC的蛋白质定量分析技术,并应用于牛血清白蛋白标准物质的定量测定,测定结果与标准物质浓度相符。本方法无需复杂的样品前处理,通过较少的样品即可快速准确得到蛋白质浓度,为蛋白质定量提供了一种新的分析方法。
1 实验部分
1.1 仪器与试剂
3482型电喷雾气溶胶颗粒发生器、3082型静电分级器、3788型纳米水基凝聚核粒子计数器、二氧化硅毛细管(内径25 μm,长度4.07 cm)(TSI,USA);FLOW-EZ微流体恒流泵(Fluigent,France)。
蔗糖(D-(+)- 蔗糖,纯度99.9%,Sigma,USA);乙酸铵(色谱级,纯度≥99.0%,Honerwell,German);牛血清白蛋白标准物质(GBW09815)、牛血清白蛋白溶液标准物质(BW3627-1)(中国计量科学研究院);实验用水为超纯水。
1.2 样品准备与标准溶液配制
实验中所有样品采用质量稀释法制备。取适量乙酸铵配制成20 mmol/L缓冲液,过滤并调至pH 7.0(缓冲液的pH值应高于BSA的等电点(pI)以防止蛋白质吸附在壁上)。0.063%(体积分数)蔗糖溶液由10%(体积分数)的蔗糖溶液过滤制备得到。将牛血清白蛋白标准物质采用重量法配制成20.0 g/L的牛血清白蛋白溶液,并稀释成100、50、25、10、5 mg/L的样品溶液;将牛血清白蛋白溶液标准物质(69.4 g/L)稀释成495.7、198.3、99.0、49.5、19.8、9.9 mg/L的样品溶液。重复实验时需要重新制备上述样品溶液梯度。样品采集选用3(Scans per sample)×3(Number of samples)的方式,以保证实验数据的重复性和准确性。
1.3 实验条件及参数
电喷雾-差分电迁移率-粒子计数分析技术的实验装置原理图如图1所示,完整的ES-DMA-CPC主要由3部分组成,包括电喷雾气溶胶颗粒发生器(ES)、粒子分选器(DMA)和凝结核颗粒计数器(CPC)。首先将样品通过微流体恒流泵注入电喷雾气溶胶颗粒发生器中,通过25 μm内径的毛细管产生雾化的高电荷液滴,液滴蒸发干燥后,根据电荷残余机制,余下的带电粒子即待分析蛋白样品通过DMA纳米柱,最终在CPC中获得粒子的总数。本研究采用更常见的内径25 μm的二氧化硅短毛细管(长度4.07 cm),以干燥的空气和二氧化碳气体作为载气。DMA鞘流流速设定为6 L/min,CPC取样流速设定为0.6 L/min,DMA直径扫描范围设定为3.16~107.5 nm。
2 结果与讨论
2.1 蔗糖颗粒的选择
基于ES-DMA-CPC的蛋白定量分析,需要了解电喷雾发生器产生的液滴尺寸。对低浓度的蔗糖和蛋白质颗粒来说,溶液的粘度受缓冲条件控制,具有相同缓冲条件的蔗糖溶液和蛋白溶液的液滴尺寸预计是相同的[25-26]。因此本研究通过对蔗糖粒径的测试分析,系统考察了影响蛋白质定量分析的相关参数。

图1 电喷雾-差分电迁移率-粒子计数法示意图Fig.1 Diagram of electrospray-differential mobility analysis-condensation particle counter(ES-DMA-CPC)
2.2 ES-DMA-CPC参数优化
2.2.1 电喷雾电压电喷雾电压造成的液体喷射模式对蔗糖粒径分布的影响如图2所示。样品溶液流速分别为0.1、0.3、0.5、1 μL/min,结果显示泰勒锥模式下蔗糖粒径分布明显较窄,粒径值较小。为保证实验测量的稳定性和准确性,控制待分析样品溶液的电喷雾在泰勒锥模式下进行测量[19-20]。本研究选择电喷雾电压在1.7~1.9 kV范围内,以保证在泰勒锥模式下进行研究。




图2 低电压模式(a)和泰勒锥模式(b)蔗糖粒径分布比较Fig.2 Comparison of sucrose particle size distribution between low voltage mode(a) and Taylor cone mode(b) sucrose sample flow rate(A-D):0.1,0.3,0.5,1 μL/min
2.2.2 样品溶液流速电喷雾产生的液滴尺寸大小对蛋白质定量意义重大,而液滴的尺寸由样品溶液流速和样品溶液的电导率控制。“2.2.1”中已确定本研究在稳定的泰勒锥状态下进行,而在确定的溶液浓度(即蔗糖溶液)下,稳定的泰勒锥模式受溶液电导率的影响[25],实验中样品溶液的电导率由缓冲溶液乙酸铵决定,因此本研究中液滴的尺寸由样品溶液流速控制[25-28]。
考察了样品溶液在0.1~1 μL/min流速梯度下蔗糖的粒径分布(图3A),该条件下蔗糖的粒径值以及峰宽(FWHM)值分布见图3B。结果显示,蔗糖粒径随着样品溶液流速的降低而减小,粒径分布随着样品溶液流速的降低而变窄。由此可知,较低流速产生分布较窄、粒径较小的电喷雾液滴,因此实验中样品溶液流速除应保证实验样品溶液产生稳定的锥形喷射不出现断流现象外,还应使FLOW-EZ微流体恒流泵瞬时流速保持稳定。结果显示,对于BSA样品,样品溶液最佳流速为300 nL/min。


图3 在0.1 μL/min到1 μL/min样品溶液流速梯度下蔗糖的粒径分布(A)和粒径值(Dd)以及峰宽值(FWHM)分布(B)Fig.3 Particle size distribution(A)and particle size of the dried sucrose(Dd) and the distribution of peak width(FWHM) values(B)of the sample solution with flow rate from 0.1 μL/min to 1 μL/min
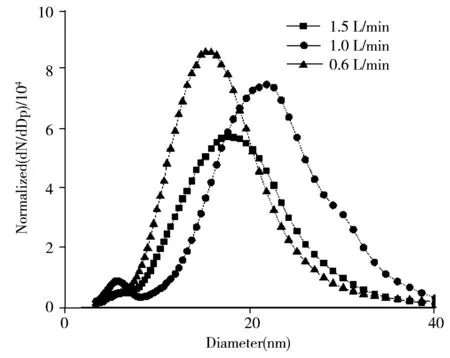
图4 不同空气流速下的蔗糖粒径分布Fig.4 Sucrose particle size distribution at different air flow rates
2.2.3 气体流速空气和二氧化碳为本研究的实验载气。空气的作用是将电喷雾产生的颗粒输送进DMA和CPC,二氧化碳的作用是防止毛细管尖端电弧的产生。故通过改变空气流量来改变载气流量。本文二氧化碳流量设置为仪器默认值,即0.1 L/min。载气流量的变化即ES腔室压力变化可改变液滴尺寸。本研究通过蔗糖粒径的变化来反应液滴尺寸的变化。如图4所示,在液体流速为300 nL/min,泰勒锥模式电压条件下,当二氧化碳流速为0.1 L/min,若空气流速为1.0 L/min时,蔗糖粒径分布更窄,粒径更小。因此,选择气体流速为二氧化碳0.1 L/min,空气1.0 L/min。
2.3 蛋白质浓度绝对定量
蛋白质浓度绝对定量方法基于电喷雾(ES)电离过程中的液滴诱导聚集进行统计分析[23]。待分析蛋白在ES过程中完全蒸发后以带电残留物的形式存在,因此遵循电荷残留机制。该电荷残留机制表明液滴诱导聚集效应存在,即DMA观察到的结果中,存在一个液滴中包裹两个单体诱导聚集形成二聚体的现象。Li等[23]通过建立统计模型进行研究,发现观察到的二聚体与单体的比值在统计学上与溶液中原始蛋白质的浓度有关。这种统计模型的建立表明,基于理论推导,根据ES-DMA-CPC对蛋白样品的单体和聚集体以及液滴尺寸进行测量,可以对蛋白样品进行定量分析。
2.3.1 液滴尺寸计算根据电荷残余机制,随着溶剂的蒸发,液滴可能会保持球形,此时液滴半径非常接近颗粒半径。通常可将颗粒迁移率表示为等效球形直径,而与其实际形状无关。因此通过蔗糖颗粒直径的测量分析表征,即可获得蛋白样品颗粒直径。
本研究通过使用体积分数为0.063%的蔗糖溶液来评估确定原始液滴的尺寸[25]。
(1)
式中,D代表液滴直径,Ds代表干燥的蔗糖颗粒直径(ES-DMA-CPC测量得到),Cs代表已知的体积分数的蔗糖溶液(本文中Cs=0.063%)。
2.3.2 BSA定量结果实验中只观察到单体、二聚体和三聚体,所以蛋白定量计算截止至三聚体。只考虑简单情况,即ES发生器产生体积为Vd的单分散液滴,根据泊松分布分析,通过对“观察到的”单体和二聚体(No1,No2)以及液滴尺寸的测量,二聚体和单体数量浓度的比值(No2/No1)与样品稀释倍数m存在某种线性关系,拟合式(2)即获得单体Cp1和二聚体Cp2的绝对数浓度,然后通过式(3)确定三聚体浓度Cp3。总浓度可以通过式(4)求和来确定[22]。
(2)
(3)
Cp=Cp1+2Cp2+3Cp3
(4)
式中,No1、No2、No3为“观察到的”单体、二聚体和三聚体的数量浓度,即ES-DMA-CPC测量得到的单体、二聚体和三聚体的数量浓度;Cp1、Cp2、Cp3为待分析样品中单体、二聚体和三聚体的数量浓度;Cp为待分析样品的质量浓度(g/L);m为稀释倍数。由于蛋白样品的差异,实验中只观察到单体和二聚体,故计算结果截止到二聚体。
根据上述理论以及方法,对牛血清白蛋白标准物质(GBW09815)进行定量分析,采用同位素稀释质谱法定值,纯度为0.963 g/g,扩展不确定度为0.038 g/g(k=2)。使用该标准物质配制20.0 g/L的牛血清白蛋白溶液进行测定,即该蛋白样品溶液标准质量浓度为19.26 g/L。以牛血清白蛋白溶液标准物质(BW3627-1)的定量结果进行验证,其标准值为69.40 g/L(U=4.6 g/L,k=2)。将两种样品的梯度稀释液分成3组,每组重复测定3次,定量结果见表1。由表1可知,牛血清白蛋白标准物质(GBW09815)配制的牛血清白蛋白溶液平均定量结果为20.05 g/L,牛血清白蛋白溶液标准物质(BW3627-1)定量验证的平均结果为69.52 g/L。本法与标准物质BSA定值(同位素稀释质谱法)的相对误差在±5%以内,说明本方法具有准确性和等效性。

表1 BSA浓度定量Table 1 Quantifying concentration of BSA
*due to the high concentration of the sample BSA solution(BW3627-1),the capillaries cloged seriousiy,so the experimental data included 3 groups(样品BSA solution(BW3627-1)由于浓度较高,引发毛细管堵塞情况严重,因此其收录实验数据为3组)
3 结 论
基于ES-DMA-CPC,采用常规的二氧化硅毛细管,在探究蔗糖粒径分布参数的条件下,建立了快速准确的蛋白质浓度定量方法,并采用标准物质验证了方法的准确性。与其他蛋白定量技术相比,电喷雾-差分电迁移率-粒子计数分析技术耗时更短,灵敏度更高,样品无需复杂前处理,在大分子蛋白类药物的定量分析中显示出良好的应用前景。

