利用2型重组腺相关病毒抑制子宫腔上皮Plekhs1基因表达对小鼠生育能力的影响
马兴红,张其法,姜 南,李世杰,王一妹
(东北农业大学生命科学学院,哈尔滨 150030)
在体靶向基因功能研究是生命科学领域新策略,其中病毒载体作为安全、有效基因治疗工具受到关注。主流病毒载体包括:腺病毒(Adenovi⁃rus)、慢病毒(Lentivirus)、腺相关病毒(AAV,Ad⁃enovirus associated virus)[1]。腺相关病毒相比其他病毒具有免疫原性低、病毒颗粒小、滴度高、血清型多、安全性高、表达稳定等优点,是最具潜力基因转导工具[2]。rAAV载体在各类疾病研究领域广泛应用[3]。2013年,欧洲药品管理局(EMA)批准首个腺相关病毒基因药物用于治疗遗传性代谢疾病[4]。子宫作为哺乳动物雌性生殖器官重要组成,是胚胎着床和胎儿发育重要场所,研究不同发育阶段子宫基因功能具有重要意义[5]。探寻在体靶向子宫特定基因研究有效途径尤为必要。
决定AAV介导基因转移效率关键因素为病毒载体对靶细胞转染程度,其中注射方式为组织细胞中转染效率决定因素,主要包括静脉注射、腹腔注射及定点注射等[6-7]。静脉注射和腹腔注射操作简单、组织损伤较小;AAV具有器官靶向性,但也分布于非靶器官,因此非靶器官基因改变可能影响基因在特定组织或细胞类型功能。同时AAV血清型较多,筛选特异性侵染靶器官血清型工作量大。BALB/c小鼠尾静脉注射血清型1、5、6、8AAV发现,AAV1和AAV8在卵巢子宫中转染效率高,AAV5在卵巢中无分布[8]。以AAV8为载体治疗大鼠纯合性家族高胆固醇血症时发现,AAV8在雌性雄性性腺中均有表达,但分布较少[9],表明静脉注射存在不确定性。定点注射可在预定时间和生理状态下在组织细胞中条件性表达基因,增加载体在靶器官分布量,提高转染效率,但操作技术难度高,损伤组织。
借鉴腺病毒子宫角注射小鼠子宫研究经验,腺病毒在子宫内特异性感染腔上皮组织,但上皮基底膜作为屏障阻止病毒颗粒侵染基质细胞[10]。研究发现子宫上皮特异性表达基因Plekhs1与子宫接受态转变密切相关,当子宫处于中性状态时Plekhs1高表达,处于非接受态时Plekhs1不表达[11]。因此,本研究构建包装可沉默Plekhs1表达2型重组腺相关病毒(rAAV2-PL3),通过子宫角直接注射方法研究腺相关病毒在子宫组织中表达规律及干扰Plekhs1表达对小鼠生育能力影响,探索子宫细胞中条件性沉默特定基因可行性方法。
1 材料与方法
1.1 材料
1.1.1 试验材料
8周龄性成熟昆明小鼠(体重18~22 g),购自哈尔滨医科大学附属第一医院实验动物中心。病毒载体质粒AAV.U6.ShRLuc(AAV2)和辅助质粒pAAV 2.9、pAdDeltaF6均由苏州大学心血管病研究所胡士军教授馈赠。
1.1.2 试验动物模型
①rAAV2-PL3在小鼠子宫表达规律试验:试验组,30只8周龄雌鼠随机分为5组,通过手术于两侧子宫角注射20 μL rAAV2-PL3,分别在5 d、2、4、6、8周采集子宫组织;对照组6只成年雌鼠注射20 μL PBS(阴性对照)。
②rAAV2-PL3/SCR干扰Plekhs1表达及对生殖影响试验:24只8周龄雌鼠随机分为2组,试验组通过手术从两侧子宫角注射20 μL rAAV2-PL3,对照组注射等体积rAAV2-SCR(空白对照);病毒注射两周后与昆明雄鼠合笼,隔夜发现栓块后单独饲养,见栓第4天每组随机取6只小鼠,采集子宫组织;每组剩余6只小鼠,继续饲养直至产仔,记录小鼠产仔数。
1.2 方法
1.2.1 rAAV2载体构建
在NCBI搜索小鼠Plekhs1基因转录本序列(NM_172641.3:80-1504);通过 thermofisher shR⁃NA设计网站设计5组Plekhs1 shRNA序列(见表1),送上海生工生物公司合成。MluⅠ、Bam HⅠ核酸内切酶双酶切AAV2质粒,琼脂糖凝胶电泳胶回收;合成shRNA片段退火;T4连接酶载体重新连接,连接产物转化到DH5α大肠杆菌感受态细胞,挑取单菌落送上海生工生物公司测序。
1.2.2 rAAV2制备
293T细胞接种150 mm培养皿中,细胞密度80%,10 mL 10%FBS DMEM/F12培养基;12 h后开始转染,转染体系:rAAV 12 μg、pAAV2.9 10 μg、pAdDeltaF6 6 μg、Opti培养基 600 μL、PEI(1 mg·mL-1)110 μL,6~8 h更换培养基;5%CO2、37℃,培养72 h后收集病毒(见图1D)。添加培养基1/80体积 0.5 mol·L-1EDTA(pH 8.0)消化细胞,收集细胞转移至15 mL离心管中,4℃2 000 g 10 min;去除上清液,将细胞转移至同1支离心管中,4℃2 000 g 5 min,去上清液;2 mL HBSS缓冲液吹散细胞,涡旋震荡2 min;液氮和37℃水浴锅快速冻融3次,每循环约10 min;4℃,5 000~7 000 g,10 min;使用Millex-HV(0.45 μm)过滤上清;上清转移至Amicon ultra-15(100 ku)滤器中,2 000 g,15℃,5 min,离心浓缩到合适体积(约200 μL)分装,-80℃保存。

表1 Plekhs1基因shRNA序列Table 1 shRNA sequence of Plekhs1 genes
1.2.3 rAAV2子宫角注射
8周龄性成熟雌鼠,腹腔注射200 μL盐酸赛拉嗪;麻醉后子宫角注射20 μL rAAV2-PL3,手术后连续1周腹腔注射10 000单位双抗。
1.2.4 绿色荧光成像检测
子宫冰冻切片(7 μm),55℃展片10~15 s;转移至4%多聚甲醛(PFA),暗环境固定1 h;1×PBS清洗3次,每次5 min;DAPI染色10 s,1×PBS清洗2次,每次5 min;抗荧光猝灭剂封片,避光放置,荧光显微镜下观察。
1.2.5 免疫组织化学检测
石蜡组织切片烘箱(60℃)烘片;脱蜡进水处理;柠檬酸钠修复液中抗原修复,3%H2O2处理;湿盒内10%马血清封闭;10%马血清稀释一抗孵育(Plekhs1(P-15),1∶100稀释)(GFP,1∶200稀释);二抗孵育(山羊抗兔IgG,1∶200),DAB显色,苏木精复染,稀盐酸分色,氨水反蓝;乙醇梯度脱水,二甲苯透明,中性树胶封片,显微镜观察。
1.2.6 小鼠子宫内膜上皮原代细胞分离培养
发情期小鼠,取出子宫清洗干净后翻转子宫;子宫组织转移至0.2%胰酶消化液中:4℃1 h,室温60 min,37℃水浴30 min;终止消化,以105细胞密度接种至培养皿35 mm中;37℃,5%CO2培养箱培养20~30 min,未贴壁细胞悬液转移至新培养皿(35 mm)中,去除基质细胞。
1.2.7 RNA提取、逆转录、Real-time PCR
TRIzol法提取总RNA,Nano Drop 2000c测RNA浓度;promega GoScript™ Reverse Transcrip⁃tion Mix逆转录试剂盒逆转录;real-time PCR使用TaKaRa试剂盒TB Green®Premix Ex Taq,Plekhs1引物序列:Forward Primer-GTTCAAGTGCCACCCA⁃GATG,Reverse Primer-TTCTCCTGTCATGGCCAAT;GAPDH引物序列:Forward Primer-GCCTTCCGT⁃GTTCCTACCC Reverse Primer-ACCTTTGGGCTTAC TCCA。PCR 在 Amplied Biosystems®7300 Real-Time PCR System仪器中反应,以GAPDH基因为内参,以 2-ΔΔCT作数据分析。
1.2.8 统计分析
GraphPad Prism 5.0软件绘图并分析数据。数据用Mean±SEM表示,组间比较采用Student's t检验,检验水准(α)为0.05。
2 结果与分析
2.1 rAAV2载体构建及病毒包装
AAV2病毒基因组质粒载体见图1 A,合成shR⁃NA片段(见表1)插入Bam HⅠ、MluⅠ酶切位点之间,shRNA由U6启动子启动,载体上有外源插入EGFP组件。质粒双酶切后经琼脂糖凝胶电泳鉴定获得约5 000 bp条带,参照阴性对照,酶切结果符合预期结果(见图1B);T4连接酶将酶切载体与退火合成shRNA片段重新连接,连接产物转入DH5α感受态细胞,挑取单菌落送上海生工生物公司测序,测序结果与设计shRNA序列一致(见图1C),重组载体构建成功,载体重新命名为rAAV2-GFP-shRNA-Plekhs1;rAAV2-GFP-shRNA-scramble;重组病毒质粒与两个辅助质粒通过PEI转染试剂共转染293T细胞中,转染48 h后荧光显微镜观察(见图1 D),293T细胞状态良好,EGFP在细胞中高表达,说明病毒基因组质粒在细胞中表达。

图1 rAAV2载体构建及病毒包装Fig.1 rAAV2 vector construction and virus packaging
2.2 rAAV2侵染小鼠子宫上皮原代细胞
rAAV2侵染小鼠子宫内膜上皮原代细胞,48 h后荧光显微镜观察细胞侵染率达100%(见图2A、B),结果表明2型腺相关病毒可有效侵染小鼠子宫内膜上皮细胞;Real-time PCR检测各组rAAV2沉默Plekhs1基因表达效果,每组cDNA样品3组平行样,其中rAAV2-PL3沉默效果显著(见图2C),制备高浓度rAAV2-PL3用于在体注射试验。

图2 rAAV2介导的Plekhs1 shRNA抑制Plekhs1基因表达Fig.2 Plekhs1-shRNA mediated by rAAV2 inhibits Plekhs1 gene expression
2.3 探究rAAV2-PL3注射小鼠子宫表达规律
小鼠子宫角注射rAAV2-PL3,不同时间点观察病毒侵染效果,通过荧光检测、EGFP基因免疫组化检测(见图3)发现随侵染时间延长,EGFP信号持续增强,信号主要在腔上皮和腺上皮细胞中表达,阴性对照注射同体积PBS,子宫组织中无EGFP信号出现,子宫角注射病毒5 d即可检测到EGFP信号,转染6周信号最强,8周仍可检测到较强表达信号。
2.4 rAAV2-PL3沉默Plekhs1基因表达
由图4可知,通过免疫组化试验检测发现,注射PBS阴性对照组见栓第4天小鼠子宫组织中EGFP不表达,Plekhs1在上皮细胞中表达(见图4A、C);注射rAAV2-PL3见栓第4天小鼠子宫中EGFP表达,Plekhs1不表达(见图4B、D);通过Real-time PCR技术检测发现注射rAAV2-PL3小鼠子宫比注射rAAV2-SCR小鼠Plekhs1表达明显降低(见图4E),表明Plekhs1被成功在体内抑制。
2.5 注射rAAV2-PL3后产仔数统计
小鼠子宫角注射rAAV2-PL3 2周后,与正常雄鼠交配,隔天早上检查阴道栓,见栓21 d后统计小鼠出生情况。由表2可知,注射rAAV2-PL3试验组小鼠产仔数分别为3、6、6、7、5只;注射rAAV2-SCR对照组小鼠产仔数分别为12、11、12、10、11只;可见试验组比对照组产仔数减少,说明干扰Plekhs1对生殖有较大影响。F1代小鼠生育情况统计学分析,注射rAAV2-PL3小鼠产仔数明显减少(P<0.05)(见图5)。
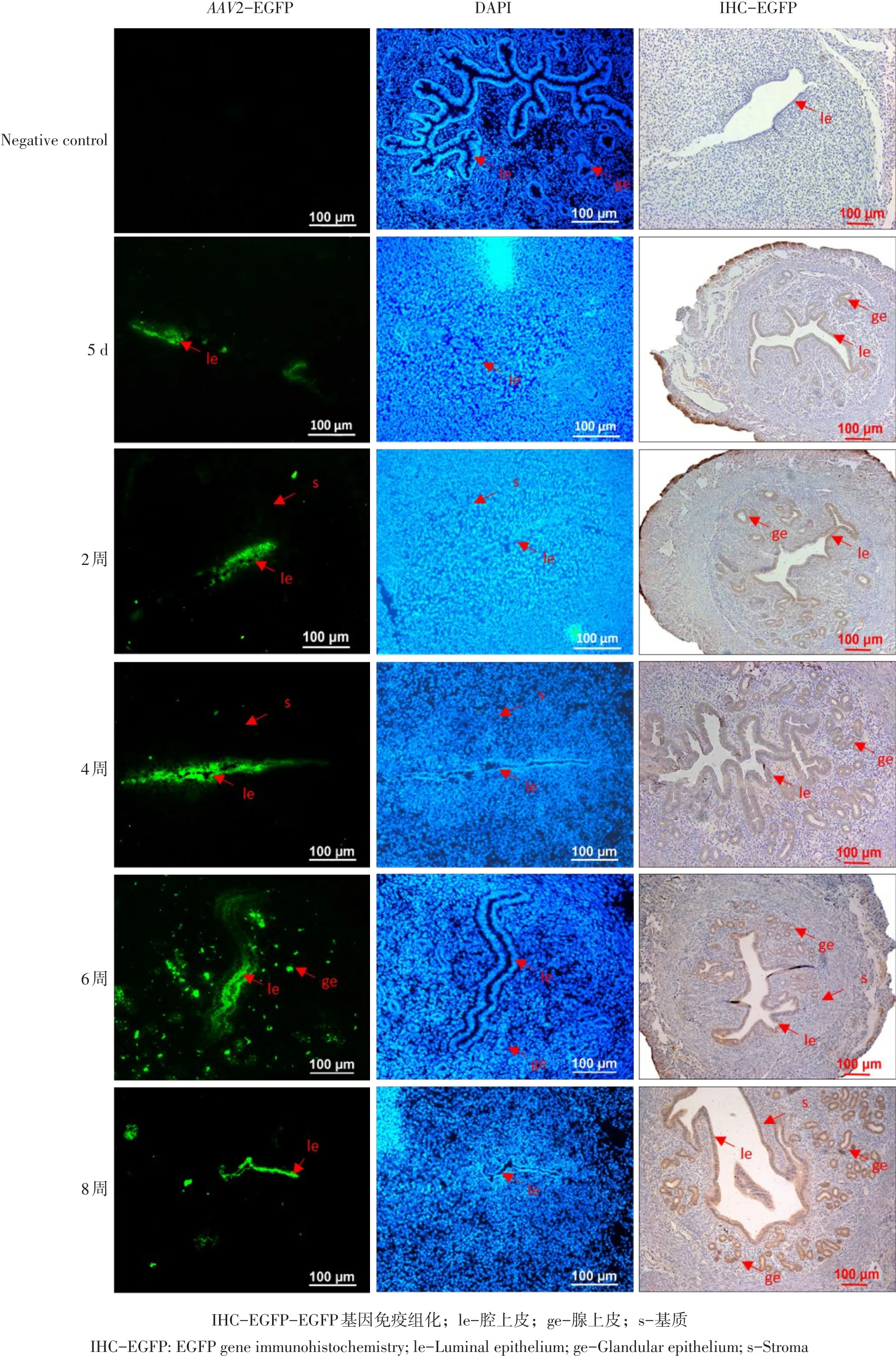
图3 rAAV2-PL3病毒侵染小鼠子宫EGFP表达规律Fig.3 Expression pattern of EGFP in mouse uterus infected by rAAV2-PL3 virus

图4 rAAV2-PL3沉默子宫上皮Plekhs1表达Fig.4 rAAV2-PL3 silences uterine epithelial Plekhs1 expression

表2 子宫腔注射rAAV2-PL3/SCR病毒小鼠,F1代生育统计Table 2 Uterine cavity injection virus mice,fertility statistics of F1generation
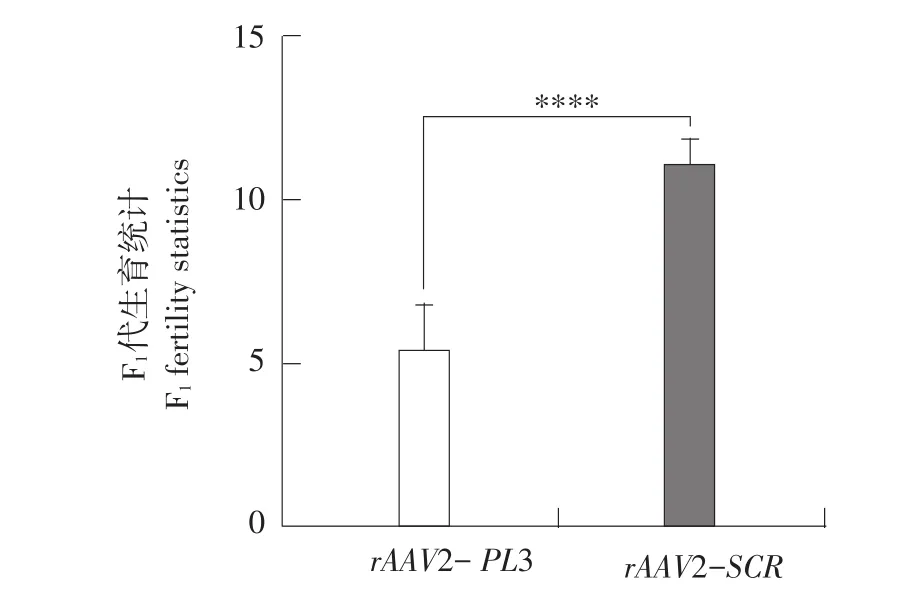
图5 F1代生育情况统计分析Fig.5 F1generation statistical analysis of fertility
3讨 论
随着基因工程技术快速发展,条件性基因敲除鼠成为研究某一基因在体内功能重要方法,但制作条件性基因敲除鼠费时费力[12]。腺相关病毒作为最有潜力基因治疗载体可在多种组织中稳定表达外源基因,感染分裂细胞和非分裂细胞,在体内长期表达且对人体无致病性,因此AAV为一种安全病毒载体[13]。腺相关病毒在子宫基因功能应用目前尚无报道。
3.1 重组腺相关病毒制备及沉默Plekhs1效果筛选
RNAi特异性沉默基因表达,广泛应用于基因功能研究领域。将双链小干扰RNA(siRNA)高效传递至体内靶细胞是RNAi成功用于疾病治疗的关键。腺相关病毒载体介导RNAi成功解决这一难题,同时有效解决RNAi转染效率低、转基因表达时间短、成本高等问题[14]。Wakimoto等将AAV-shRNA应用于小鼠心脏疾病研究[15]。Plekhs1为小鼠子宫上皮特异性表达基因,与子宫接受态转化密切相关[11]。本研究针对Plekhs1 mRNA设计shRNA序列,成功构建、包装rAAV2病毒;侵染小鼠子宫内膜上皮原代细胞,Real-time PCR筛选沉默效果最强rAAV2-PL3病毒。
3.2 检测子宫角注射rAAV2-PL3表达规律
注射方式为腺相关病毒介导基因在靶细胞转染效率关键因素。心血管疾病研究发现,尾静脉注射AAV9对心脏组织有较强感染能力,同时在脑组织、肺组织、肝脏组织也有较强感染能力,影响试验结果,王惠等通过心肌层注射方法增加病毒在心脏组织分布并长期表达[16]。Chen等静脉注射AAV在子宫表达量低,表达时间短,难以满足试验需要[9]。本研究首先验证腺相关病毒rAAV2-PL3直接子宫角注射有利于条件性靶向转染子宫细胞。通过荧光检测、免疫组化技术检测发现,转染第5天在腔上皮检测到EGFP信号,转染6周时信号最佳,随着转染时间延长EGFP信号不断增强,累积效果明显,信号显示范围扩大。值得注意的是,病毒侵染信号主要集中在腔上皮和腺上皮细胞,上皮结构完整,表明上皮基底膜细胞可作为屏障阻止病毒颗粒侵染基质细胞[10]。
3.3 rAAV2-PL3沉默子宫上皮Plekhs1表达及对生育影响
马珍子等研究发现正常妊娠过程中见栓第4天腔上皮细胞PLEKHS1高表达[11],本研究通过免疫组化技术检测rAAV2-PL3感染小鼠见栓第4天子宫细胞Plekhs1表达,发现小鼠子宫腔上皮细胞Plekhs1蛋白表达明显减弱;通过Real-time PCR进一步验证Plekhs1已被沉默。研究人员检测AAV侵染后的生殖细胞及子代体内病毒基因表达,研究腺相关病毒在生殖系统应用是否存在安全问题。Calcedo等发现在新生儿体内即可检测到AAV抗体,野生型AAV侵染人体是必然事件[17];Couto等利用AAV2侵染小鼠成熟精子,人工受精后胚胎移植,在后代中未检测到AAV2基因表达,表明AAV2无法整合于生殖细胞[18]。本研究子宫角注射对照病毒rAAV2-SCR,小鼠产仔数量未受影响,表明子宫角注射腺相关病毒方法对子宫功能无影响。为验证rAAV2-PL3沉默Plekhs1表达是否对小鼠生育能力造成影响,统计注射rAAV2-PL3与对照病毒rAAV2-SCR小鼠产仔数,分析发现注射rAAV2-PL3小鼠产仔量比对照组减少约50%。结果表明,沉默Plekhs1表达降低生育能力,Plekhs1在妊娠过程中发挥重要作用。
综上,腺相关病毒介导shRNA通过子宫角注射是实现子宫特定基因条件性干扰的可行方法,有助于研究妊娠过程子宫基因潜在功能。但因腺相关病毒无法突破阻碍进入子宫基质,研究子宫基质细胞基因功能的方法需进一步完善。

