番茄茎基腐病病原菌分离及其防治药剂筛选
尉菊萍 王洪梅 刘磊 吕令华


摘要:为筛选防治番茄茎基腐病的有效药剂,本研究从番茄病株中分离病原菌,测定其致病性,同时评价9种市售药剂对该病病原菌的室内毒力,并从中选择室内毒力大的药剂进行番茄茎基腐病的田间防效试验。结果表明:番茄茎基腐病的病原菌归属于细菌;9种供试药剂中,50%琥铜·霜脲氰WP的毒力最大,EC50为432.76 mg/L,高浓度下的抑制率可达100%;田间试验结果表明该药剂防治茎基腐病的效果最好,能显著降低病株率,防效达85.71%。因此,50%琥铜·霜脲氰WP对番茄茎基腐病病原菌具有较好的抑制作用,可作为田间防治该病的候选药剂。
关键词:番茄茎基腐病;致病性测定;毒力测定;防治效果
中图分类号:S482.2文献标识号:A文章编号:1001-4942(2020)05-0105-05
Abstract In order to screen out effective bactericides for tomato stem-based rot, the pathogenic strains were isolated from infected plants, and their pathogenicity was determined. The effect of 9 common bactericides in the market on tomato stem-based rot was determined in laboratory in order to screen the effective one for field tests. The results showed that the pathogen of tomato stem-based rot belonged to bacteria. Among the 9 tested bactericides, 50% cuprous succinate·hydrocyanide had the most virulence with the EC50 as 432.76 mg/L, and its inhibition rate was 100% under high concentration. The results of field experiment also showed that 50% cuprous succinate·hydrocyanide WP had the best control effect on stem-based rot, which could significantly decrease the diseased plant rate with the control efficiency as 85.71%. Therefore, 50% cuprous succinate·hydrocyanide WP had better inhibitory effect on the pathogen of tomato stem-based rot, so it could be used as a candidate agent for controlling tomato stem-based rot in field.
Keywords Tomato stem-based rot; Pathogenicity test; Toxicity determination; Control effect
近年来,农业产业结构调整以及市场需求的增加促进了设施番茄产业的发展。但由于全球气候变暖,同时缺乏合理的轮作倒茬制度,番茄茎基腐病发生程度逐年加重,果实品质和产量受到严重影响。这已成为限制设施生产的重要问题。番茄茎基腐病主要危害植株茎基部,一般在第1~3穗果时发生,发病初期茎基部土表以上3~5 cm处出现深褐色病斑[1],茎秆发病部位向内凹陷、皮层腐烂,地上部叶片变黄,出现中午萎蔫、早晚恢复的现象[2],但后期萎蔫不能恢复,直至整株枯死[3,4];病部常形成黑褐色、大小不一的菌核[5],可蔓延至主侧根,湿度大时上有白色霉层出现[6]。该病是土传病害,病菌在土壤中越冬,腐生性强,可在土中生存2~3年[7,8]。
导致番茄植株发生茎基腐病的因素有很多,如高温、田间管理粗放、根茎部有伤口等。另外,秧苗定植后浇水过多、土壤黏重、通风排湿不畅等也会引起该病发生[2]。特别是大棚越夏番茄定植时,正处于高温时期,土壤水分蒸发快,加之浇水过多,可形成高温高湿的棚内环境,极易引起植株发病。轻者病株率为5%~10%,一般为20%~30%,严重时达50%以上。目前,化学防治仍是防治番茄茎基腐病的主要方法。祁凯等[3]研究不同药剂对番茄茎基腐病室内活性的影响时发现,双胍三辛烷基苯磺酸盐抑菌活性最强,可应用于生产。王广印等[9]采用“可立克”药肥对秋番茄秧苗进行喷灌根处理后茎基腐病发病率为零,“棉隆+生物菌”处理土壤可使发病率降低79.62%。本研究对番茄茎基腐病病原菌进行分离和致病性测定,评价9种市售药剂对该病病原菌的室内毒力,并选择室内毒力大的药剂进行番茄茎基腐病的田间防效试验,以期筛选出有效、可用于生产的番茄茎基腐病防治药剂。
1 材料与方法
1.1 试验材料
供试番茄品种菏粉2号,正常植株和病株均种植于菏泽市农业科学院蔬菜试验田,病株具有典型茎基腐病表现。
供试YEB液体培养基:每升含牛肉浸膏5.0 g、酵母浸膏1.0 g、蛋白胨5.0 g、蔗糖5.0 g、MgSO4·H2O 0.5 g。YEB固体培养基:在上述配方基礎上加入15.0 g琼脂。以上两种培养基均经121℃灭菌20 min后用于病原菌的分离、纯化及培养。
1.2 主要试剂
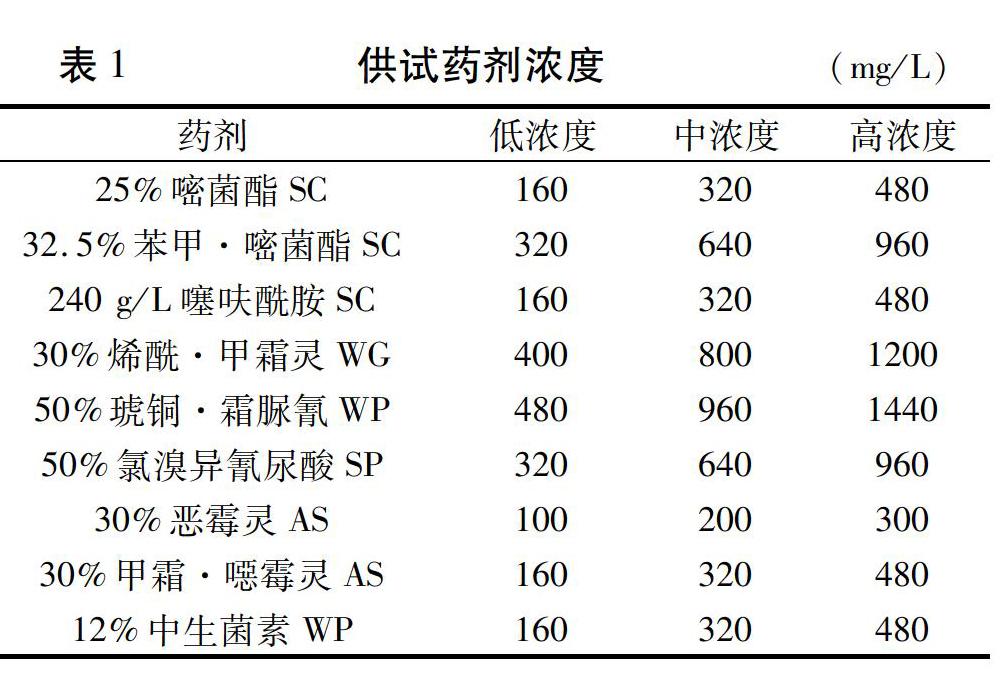
供试药剂:25%嘧菌酯悬浮剂,江西欧美生物科技有限公司产品;32.5%苯甲·嘧菌酯悬浮剂,江西众和化工有限公司产品;240 g/L噻呋酰胺悬浮剂,江西众和化工有限公司产品;30%烯酰·甲霜灵水分散粒剂,广东中迅农科股份有限公司产品;50%琥铜·霜脲氰可湿性粉剂,河北省万泉农药厂产品;50%氯溴异氰尿酸可溶粉剂,南京南农农药科技发展有限公司产品;30%恶霉灵水剂,中农立华(天津)农用化学品有限公司产品;30%甲霜·噁霉灵水剂,中农立华(天津)农用化学品有限公司产品;12%中生菌素可湿性粉剂,福建凯立生物制品有限公司产品。
1.3 试验方法
1.3.1 病原菌的分离与纯化 将病株在自来水下冲洗干净,75%酒精浸泡30 s;再置于无菌操作台中,用灭菌刀片切取茎基部病健交界处1 cm左右茎段,放入YEB液体培养基,于37℃、200 r/min摇床中振荡培养12 h。使用灭菌接种环蘸取上述培养溶液,采用平板划线法,涂布于YEB固体培养基上,28℃、黑暗、倒置培养12 h。挑选具有代表性的单菌落进行纯化培养,对纯化后的目标菌株编号,并采用斜面保存法,4℃保存备用。
1.3.2 病原菌致病性测定根据柯赫氏法则进行接种试验[10],测定纯化菌株的致病性。具体步骤如下:将纯化菌株培养12 h后配制成菌悬液,接种前浇足水,用玻璃棒在距茎基部2 cm处扎1个深约3 cm的孔,用移液枪将10 mL菌悬液注入孔内[11],以无菌水为对照,重复3次,每重复包含10株幼苗。接种后置于温室中培养,白天24~27℃、夜间20~22℃,常规水分管理,7 d后调查发病情况,观察是否出现褐色病斑、萎蔫和腐烂等症状,并计算发病率。将发病部位按照1.2.1的方法再进行分离培养,观察该部位分离得到的病菌与接种菌是否一致。
1.3.3 供试药剂的室内毒力测定采用生长速率法进行室内毒力测定[12]。将各药剂用无菌水分别配制成10倍于试验所需浓度(表1)的母液,以1∶9的体积比分别加至不同的YEB培养基(灭菌后冷却至45℃)中,充分摇匀后制成含药平板,以加入等量无菌水的为对照,重复3次。
取涂布培养病原菌的YEB固体培养基,用直径0.5 cm的打孔器打取菌饼,再用接种针挑取菌饼至含药平板中央。28℃黑暗培养7 d后,采用十字交叉法测量菌落直径,计算菌落生长抑制率。计算公式:
对照菌落直径-处理菌落直径对照菌落直径-菌饼直径×100 。
根据药剂浓度与菌落直径的关系,将药剂抑制率转换成抑制几率值(y),药剂各浓度转换成以10为底的对数值(x),计算毒力回归方程、相关系数和EC50值。
1.3.4 田间防治试验于菏泽市农业科学院蔬菜试验田大拱棚进行。选择室内毒力试验中毒力较大的50%琥铜·霜脲氰WP、30%甲霜·噁霉灵AS和30%恶霉灵AS,按照田间推荐使用浓度配制上述药剂,即50%琥铜·霜脲氰WP 700倍液、30%甲霜·噁霉灵AS 1 000倍液、30%恶霉灵AS 1 000倍液,育苗前以1∶500的比例拌入基质土壤,并在定植当天灌至幼苗根部[11]。每株灌入50 mL,以浇等量水为对照,每处理重复3次。小区面积20 m2,定植75株番茄幼苗,随机区组排列。15 d后记录发病株数,并计算病株率和防效[13]。计算公式:
1.4 数据分析
采用Microsoft Excel 2013和DPS 15.0软件进行数据统计与分析。
2 结果与分析
2.1 病原菌培养性状观察
在YEB固体培养基上28℃、黑暗、倒置培养12 h后,病原菌单菌落直径为0.1~0.2 cm;菌落呈圆形、乳白色,表面光滑隆起,边缘整齐;菌落聚集区域培养基不变色(图1)。
2.2 病原菌致病性测定
由图2可以看出,接种7 d后,番茄幼苗表现出明显的感病特征。与对照相比,感病幼苗发生萎蔫,长势较弱,叶片变黄,茎基部中空纤细,出现褐色病斑且有轻微腐烂现象。这与田间感染番茄茎基腐病植株表现症状一致。经计算,3个重复的发病率分别为80%、90%、80%,平均发病率为83.33%(表2)。
挑取上述病株发病部位进行病菌分离、培养后发现,该病菌与接种菌形态基本一致,根据柯赫氏法则,判定该菌为番茄茎基腐病病原菌。
2.3 供试药剂室内毒力测定结果
由表3可以看出,培养7 d后,对照的菌落直径为1.44 cm,各药剂处理的则在0.50~1.40 cm之间,因此,不同药剂对菌落生长均有一定抑制作用。
药剂使用浓度越高,对番茄茎基腐病病原菌的抑制率越大,且部分藥剂在不同浓度下的抑制率差异达显著水平。9种药剂中,50%琥铜·霜脲氰WP对病原菌的抑制效果最好,高浓度(1 440 mg/L)下的抑制率达到100%,低浓度(480 mg/L)下的抑制效果较差;30%甲霜·噁霉灵AS的抑制效果次之,其在160、320、480 mg/L时的抑制率分别为38.21%、58.80%、78.23%;12%中生菌素WP抑制效果最差,其在160、320、480 mg/L时的抑制率仅为4.93%、7.05%、27.12%。
EC50可用来表示药剂的毒力大小,其值越小,毒力越大。由表3可以看出,30%烯酰·甲霜灵WG的EC50值最高,为11 492.12 mg/L,毒力最小;50%琥铜·霜脲氰WP的EC50值为432.76 mg/L,毒力最大,是30%烯酰·甲霜灵WG的27倍;30%恶霉灵AS的EC50值为492.82 mg/L,毒力较大,是30%烯酰·甲霜灵WG的23倍;30%甲霜·噁霉灵AS的EC50值为569.39 mg/L,毒力也较大;其余药剂的毒力一般。
2.4 田间防治试验结果
由表4可以看出,对照的番茄幼苗发病率较高,病株率达28.00%,显著高于施药处理。施药15 d后,3种药剂对茎基腐病都有一定的防治效果,其中,50%琥铜·霜脲氰的病株率最低,仅为4.40%,防效达85.71%,显著高于其它药剂处理;30%甲霜·噁霉灵与30%恶霉灵之间的防效差异不显著。
3 讨论与结论
本试验通过对试验田内番茄茎基腐病病株进行病原菌的分离纯化和柯赫氏法则验证,确定分离菌株为番茄茎基腐病病原菌。经观察,该病原菌的菌落形态同细菌一致,且病株病斑处无白色霉层及菌核出现,进而推断其归属于细菌界。吴丽敏[7]、张怡[14]等认为番茄茎基腐病病原菌分别为茄丝核菌(Rhizoctonia solani)和镰孢属茄镰孢,均属于真菌。这与本试验结果明显不同,分析其原因可能是茎基腐病的病原菌并非仅有一种,可能既包括细菌,也包括真菌。而本试验得到的病原菌形态上更接近细菌,推测可能与植株移栽方式、土壤环境及取样时期有关。后续研究将对该病原菌进行分子生物学鉴定加以验证。
本研究发现9种供试药剂对番茄茎基腐病病原菌均有一定抑制作用,且抑制能力与药剂使用浓度正相关。其中50%琥铜·霜脲氰WP表现出较强的抑制效果,高浓度下的EC50值最低,毒力最大,抑制率可达100%。田间试验结果同样表明50%琥铜·霜脲氰WP防治番茄茎基腐病的效果最好,可有效降低病株率,防效达85.71%,显著高于其它药剂。综合来看,9种供试药剂中50%琥铜·霜脲氰WP对番茄茎基腐病的防治效果最佳,30%恶霉灵AS和30%甲霜·噁霉灵AS较好。
50%琥铜·霜脲氰主治细菌性病害,生产上多用于防治黄瓜霜霉病和细菌性角斑病,尚未有关于防治番茄茎基腐病的研究报道。本研究中,番茄茎基腐病的病原菌属于细菌,所以该药剂的防治效果较好,具体作用机理仍有待于进一步研究。此外,霜脲氰在土壤中消解速度较快,属于易降解农药,使用后对蔬菜较安全[15,16]。因此,50%琥铜·霜脲氰可湿性粉剂可作为田间防治番茄茎基腐病的候选药剂,但在生产中还应该结合调整倒茬制度、加强田间管理等方法进行综合防治。
参 考 文 献:
[1] 刘志恒,马家瑞,杨红,等.番茄茎基腐病病原菌的生物学特性[J].植物保护,2010,36(2):94-97, 101.
[2] 刘志福.冀西北大棚越夏番茄茎基腐病综合防治技术[J].农业与技术,2015,35(7):105-106.
[3] 祁凯,张博,张悦丽,等.几种药剂对番茄茎基腐病的室内和田间防治效果[J].山东农业科学,2018,50(2):116-118.
[4] 王欣.温室秋冬茬番茄茎基腐病的预防[J].农业技术与装备,2017(8):56-57.
[5] 陈永杰,陈涛,薄晓峰,等.药土围根法预防番茄茎基腐病的效果[J].山西农业科学,2019, 47(2): 262-264.
[6] 孙淑敏.警惕番茄茎基腐病发生[N].江苏农业科技报,2015-10-28.
[7] 吴丽敏,安心.番茄茎基腐病致病菌的鉴定[J].吉林蔬菜,2014(1):38-39.
[8] 王贵仁. 4措施防治番茄茎基腐病[N].河北农民报,2016-03-01.
[9] 王广印,郭卫丽,陈碧华,等.大棚秋番茄茎基腐病防控试验[J].西北农业学报,2019,28(1):66-78.
[10]王妮,尹显慧,彭丽娟,等.辣椒炭疽病病原鉴定及其杀菌剂毒力测定[J].植物保护,2019,45(4):216-223.
[11]韩帅,张河庆,吴婕,等.四川主要辣椒栽培品种对疫病的抗性鉴定及评价[J].中国蔬菜,2019(7):56-61.
[12]戴启东,李广旭,杨华,等.6种杀菌剂对蓝莓采后灰葡萄孢菌的室内毒力测定[J].辽宁农业科學,2019(4):19-22.
[13]甘林,卢学松,兰成忠,等.9种除草剂对玉米田杂草的防除效果及其安全性评价[J/OL].农药学学报:1-12[2019-12- 25].https://doi.org/10.16801/j.issn.1008-7303.2020.0029.
[14]张怡,李幸,董正伟,等.番茄茎腐病菌的分子鉴定及致病力检测[J].植物保护,2018,44(4):132-137.
[15]张汝美,王长强,陈永健.60%丙森锌·霜脲氰可湿性粉剂对黄瓜霜霉病的防治效果[J].山东农业科学,2009(10):64-65.
[16]刘同金,李瑞娟,宋国春, 等.25%甲霜灵·霜脲氰水分散粒剂在辣椒和土壤中的残留行为及安全使用评价[J].山东农业科学,2017,49(7):149-154.

