‘棉梨’染色体倍性鉴定
李春兰 牛莹莹 吴玉霞 周奥特 宋金龙 曾甜 何天明

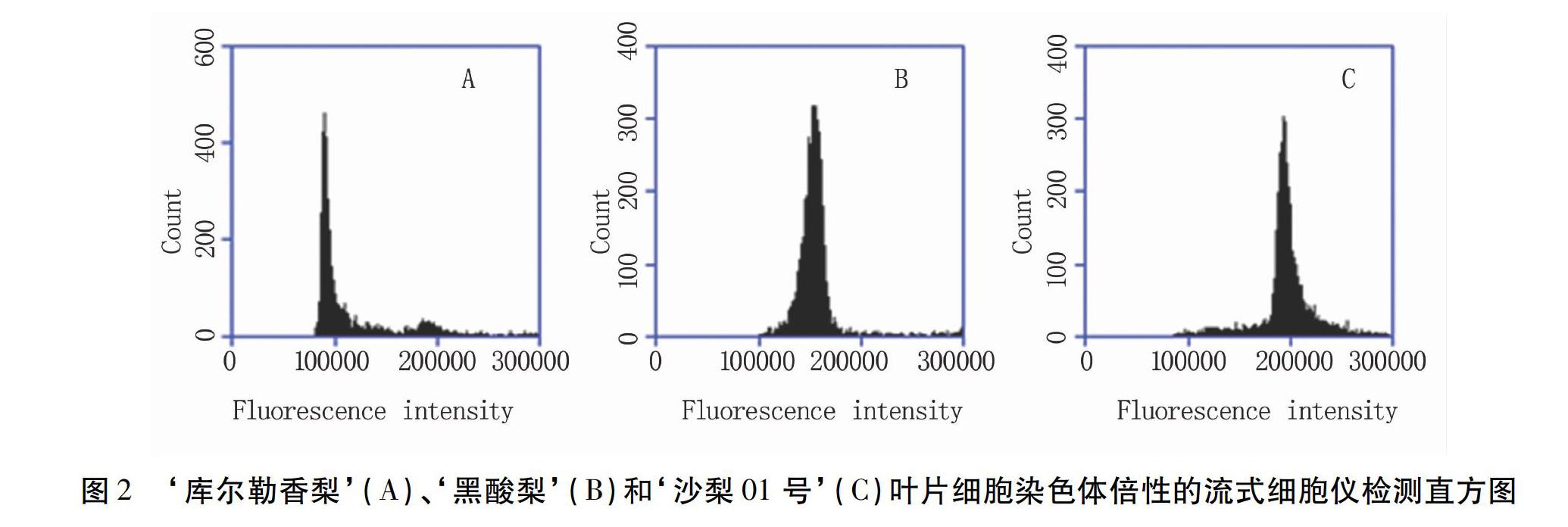

摘要:以‘库尔勒香梨、‘黑酸梨、‘沙梨01号为对照,利用流式细胞仪和根尖压片法对‘棉梨的染色体倍性进行鉴定,以期为梨种质资源的创新和利用提供参考。结果表明:根尖压片得出‘库尔勒香梨、‘黑酸梨、‘沙梨01号以及‘棉梨的染色体数目分别为34、51、68以及34,‘棉梨的染色體数目与二倍体的‘库尔勒香梨相同;利用流式细胞仪得出‘库尔勒香梨、‘黑酸梨、‘沙梨01号以及‘棉梨均出现了一个峰,且峰值比为1.0∶1.5∶2.0∶1.0,即各梨品种叶片细胞中DNA相对含量为 2C∶3C∶4C∶2C。综上可得:‘棉梨的染色体数目为2n=2X=34,为单纯的二倍体。
关键词:棉梨;流式细胞仪;染色体倍性;根尖压片法
中图分类号:S661.201文献标识号:A文章编号:1001-4942(2020)05-0016-05
Abstract With pear varieties Korla Fragrant Pear, Heisuanli and Shali 01 as internal reference standards, the ploidy of Mianli (Pyrus sinkiangensis) was identified by flow cytometry and root-tip squashing methods. The objective was to provide references for the innovation and utilization of pear germplasm resources. The results showed that the chromosome numbers of Korla Fragrant Pear, Heisuanli, Shali 01 and Mianli were 34, 51, 68 and 34, and the chromosome number of Mianli was the same as that of Korla Fragrant Pear. In addition, one peak was obtained in Korla Fragrant Pear, Heisuanli, Shali 01 and Mianli by flow cytometry, and the peak ratio was 1.0∶1.5∶2.0∶1.0, that was, the relative DNA content in the leaf cells of each pear variety was 2C∶3C∶4C∶2C. In conclusion, the chromosome number of Mianli was 2n=2x=34, a simple diploid.
Keywords Mianli; Flow cytometry; Chromosome ploidy; Root-tip squashing method
新疆是我国重要的梨产区,也是世界梨种质资源的富集区[1],拥有许多珍贵的梨种质资源,如闻名中外的商业化栽培良种‘库尔勒香梨[2],罕见的三倍体梨品种‘杏叶梨(Pyrus armeniacaefolia)[3]和具雄性不育特性的有性杂交新品种‘新梨7号[4]。另外,新疆境内广泛分布的新疆梨(Pyrus sinkiangensis Yu)品种群分属我国五大栽培梨系统之一[2]。
近年,本课题组在新疆梨普查中发现了具单性结实特性的新种质——‘棉梨,初步的田间授粉试验表明该品种具无融合生殖特性。具无融合生殖特性的种质可产生与母本基因型相同的无性种子,作为优良砧木利用潜力巨大,前景广阔,所以对‘棉梨这一特殊的生殖特征进行深入研究十分必要。然而,学术界对梨无融合生殖研究甚少,仅见前苏联学者的一篇报道[5]。但人们对苹果属植物的无融合生殖研究已较为深入,这无疑对同为蔷薇科的梨属植物无融合生殖研究颇具参考价值[6-8]。在苹果属中,具无融合生殖的皆为多倍体野生种[9]。许多学者认为,植物的无融合生殖与其多倍性相关[10,11]。所以,要探究‘棉梨无融合生殖遗传特性,先行鉴定其染色体倍性是很有必要的。
植物倍性鉴定是倍性育种及其应用的重要一环,如何简便、准确地鉴定出植株倍性水平,从而大大减少育种的工作量及盲目性,降低成本,加速育种进程,在农作物倍性育种中具有重要意义。目前,最常用的植物倍性鉴定方法仍是分子水平的鉴定和直接染色体计数,即流式细胞计数法和常规压片法。染色体计数是传统的、最直接的确定植物倍性的方法[12],此法能直观鲜明地观察染色体形态和数量,但对于染色体小且数目较多的属下种而言,染色体计数较为困难,需借助其他方法[13]。20世纪80年代以来,流式细胞仪问世,以能够快速鉴定植物的染色体倍性水平,特别适用于样品较多时的倍性检测分析[14],不受植物取材部位和细胞所处时期限制,而且可以直接观测嵌合体和混倍体图像等优势,很快在植物遗传和育种中得到了广泛应用,但其缺点是无法直接观测到染色体的数量及形态特征[15]。鉴于此,本研究将流式细胞仪检测法与根尖压片法相结合,以倍性已知的新疆梨二倍体品种‘库尔勒香梨[16]、四倍体品种‘沙梨01号[17-19]和三倍体品种‘黑酸梨[20]为内参,对‘棉梨的染色体倍性进行了系统研究, 旨在为今后探讨‘棉梨无融合生殖的遗传机制和鉴定杂交后代倍性提供必要的技术支持和本底资料。
1 材料与方法
1.1 试验材料
本研究于2017—2019年在新疆农业大学果树生物学研究中心完成。供试梨种质为‘棉梨、二倍体‘库尔勒香梨、三倍体‘黑酸梨、四倍体‘沙梨01号,选取其经种子培育而成的实生苗及新疆轮台国家果树资源圃保存的20年生成龄梨树种子,用流式细胞仪和根尖压片法测定染色体倍数。供试品种的砧木均为杜梨,果园管理水平中等。
流式细胞仪分析法作为一种生物染色体间接鉴定方法,可检测植物嵌合体或混倍体的存在,缺点是无法直接观测到染色体的数量和形态[13,32]。如田路明等[20]以叶片为材料,运用流式细胞仪测得的结果是‘沙梨01号为二倍体与四倍体的嵌合体;而黄礼森等[17]以根尖为材料用去璧低渗法鉴定出‘沙梨01号是纯四倍体, Lin 和 Fang[18]也用同法鉴定出‘沙梨01号是纯四倍体。本研究用压片法和流式细胞仪相结合也鉴定出‘沙梨01号为纯四倍体。但‘沙梨01号是否存在二倍体与四倍体嵌合的现象尚待确证。在本试验中,‘沙梨01号仅作为四倍体梨的内参标样,其倍性争议对靶标二倍体品种‘棉梨的倍性鉴定结果并无实质性影响,但作为一个有争议的四倍体,对其染色体倍性进行深入研究很有必要。
用流式细胞仪测得‘黑酸梨与二倍体‘库尔勒香梨峰值比为1.5∶1.0,即‘黑酸梨叶片细胞C值水平为3C,用根尖压片法观测得出‘黑酸梨染色体数目为51,两种方法均得出其细胞倍性为三倍体。这与田路明等[20]以叶片为材料用流式细胞仪检测出‘黑酸梨为三倍体的结果一致。
4 结论
本研究以具有代表性倍性值的新疆地方梨品种‘库尔勒香梨、‘黑酸梨、‘沙梨01号为对照,利用流式细胞仪和根尖压片法对具有特殊生殖方式的‘棉梨进行染色体倍性鉴定,其结果一致,均显示‘棉梨染色体数为34,是单纯的二倍体,不存在嵌合体等特别的存在。综合得出:‘棉梨染色体数目为2n=2X=34,二倍体。在今后的研究中,我们将以此为标准,快速检测‘棉梨自然杂交后代和人工杂交后代染色体的倍性,以进一步探讨‘棉梨无融合生殖的遗传学特性。
参 考 文 献:
[1] 新疆植物志编辑委员会. 新疆植物志:第二卷,第二分册[M]. 乌鲁木齐: 新疆科技卫生出版社,1995.
[2] 张绍铃主编. 梨学[M]. 北京:中国农业出版社,2013.
[3] 陈瑞阳,李秀兰,佟德耀,等. 中国梨属植物染色体数目研究[J]. 园艺学报,1983,10(1): 13-17.
[4] 何天明,张琦. 新梨7号小孢子败育的解剖学观察[J]. 果树学报,2002,19(2): 94-97.
[5] ДолматовО, Джафарова В . Apomixis and the problem of obtaining haploids and homozygote diploids in pear (Pyrus communis L.)[J]. Cортовивчення та Cортознавство, 2013, 1(18): 22-25.
[6] Qu X L, Mao Z Q, Hu Y L, et al. Apomixis and ploidy of several crabapple cultivars, Malus Mill [J]. Acta Horticulturae, 2008, 769: 387-392.
[7] 劉阳,董文轩,张蕾,等.平邑甜茶(Malus hupehensis)胚囊种类与发生特性[J].果树学报,2006,23(3): 330-334.
[8] 杨晓红,周志钦.小金海棠雌蕊无融合生殖发育的解剖学结构观察[J]. 果树学报,2009,26(1):1-5.
[9] 韩振海.苹果矮化密植栽培理论与实践[M]. 北京:科学出版社,2011.
[10]Asker S, Jerling L. Apomixis in plants [M]. Boca Raton, FL: CRC Press, 1992.
[11]董绍珍. 苹果属植物与无融合生殖[J]. 果树科学,1987(4): 27.
[12]孙庆华,韩振海. 果树多倍体鉴定研究进展[J]. 山东农业科学,2008(2): 11-14.
[13]陈瑞阳,宋文芹,李秀兰.植物染色体标本制备的去壁、低渗法及其在细胞遗传学中的意义[J]. 遗传学报,1982,9(2): 151-159.
[14]Farnham M W. Doubled-haploid broccoli production using anther culture: effect of anther source and seed set characteristics of derived lines [J]. J. Amer Soc. Hort. Sci.,1998,123:73-77.
[15]Dolezel J, Bartos J. Plant DNA flow cytometry and estimation of nuclear genome size[J]. Annals of Botany, 2005, 95(1): 99-110.
[16]蒲富慎,黄礼森,孙秉钧,等.我国野生梨和栽培品种染色体数目观察[J]. 园艺学报,1985,12(3): 155-158.
[17]黄礼森,李树玲,丛佩华. 梨多倍体与二倍体性状比较[J]. 中国果树,1990(3): 30-31.
[18]Lin S H, Fang C Q. Studies on chromosome of Pyrus in China[J]. Acta Horticulturae, 1994,367:27-32.
[19]Sun Q R, Sun H Y, Li L G, et al. In vitro colchicine-induced polyploid plantlet production and regeneration from leaf explants of the diploid pear (Pyrus communis L.) cultivar ‘Fertility[J]. Journal of Horticultural Science & Biotechnology, 2009, 84(5):548-552.
[20]田路明,齐丹,曹玉芬.利用流式细胞仪鉴定梨种质资源染色体倍性[J].中国果树,2018(3): 29-32.
[21]刘敏,王卉,宁慧霞,等. 树上干杏染色体制片优化及核型分析[J]. 西北农业学报,2012, 21(10): 79-83.
[22]孙琪,廖康,耿文娟,等.新疆欧洲李种质资源染色体核型分析[J].西北植物学报,2015,35(6): 1153-1159.
[23]Loureiro J, Rodriguez E, Dolezel J, et al. Two new nuclear isolation buffers for plant DNA flow cytometry: a test with 37 species [J]. Annals of Botany, 2007, 100(4): 875-888.
[24]弓娜,田新民,周香艳,等. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报,2011,27(9): 21-27.
[25]Galbraith D W, Harkins K R, Maddox J M, et al. Rapid flow cytometric analysis of the cell cycle in intact plant tissues[J]. Science, 1983, 220(4601): 1049-1051.
[26]Isuzugawa K, Murayama H, Nishio T. Characterization of a giant-fruit mutant exhibiting fruit-limited polyploidization in pear (Pyrus communis L.)[J]. Scientia Horticulturae, 2014, 170: 196-202.
[27]Siena L A, Sartor M E, Espinoza F, et al. Genetic and embryological evidences of apomixis at the diploid level in Paspalum refum support recurrent auto-polyploidization in the species[J]. Sexual Plant Reproduction, 2008, 21(3): 205-215.
[28]Bicknell R A,Koltunow A M.Understanding apomixis:recent advances and remaining conundrums[J]. Plant Cell,2004,16:228-245.
[29]Hrandl E, Temsch E M. Introgression of apomixis into sexual species is inhibited by mentor effects and ploidy barriers in the Ranunculus auricomus complex[J]. Annals of Botany, 2009, 104 (1): 81-89.
[30]楊锋,伊凯,吴雅琴,等. 平邑甜茶无融合生殖基因型分析及雌配子发育模式研究[J]. 果树学报,2012,29(4):536-543.
[31]Arumuganathan K, Earle E D. Nuclear DNA content of some important plant species[J]. Plant Molecular Biology Reporter, 1991, 9(3):208-218.
[32]Arumuganathan K, Earle E D. Estimation of nuclear DNA content of plants by flow cytometry[J]. Plant Molecular Biology Reporter, 1991, 9(3):229-241.

