尼莫地平联合神经生长因子治疗脑出血的疗效及对血清HIF-1α、NSE水平的影响
李莉,董海青,贺建辉,李鑫,田宇慧,韦秋红
(保定市第一中心医院神经外科,河北 保定 071000)
脑出血是指由脑血管病变所致非创伤性血管破裂或损伤而引起的出血[1]。流行病学调查显示,脑出血患者75%以上存在高血压以及动脉粥样硬化疾病[2]。脑出血患者血管病变发展速度较快,发病时血肿可压迫局部神经组织,并触发局部炎症级联反应。研究表明,炎症级联反应可直接损伤内皮细胞,使血管壁的光滑程度发生显著改变,血栓形成风险显著增加[3]。神经生长因子是新型的临床神经营养药物,其能促进神经元细胞分化,改善新陈代谢能力,为患者的神经元修复提供良好的营养供给[4]。尼莫地平可显著改善脑出血患者的局部病灶部位的血液循环和血管痉挛,对促进脑细胞的新陈代谢能力具有重要意义[5]。缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)可通过与缺氧适应基因结合,促进缺氧蛋白的转录,是低氧适应以及病理反应的重要基础[6]。神经元特异性烯醇化酶(neuron specific enolase,NSE)在机体糖酵解过程中起重要作用[7]。目前,临床治疗脑出血较常用的药物为神经生长因子、尼莫地平,但关于尼莫地平联合神经生长因子治疗的研究较少。本研究旨在探讨尼莫地平联合神经生长因子治疗脑出血患者的疗效及对血清HIF-1α、NSE水平的影响,以为临床治疗提供科学依据。
1 资料与方法
1.1一般资料 回顾性分析2017年1月至2018年5月保定市第一中心医院收治的120例脑出血患者的临床资料,其中男69例,女51例,年龄30~45岁,平均(37±7)岁;体质指数21.1~24.9 kg/m2,平均(23.2±1.4) kg/m2;脑出血量12.3~16.9 mL,平均(14.4±2.1) mL;文化程度:小学及以下39例,中学或中专37例,大专及以上44例。根据改良Rankin量表评分[8]标准,患者的改良Rankin量表评分为2~5分,平均(3.3±1.3)分。上述患者按照治疗方法不同分为观察组和对照组,每组60例。两组患者的性别、年龄、体质指数等基础资料比较差异无统计学意义(P>0.05),见表1。本研究经保定市第一中心医院医学伦理委员会批准,患者均签署了知情同意书。
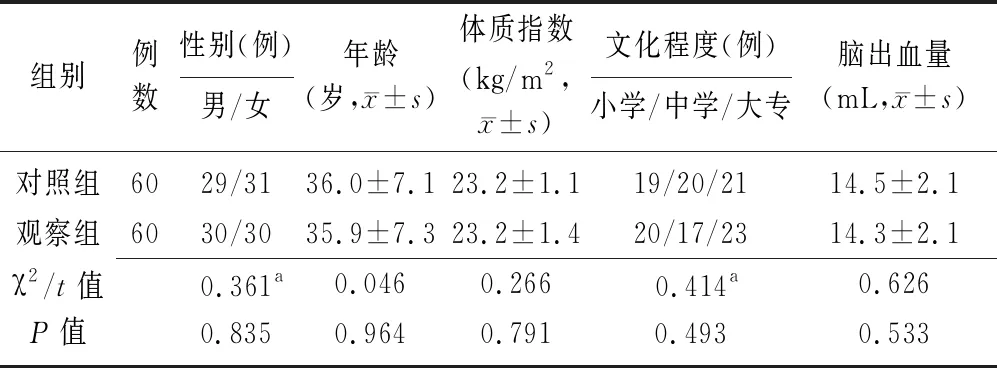
表1 两组脑出血患者的基础资料比较
对照组:单独使用尼莫地平治疗;观察组:在对照组的基础上联合使用神经生长因子进行治疗;a为χ2值,余为t值
1.2纳入与排除标准 纳入标准:①自发性脑出血;②年龄18岁以上;③发病时间小于6 h;④格拉斯哥昏迷指数[9]6分以上。排除标准:①急性心功能不全、先天性心脏病、原发性心肌病等非冠状动脉狭窄所致的心脏病;②脑血管病;③肝肾功能障碍;④自身免疫性疾病;⑤急性感染、慢性感染急性发作;⑥ 2型糖尿病;⑦活动性肺结核或恶性肿瘤;⑧已发生心力衰竭;⑨严重精神疾病。
1.3治疗方法 两组患者均采取抗凝血、减压、控制颅压,预防感染治疗。对照组单独使用尼莫地平(西安博爱制药有限责任公司生产,批号:20160825)口服治疗,每次40 mg,每日3次。观察组在对照组的基础上联合使用神经生长因子[厦门北大之路生物工程有限公司生产,批号:20160711,规格:18 μg(≥9 000 AU)/支]治疗,每日1次,每次18 μg,静脉滴注,4周为1个疗程,两组患者均连续治疗2个疗程。
1.4观察指标
1.4.1临床疗效 依据美国国立卫生研究院卒中量表(the National Institutes of Health stroke scale,NIHSS)进行评定[10]:NIHSS评分改善程度在90%以上为治愈,NIHSS评分改善程度在46%~90%为显著进步,NIHSS评分改善程度在18%~45%为好转,NIHSS评分改善程度在18%以下为无效。总有效率=(治愈例数+显著进步例数+好转例数)/总例数×100%。分别记录两组患者治疗前和治疗后3、5、7、10 d的NIHSS评分,NIHSS评分总计42分,评分越高,说明患者的神经功能损伤越严重[11]。
1.4.2实验室指标 分别采集两组患者的空腹肘部静脉血4 mL,离心半径15 cm、3 500 r/min离心15 min,取上清液,采用酶联免疫吸附测定法检测患者治疗前及治疗后10 d的HIF-1α、NSE水平,试验试剂购自上海罗氏诊断试剂公司(批号:20160502),操作流程严格按照说明书进行;使用酶联免疫吸附测定法检测患者治疗前及治疗后10 d的血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-8水平,试剂购自上海酶联生物有限公司(批号:20160411),操作过程严格按照说明书进行;采用酶联免疫吸附测定法检测患者治疗前及治疗后10 d的应激指标[血清肾素、肾上腺素(adrenaline,E)、血管紧张素 Ⅱ(angiotensin Ⅱ,Ang Ⅱ)及去甲肾上腺素(noradrenaline,NE)]变化,试剂购自上海罗氏诊断试剂公司(批号:20160430),操作过程严格按照说明书进行。
2 结 果
2.1两组患者的临床疗效比较 观察组的总有效率高于对照组[86.67%(52/60)比55.00%(33/60)](χ2=4.091,P=0.043),观察组的临床疗效优于对照组(Z=2.051,P=0.041)。见表2。
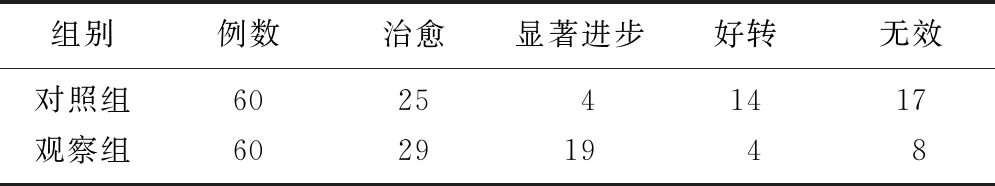
表2 两组脑出血患者的临床疗效比较 (例)
对照组:单独使用尼莫地平治疗;观察组:在对照组的基础上联合使用神经生长因子进行治疗
2.2两组患者的NIHSS评分比较 治疗前,两组患者的NIHSS评分比较差异无统计学意义(P>0.05);治疗后,两组患者的NIHSS评分呈下降趋势,且观察组各时点间均低于对照组(P<0.01)。两组NIHSS评分的组间、时点间、组间和时点间交互作用比较差异有统计学意义(P<0.01)。见表3。

表3 两组脑出血患者治疗前后NIHSS评分比较 (分,
NIHSS:美国国立卫生研究院卒中量表;对照组:单独使用尼莫地平治疗;观察组:在对照组的基础上联合使用神经生长因子进行治疗
2.3两组患者的血清HIF-1α、NSE水平比较 治疗前,两组患者的HIF-1α、NSE水平比较差异无统计学意义(P>0.05);治疗后,两组患者的HIF-1α、NSE水平均下降,且观察组低于对照组(P<0.01)。两组HIF-1α、NSE水平的组间、时点间、组间和时点间交互作用比较差异有统计学意义(P<0.01)。见表4。

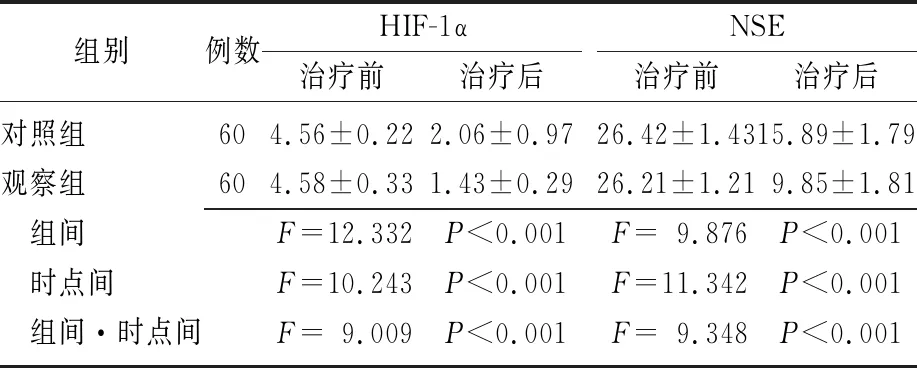
组别例数HIF-1α治疗前治疗后NSE治疗前治疗后对照组604.56±0.222.06±0.9726.42±1.4315.89±1.79观察组604.58±0.331.43±0.2926.21±1.219.85±1.81 组间F=12.332 P<0.001F=9.876 P<0.001 时点间F=10.243 P<0.001F=11.342 P<0.001 组间·时点间F=9.009 P<0.001F=9.348 P<0.001
HIF-1α:缺氧诱导因子-1α;NSE:神经元特异性烯醇化酶;对照组:单独使用尼莫地平治疗;观察组:在对照组的基础上联合使用神经生长因子进行治疗
2.4两组患者的炎症因子水平比较 治疗前,两组患者的TNF-α、IL-6、IL-8水平比较差异无统计学意义(P>0.05);治疗后,两组患者的TNF-α、IL-6、IL-8水平均明显下降,且观察组低于对照组(P<0.05)。两组TNF-α、IL-6、IL-8水平的组间、时点间、组间和时点间交互作用比较差异有统计学意义(P<0.01)。见表5。
2.5两组患者的应激指标比较 治疗前,两组患者的肾素、E、AngⅡ、NE水平比较差异无统计学意义(P>0.05);治疗后,两组患者的肾素、E、AngⅡ、NE水平均升高,但观察组低于对照组(P<0.01)。两组肾素、E、AngⅡ、NE水平的组间、时点间、组间和时点间交互作用比较差异有统计学意义(P<0.01)。见表6。
3 讨 论
在脑出血患者的疾病进展过程中,由于脑血肿部位发生占位性病变[12],导致局部病灶部位引发炎症反应,在炎症因子以及应激反应的介导下患者大脑严重缺血,最终可造成患者的脑细胞死亡[13]。有专家认为,神经功能损伤是造成患者的脑组织出现水肿的重要原因[14]。而在此过程中,炎症因子发挥重要作用。脑出血的发生会造成周围脑组织的炎症反应过度激活,机体内环境发生改变,进而影响机体的下丘脑功能,下丘脑功能受到抑制后儿茶酚胺合成并参与神经细胞的生长发育产生明显的抑制作用,从而加重神经功能的恶化[15]。在对脑出血患者的治疗中,主要以增加局部血液循环能力以及改善患者的神经功能损伤,提高患者的生活质量为主[16]。而在临床中,尼莫地平主要是通过改善患者血肿周围缺血区域的血流,进一步促进局部血液循环功能的改善,同时对神经损伤患者采用神经生长因子治疗,可促进患者神经修复及再生,提高患者的治疗效果[17]。

组别例数TNF-α治疗前治疗后IL-6治疗前治疗后IL-8治疗前治疗后对照组603.49±0.224.15±0.4441.42±12.4330.89±7.7999.24±19.3337.69±9.57观察组603.39±0.212.11±0.4642.21±11.2115.85±7.8199.07±22.3511.67±3.55 组间F=9.110 P<0.001F=9.002 P<0.001F=9.012 P<0.001 时点间F=8.102 P<0.001F=8.012 P<0.001F=8.997 P<0.001 组间·时点间F=7.032 P<0.001F=7.899 P<0.001F=8.997 P<0.001
TNF-α:肿瘤坏死因子-α;IL:白细胞介素;对照组:单独使用尼莫地平治疗;观察组:在对照组的基础上联合使用神经生长因子进行治疗
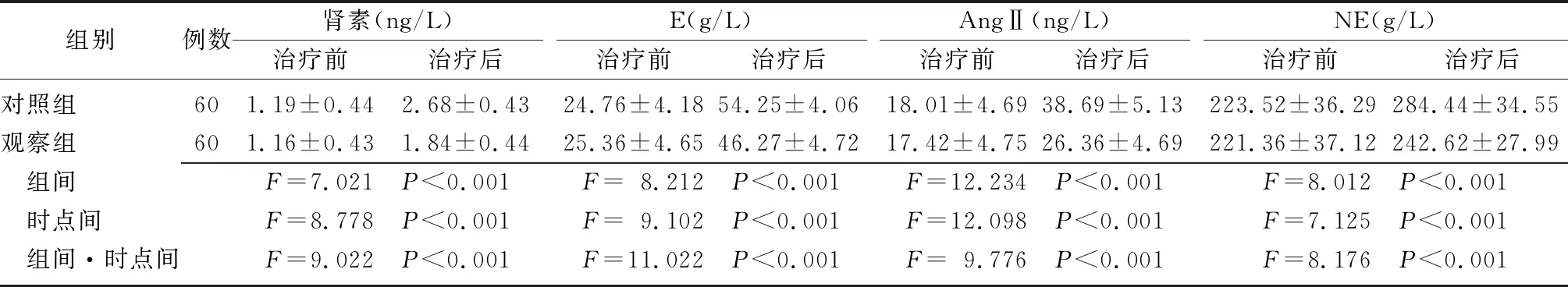
组别例数肾素(ng/L)治疗前治疗后E(g/L)治疗前治疗后AngⅡ(ng/L)治疗前治疗后NE(g/L)治疗前治疗后对照组601.19±0.442.68±0.4324.76±4.1854.25±4.0618.01±4.6938.69±5.13223.52±36.29284.44±34.55观察组601.16±0.431.84±0.4425.36±4.6546.27±4.7217.42±4.7526.36±4.69221.36±37.12242.62±27.99 组间F=7.021 P<0.001F=8.212 P<0.001F=12.234 P<0.001F=8.012 P<0.001 时点间F=8.778 P<0.001F=9.102 P<0.001F=12.098 P<0.001F=7.125 P<0.001 组间·时点间F=9.022 P<0.001F=11.022 P<0.001F=9.776 P<0.001F=8.176 P<0.001
E:肾上腺素;AngⅡ:血管紧张素Ⅱ;NE:去甲肾上腺素;对照组:单独使用尼莫地平治疗;观察组:在对照组的基础上联合使用神经生长因子进行治疗
有研究认为在尼莫地平联合神经生长因子治疗脑出血的过程中,尼莫地平可以有效增强患者的局部血液循环能力,促进炎症因子水平的新陈代谢能力,有利于改善患者的内皮损伤[18-19]。本研究中,观察组的治疗效果显著优于对照组。大脑细胞对于局部的缺氧具有较强的敏感性,一旦患者的脑组织局部病灶部位氧消耗与氧供应失衡,就会出现局部应激反应水平的升高。此时,局部病灶部位毛细血管的血清HIF-1α水平显著升高[20]。血清NSE是一种酸性蛋白酶,其为神经元及具有神经内分泌功能的细胞所特有。有研究显示,血清NSE水平的升高与神经元的凋亡、脑损伤、认知能力下降等具有相关性[21]。当脑组织受损时,由于细胞膜的完整性受到破坏[22-23],NSE被释放出来并通过血脑屏障进入血液,因此能够反映脑组织神经元的损伤情况[24]。刘宇明等[25]研究显示,血清NSE水平与患者的认知障碍程度密切相关,其与简易智力状态检查量表评分呈负相关,NSE水平越高认知程度越严重。许乐宜等[26]采用常规用药基础联合鼠神经生长因子治疗脑出血的结果显示,患者NSE水平显著降低,治疗效果明显提高。本研究结果显示,治疗后,两组患者的HIF-1α、NSE水平均下降,且观察组低于对照组(P<0.01),提示尼莫地平联合神经生长因子治疗可显著提高患者的认知功能。马丽丽[27]采用尼莫地平治疗脑出血的临床疗效显著,炎症因子水平显著下降。本研究结果显示,两组患者的TNF-α、IL-6、IL-8水平均明显下降,且观察组低于对照组,与上述研究结果一致。表明随着联合治疗的开展,患者脑组织的内皮细胞以及神经元细胞的功能恢复显著,局部病灶部位神经元细胞的新陈代谢能力增强,对提高患者的认知功能具有积极意义。在炎症反应过程中,内皮细胞损伤释放出大量的自由基[28],这些自由基的聚集会引发患者一系列临床症状[29]。而本研究中通过对患者的应激反应状态分析可知,治疗后观察组患者的应激反应能力显著下降,提示联合用药治疗可显著提升患者的应激氧化清除能力,对脑出血患者治疗效果的提升具有积极意义[30-32]。
综上所述,脑出血患者采用尼莫地平联合神经生长因子进行治疗,能显著下调血清HIF-1α、NSE水平及炎症反应,效果显著。

