腹腔镜右半结肠癌完整系膜切除术经尾侧-中间联合入路回顾性研究
刘海山,蔡正昊,马君俊,孙 晶,何子锐,臧 潞,董 峰,冯 波,宗雅萍,薛 佩,张鲁阳,陆爱国,郑民华
(上海交通大学医学院附属瑞金医院外科,上海 200025)
根治性手术是治疗早、中期结肠直肠癌的主要方法。2009年,Hohenberger等[1]提出在结肠癌根治术中施行结肠完整系膜切除 (complete mesocolic excision,CME)理念。相比于传统根治手术,CME根治手术病人的局部复发率降低(6.5%比3.5%),5年总生存率升高(82.1%比89.1%)。目前传统中间入路(简称中间入路)与尾侧-中间联合入路(简称尾侧联合入路)是腹腔镜右半结肠癌CME常用的两种入路方式。手术入路研究是腹腔镜右半结肠癌手术研究热点之一[2],而以CME完成质量作为比较指标的研究仍较少。本研究收集2017年1月至6月我科收治的68例右半结肠癌病人临床资料,分析比较两种手术入路在CME完成质量、手术安全性、近期疗效及远期预后等方面的优势与劣势。
资料与方法
一、研究设计与病人选择
本研究为回顾性研究,根据纳入及排除标准,筛选出68例,其中尾侧联合入路组37例,中间入路组31例。
包括以下病人。①年龄18~85岁;②术后病理检查诊断为结肠腺癌;③肿瘤位于盲肠至横结肠右1/3段;④术后病理分期为T2-4aN0-2M0;⑤限期手术病例,手术方式为中间入路或尾侧联合入路腹腔镜右半结肠癌CME;⑥术后标本照片、手术录像留存完整,能评估CME完成质量并统计腹腔镜下解剖时间;⑦术后根据病理分期按标准行辅助治疗。
不包括以下病人。①同时性或异时性多原发结肠直肠癌;②术前胸部、腹部、盆腔增强CT检查显示存在远处转移,或术中探查发现腹腔内转移;③未行R0切除;④无法明确手术入路者,未留存标本照片,照片难以评估CME完整质量;⑤急诊手术。
二、手术方法
(一)中间入路手术方法
中间入路采用文献[3]中的手术步骤。①沿回结肠动、静脉(ileocolic artery/vein,ICA/ICV)下方横弧形切开结肠系膜进入右结肠后间隙(right retrocolic space,RRCS)(见图1)。②沿肠系膜上静脉(superior mesenteric vein,SMV)右侧向头侧解剖/清扫SMV主干至胰腺下缘,沿途解剖SMV、肠系膜上动脉(superior mesenteric artery,SMA)各分支血管,包括ICA/ICV、右结肠血管 (right colic artery/vein,RCA/RCV)、中结肠血管 (middle colic artery/vein,MCA/MCV)以及 Henle 干(Henle′s trunk,HT)及其分支血管,并根据肿瘤部位于根部结扎相应滋养血管(见图2)。③以RRCS为手术平面,向右侧、头侧扩展,右侧直至侧腹膜,头侧直至胰腺下缘与十二指肠水平部,将右结肠系膜完整游离(见图3)。④可采取完全中间入路的策略[4],从胰腺下缘“爬坡”,辨认系膜解剖层次后,继续从下往上解剖横结肠系膜;亦可转向横结肠上区,采用头侧入路方式,游离胃结肠韧带后,通过系膜间间隙(inter-mesenteric space,IMS)进入横结肠后间隙(transverse retrocolic space,TRCS),完成横结肠系膜的解剖与游离[5]。⑤打开右侧侧腹膜,充分游离右半结肠及结肠系膜,并完整切除病变肠管(见图4)。
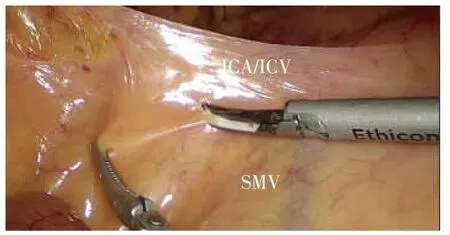
图1 于ICA/ICV下方横弧形切开系膜
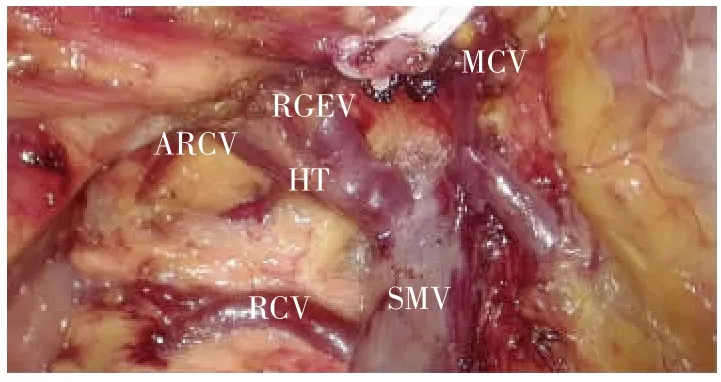
图2 沿SMV沿途解剖各分支血管ARCV和RGEV
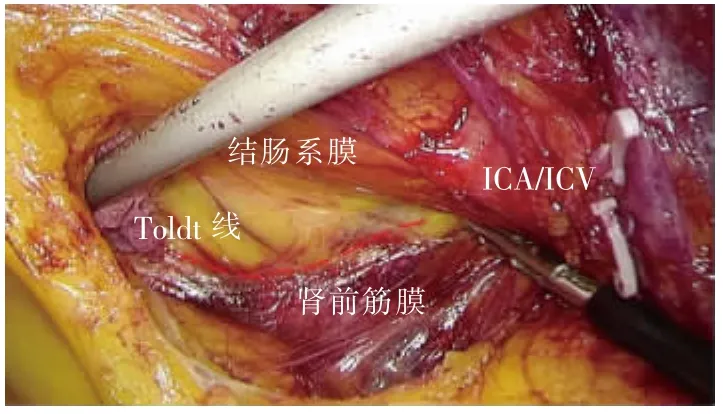
图3 拓展RRCS
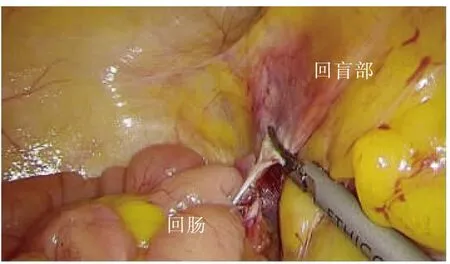
图4 打开右侧侧腹膜
(二)尾侧联合入路手术方法
尾侧联合入路采用文献[6]中的手术步骤。①助手提起回盲部及升结肠向头侧及左侧牵拉,于回肠系膜根部与后腹膜融合处,可见“黄白交界线”(见图5)。②于黄白交界线靠内侧横弧形切开,可见系膜后叶与后腹膜间结缔组织被牵拉而形成的白色细丝,表明未进入错误间隙(见图5);于两层筋膜间锐性分离,进入RRCS,向头侧、内侧游离至十二指肠框(见图6)。③回转中间入路:同中间入路——于ICA/ICV下方横弧形切开,适度分离即可与已游离好的RRCS贯通(见图7)。其余步骤同中间入路。
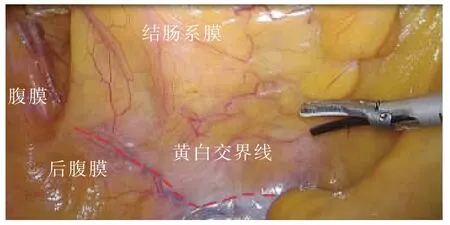
图5 于黄白交界线处横弧形切开,进入RRCS

图6 拓展RRCS
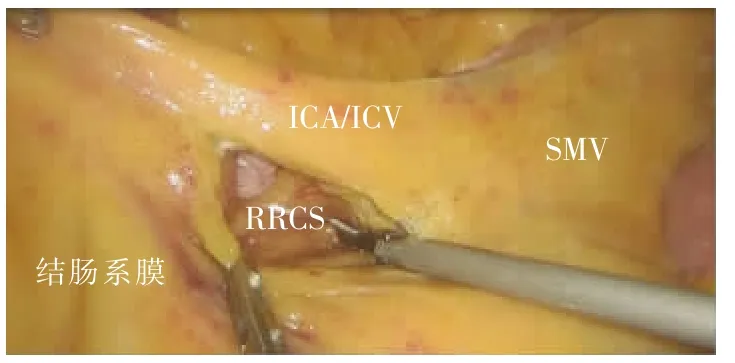
图7 回转中间入路,打开系膜前叶,与尾侧会师
三、分析指标
比较两种入路CME完成质量评价指标,即标本CME评级、切除系膜面积、淋巴结清扫数、血管结扎部位距肿瘤距离以及距肠管距离;手术安全性及可行性指标,包括总手术时间及腹腔镜下解剖时间、出血量、中转开腹情况和术中并发症,术后近期疗效指标,包括术后排气时间、开放饮食时间、近期并发症发生率,和术后3年无病生存(disease-free survival,DFS)]的远期预后。术后近期并发症定义为术后1个月内病人出现的手术并发症。术后随访通过电话及门诊,获取病人生存、复发以及术后辅助治疗情况。
CME完成质量评价指标包括以下内容:①CME评级,采用West等[2]提出的分级方法。按系膜完整性评为:a.系膜层面(mesocolic plane),系膜完整性为“好”;b.系膜内层面(intramesocolic plane),系膜完整性为“中等”;c.固有肌层层面(muscularis propria plane),系膜完整性为“差”。定义评级为“好”者所占百分比为CME完成率。②标本相关数据测量:肠管长度(L线),血管结扎部位与肿瘤距离(A线)、血管结扎部位与肠壁最短距离(B线)、结肠系膜面积(S)(见图8)。
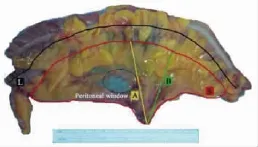
图8 CME完成质量评价指标的测量
四、统计学方法
结 果
本研究共纳入68例,男35例,女33例,年龄(63.78±13.17)岁。中间入路31例,尾侧联合入路37例。两组基线资料,包括术后辅助治疗及术后病理检查结果差异无统计学意义(见表1、2)。两组均无中转开腹及术中并发症发生情况,总手术时间、出血量、术后排气时间及恢复饮食时间和术后并发症发生差异无统计学意义。但尾侧联合入路组腹腔镜下解剖时间较中间入路组缩短,(62.70±12.22)min比(70.39±11.98)min,P=0.01(见表 3)。
对于CME完成质量,尾侧联合入路组CME完成率为86.5%(32/37),略高于中间入路组80.6%(25/31),但两者差异无统计学意义(P=0.53)。两组完成CME的系膜完整性分级都在a级(系膜层面)和b级(系膜内层面),无c级(固有肌层层面)(见表4)。其余指标差异亦无统计学意义。
两组病人总体中位随访时间为32.02(30.73~32.87)个月,无失访,无死亡病例。尾侧联合入路组2例肝转移,1例腹腔转移,3年DFS为91.9%。中间入路组1例肝转移,1例腹腔转移,3年DFS为93.5%。两组3年DFS差异无统计学意义(P=0.87)(见图 9)。

表1 基线资料
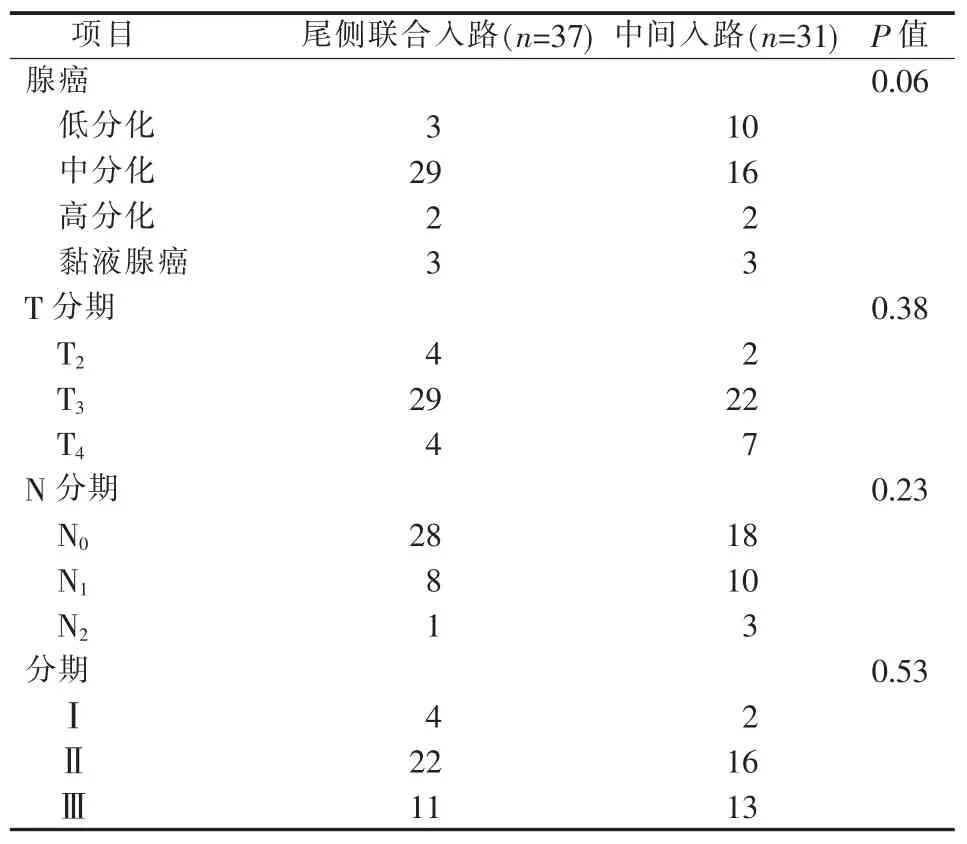
表2 术后病理检查结果
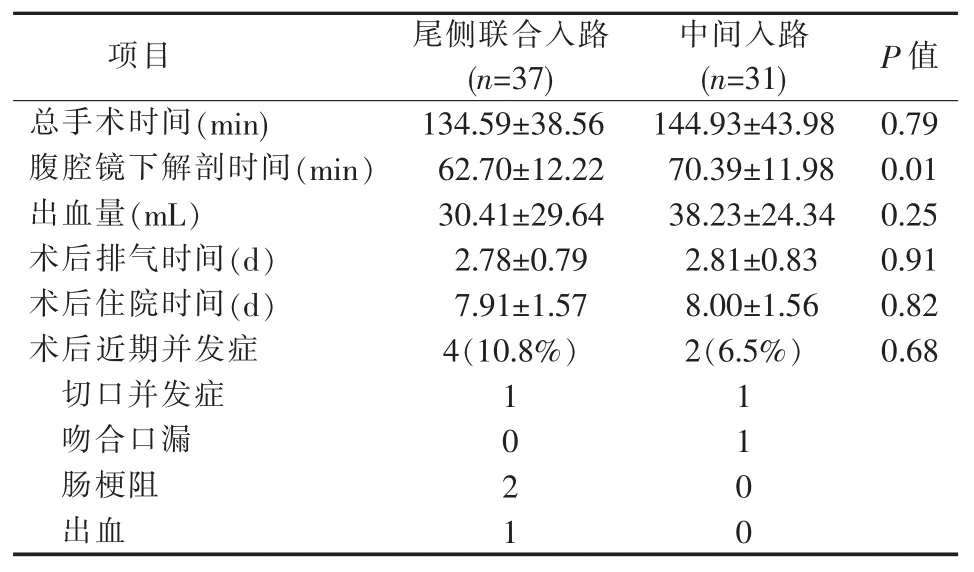
表3 围术期相关指标
讨 论
本回顾性研究比较尾侧联合入路与中间入路手术的安全性及可行性,术后近期疗效及远期预后等指标。初步结果证实尾侧联合入路腹腔镜下解剖时间较中间入路缩短,而在总手术时间、术中出血量、开腹中转率、术后并发症、术后恢复及远期预后等方面差异无统计学意义。本研究首次应用CME完成质量作为评价手术质量的指标,比较两种入路的手术学效果。
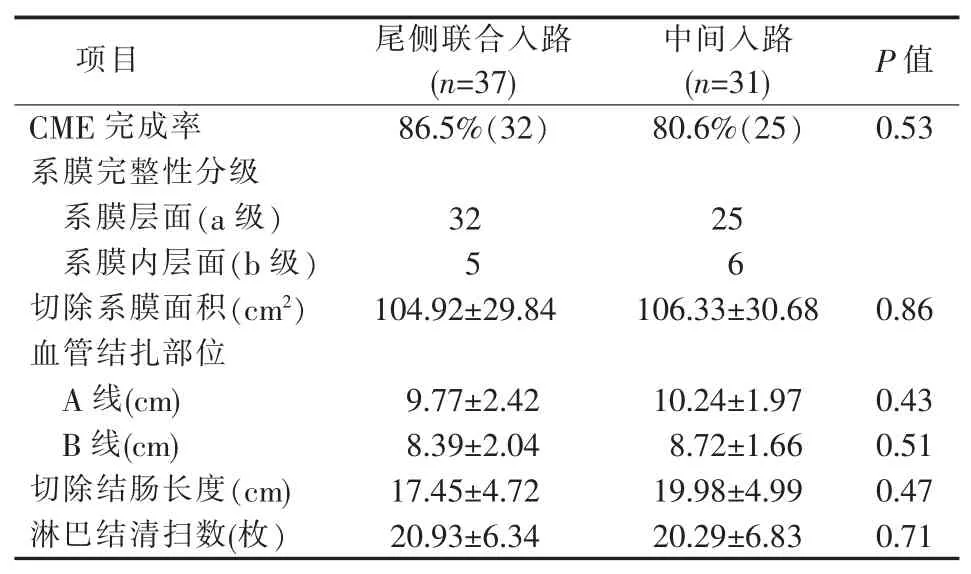
表4 CME完成质量
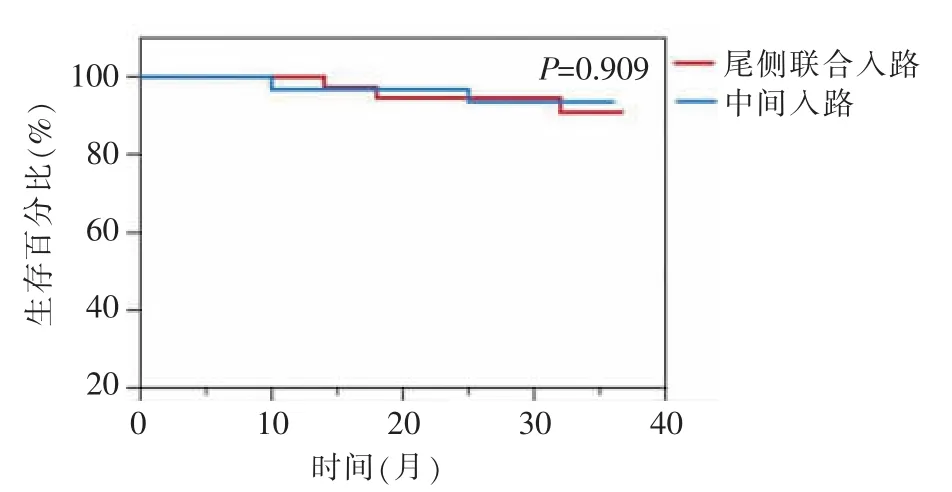
图9 DFS
CME完成质量的评价指标,包括标本CME评级、切除系膜面积、血管结扎部位与肿瘤距离和血管结扎部位与肠管距离、淋巴结清扫数等[7-8],逐渐成为评价结肠癌根治手术质量的重要指标。现代系膜解剖研究认为,结肠系膜是一个完整、连续的结构,上延续至小肠系膜,下延伸至直肠系膜[9]。对结肠系膜显微结构的研究显示,单层间皮细胞形成的浆膜由前向后,如信封样包绕肠管、其供养血管、引流淋巴管道以及系膜内脂肪组织、神经等[10],形成相对独立的结构。在肿瘤发展早、中期,肿瘤细胞直接扩散或沿淋巴途径转移,都局限于该“信封”内。此外,结肠系膜内可能存在常规方法难以检出的阳性淋巴结以及微小癌结节等[11]。因此,Hohenberger等[1]提出CME理念,强调在实施结肠癌根治术时保证系膜完整切除,同时行血管高位结扎与根部淋巴结清扫。目前有较多研究支持CME的有效性[12-14]。West等[15]提出结肠系膜完整性与DFS及总体生存等相关。结肠系膜完整者(系膜层面)5年总体生存率较不完整者(系膜内层面及固有肌层层面)高15%,Ⅱ、Ⅲ期病人的5年生存率提高可达27%。同时,淋巴结清扫数、系膜切除面积等指标也被证实与预后相关。因此,CME的完成质量成为评价结肠癌根治术质量的重要指标。本研究使用CME完成质量的评价指标,包括系膜完整性、淋巴结清扫数、系膜切除面积、血管结扎部位与肿瘤距离等,来评价手术质量,比较两种入路腹腔镜右半结肠癌CME的优劣。在同类研究中,尚属首次。
腹腔镜右半结肠癌CME入路较多[16-18]。根据其解剖起点、顺序的不同,可分为头侧入路、尾侧入路、中间入路等。①头侧入路自胃大弯中部进入IMS,随后进入TRCS进行拓展,自上而下解剖SMV及其分支。该入路较易寻找TRCS,但解剖HT与MCA时,易损伤RCV及SMV分支至胰腺颈部小血管,而造成出血[19]。②尾侧入路从黄白交界线进入RRCS,自外下向内上游离右半结肠系膜,并解剖SMV/SMA以及其分支血管。该入路便于寻找天然解剖平面,且于直视下分离,从而保证系膜完整性,并减少腹膜后位器官损伤。但在拓展TRCS及解剖HT时,由于操作空间封闭,一旦出血将难以控制[5]。③中间入路以ICA/ICV为起点,以SMV为中心,以RRCS为解剖平面,点线面结合,完成相应血管解剖及结肠系膜游离。中间入路优先处理血管,更符合肿瘤根治原则,同时减少血管损伤,降低出血量,是右半结肠癌根治术的经典入路。但其需从腹侧切开系膜,并向背侧寻找拓展RRCS,易走错层面、破坏系膜或损伤腹膜后位器官。在此基础上,本课题组提出尾侧联合入路。即优先经尾侧入路拓展RRCS,再回转中间入路,处理血管及清扫淋巴结等。既可发挥尾侧入路在辨认解剖起点、维持解剖平面及保护腹膜后位器官方面的优势,又能发挥中间入路在处理血管方面的长处。
本研究发现,尾侧联合入路组与中间入路组CME完成率分别为86.5%与80.6%,与其他研究的65%~85%相符[20-23]。尾侧联合入路组较中间入路组CME完成率略有提高,但两组间差异无统计学意义,可能有以下原因。①本研究术者经验丰富,能熟练辨认解剖标志、寻找正确的解剖间隙,故而难以体现尾侧入路在辨认解剖标志、维持系膜完整性方面的优势,而这种优势对于初学者可能更显著。②本研究为回顾性,通过标本照片及手术录像判断系膜完整性。对于缺损较小者难以判断,增加评判CME完成率的难度,可能导致偏倚。③纳入例数较少,可能难以体现差异。CME完成质量的其他指标(切除系膜面积、血管结扎部位与肿瘤距离、淋巴结清扫数),两组间差异亦无统计学意义。因两种入路主要区别在于解剖起点与顺序,在血管结扎部位与淋巴结清扫范围方面无区别。
舒若等[24]采用与本研究相似的入路方式,认为尾侧联合入路可迅速辨认并直接进入RRCS解剖,从而缩短总手术时间、减少出血量。本研究结果表明,虽然两种入路总手术时间差异无统计学意义,但尾侧联合入路与中间入路比较,腹腔镜下解剖时间缩短,提示尾侧联合入路的优势在于腹腔镜下找寻、辨认及解剖间隙。肖荷芳等[25]、叶进军等[26]、郑毅等[27]报道的尾侧入路方式为经尾侧拓展RRCS内侧至SMV左侧,头侧至显露胰头及十二指肠各段。虽然最后均转至系膜腹侧结扎血管根部,但笔者认为将其称为完全尾侧入路更合适。因其经尾侧完全解剖显露SMV各属支,包括HT。本课题组体会,若单纯经尾侧一直拓展至TRCS,甚至结肠肝曲,极易损伤此区域内胰十二指肠上前静脉及其分支、RCV、RGEV及HT等,从而引起出血。且因术者位于病人左侧,主操作的右手器械在分离该间隙至邻近内侧SMV时,往往因杠杆作用,易造成该处系膜及血管撕裂。故而本课题组在经尾侧拓展RRCS时,向头侧至胰腺下缘,内侧仅适度拓展至显露SMV即止。胰头前间隙 (即TRCS)与ICV/ICA、RCV/RCA、MCA根部留待经中间入路进行解剖拓展,因经中间入路从下至上解剖HT至中结肠血管,高位结扎处理相应血管根部更安全可靠。在解剖结肠中动脉并切断后,HT内侧空间得以拓展,而外侧已经尾侧拓展完毕。此时再处理HT,可有效减少血管损伤。
综上,对于腹腔镜右半结肠癌CME,尾侧联合入路可缩短腹腔镜解剖时间,而在CME完成质量、手术安全性、术后近期疗效及远期预后方面,与中间入路相当。该结论尚待大样本前瞻性研究进行验证。

