PCV2b衣壳蛋白C端连接不同B细胞表位对其免疫原性的影响
刘晴坤,冯 华,任春晓,魏 蔷,刘运超,张改平,3
(1.河南农业大学 生命科学学院,河南 郑州 450002;2.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;3.郑州大学 生命科学学院,河南 郑州 450001)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)属于圆环病毒科圆环病毒属,于1991年在加拿大首次鉴定分离出该病毒[1],PCV2为无囊膜的单链环状DNA病毒,病毒全基因组大小在1 766~1 768 bp,可分为5种基因亚型PCV2a~e[2]。PCV2主要感染5~12周的断奶仔猪,诱导机体的淋巴细胞凋亡和秏竭,导致免疫抑制[3],从而引起与其他病毒的混合感染[4],导致断奶仔猪多系统消耗综合征(Postweaning multisystemic wasting syndrome,PMWS)、猪繁殖障碍症(Reproductive failure)等猪圆环病毒相关疾病(Porcine circovirus association disease,PCVAD)的发生[5]。PCV2现已成为重要的病原体,给养猪业带来巨大损失。
疫苗接种是预防猪圆环病毒感染的有效手段,目前市场上疫苗多以灭活苗和亚单位疫苗为主,但由于病毒培养滴度较低,这在一定程度上提高灭活苗的生产成本,现有原核表达的亚单位疫苗较少[6],因此,研制高效廉价的亚单位疫苗具有广阔的应用前景。PCV2的2个主要开放阅读框(Open reading frame,ORF),ORF1编码与病毒复制有关的蛋白酶(Rep,Rep′),其中ORF2编码的衣壳蛋白(Cap)是PCV2的主要抗原[7],已广泛应用于疫苗设计。Beach等[8]把外源表位串联在PCV2 Cap的C端,免疫动物后,能刺激机体产生针对Cap和该表位的体液免疫反应;Huang等[9]的研究显示,在Cap的C末端引入口蹄疫中和表位,同样能刺激机体产生针对Cap和所连接表位的免疫反应。上述研究表明,Cap的C端是连接外源表位的较好位点。Shang等[10]鉴定出多个PCV2的优势表位,已应用于PCV2表位疫苗的研究[11-12],其中表位195HVGLGTAF202位于loop GH和loop HI之间,该表位能刺激机体产生较高的抗体水平,表位226LKDPPLNP233位于Cap的末端,是PCV2的中和表位,这2个表位在PCV2a和PCV2b中非常保守[13]。
目前,表达PCV2 Cap已有多种方法[14],其中,小分子泛素相关修饰物(Small ubiquitin-related modifier,SUMO)是一类广泛存在于真核生物中且序列有高度保守性的小分子蛋白质,主要参与细胞内的蛋白质定位、细胞凋亡、蛋白质稳定性控制等胞内活动,能促进蛋白质可溶表达和正确折叠,且已广泛应用于蛋白质的融合表达[15-17]。鉴于此,利用SUMO标签的这种特性,分别将确定的2个表位226LKDPPLNP233和195HVGLGTAF202以单独和串联的方式连接在Cap的C端并构建至pE-SUMO载体;将构建好的融合表达载体转化至BL21(DE3)后诱导表达,纯化目的蛋白,经动物免疫试验,探究PCV2 Cap的C末端连接PCV2不同表位对Cap免疫原性的影响,为新型PCV2亚单位疫苗的研发提供参考。
1 材料和方法
1.1 细胞、抗体与质粒
JM109感受态细胞和BL21(DE3)感受态细胞购自庄盟生物基因科技有限公司,pE-SUMO载体、已构建好的在Cap的C端连接表位226LKDPPLNP233的重组表达载体pE-SUMO-Cap-e1、PCV2 Cap单克隆抗体3H6均由河南省农业科学院动物免疫学重点实验室保存。
1.2 主要试剂
Primer STAR Max DNA Polymerase购自大连宝生物工程有限公司;DL2000 DNA Marker 购自庄盟国际生物基因科技有限公司;彩虹180广谱蛋白Marker、BCA蛋白质浓度测定试剂盒和SUMO蛋白酶均购自北京索莱宝科技有限公司;限制性内切酶BsaⅠ、BamHⅠ和T4DNA连接酶均购自NEB公司;鼠源6×His标签抗体购自武汉三鹰生物技术有限公司;HRP标记羊抗鼠二抗购自亚科因生物技术有限公司(Abbkine);Ni-NTA填料购自Novagen公司;弗氏佐剂购自Sigma公司;PCV2灭活苗购自上海海利生物技术股份有限公司;PCV2抗体检测试剂盒购自无锡优联生物科技有限公司。
1.3 目的基因扩增
根据大肠杆菌密码子的偏好性对PCV2b(GenBank: AY969004.1)cap基因进行密码子优化(http://www.jcat.de/),优化后由上海生工合成。根据合成的cap序列设计上下游特异性引物(表1),下游引物PCV2b-R2表示连接表位195HVGLGTAF202,下游引物PCV2b-R12表示表位195HVGLGTAF202和226LKDPPLNP233的串联,引物由郑州尚亚公司合成。以合成的cap全序列为模板进行PCR反应,反应条件为:94 ℃高温完全变性5 min;94 ℃变性30 s,56 ℃退火30 s,68 ℃延伸40 s,共30个循环;最后68 ℃延伸10 min。
1.4 重组表达载体构建
将回收的2个目的基因和pE-SUMO质粒分别用BsaⅠ和BamHⅠ在37 ℃双酶切3 h,之后85 ℃失活20 min,回收后在T4连接酶作用下4 ℃过夜连接,将连接产物转化到JM109感受态细胞,在37 ℃无抗性LB中培养1 h后均匀涂布到含有50 μg/mL氨苄青霉素抗性的平板上培养过夜,每个重组载体挑出5个阳性克隆,经菌液PCR初步鉴定后再测序验证。
1.5 重组蛋白可溶性分析
将3种重组表达载体按上述操作转化至BL21(DE3)感受态细胞,挑选对应的阳性克隆,分别接种至5 mL含50 μg/mL氨苄青霉素的LB中,培养至菌体OD600约0.4~0.6,加入终浓度为1 mmol/L的IPTG,以不加任何诱导剂做阴性对照,降温至26 ℃诱导培养12 h,收集菌体,细胞超声破碎后(工作4 s停8 s,破碎2 min)12 000 r/min离心分离上清和沉淀,SDS-PAGE鉴定可溶性表达情况。
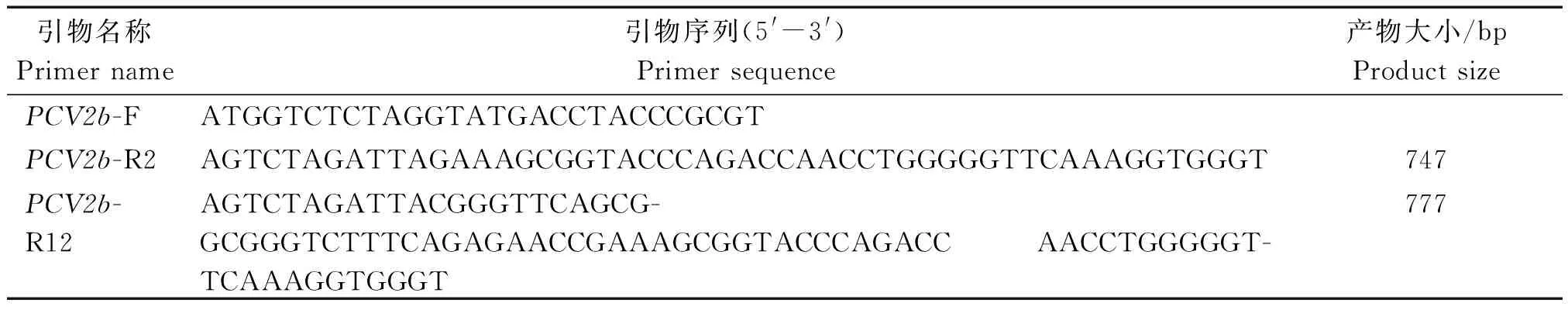
表1 PCR扩增引物序列Tab.1 The primer sequence for PCR amplification
1.6 重组蛋白的纯化与鉴定
分别取pE-SUMO-Cap-e1、e2、e12蛋白可溶性上清,采用Ni-NTA亲和层析纯化目的蛋白质,分别将3种重组蛋白的上清液、流穿液、洗涤液、洗脱液经SDS-PAGE鉴定,再用鼠源6×His标签抗体做Western Blotting验证。
1.7 重组蛋白的酶切与鉴定
根据SUMO蛋白酶使用说明书推荐的缓冲条件和蛋白酶用量,分别将纯化的蛋白于4 ℃酶切过夜,再次用Ni-NTA亲和层析除标签,SDS-PAGE检测3种蛋白是否切开,再用PCV2的Cap单抗3H6鉴定目的蛋白的免疫反应性。
1.8 动物免疫试验
20只6周龄SPF级雌性Balb/c小鼠购自河南省实验动物中心,随机分成5组,每组4只,初次免疫时,Cap-e1、e2、e12分别与弗氏完全佐剂等体积乳化,在接下来的加强免疫中与弗氏不完全佐剂等体积乳化,每次免疫剂量定在每只30 μg,经背部皮下多点注射,每2周免疫1次,共免疫3次,同时设置PBS为阴性对照组,疫苗为阳性对照组,分别在第2周、第4周、第6周断尾采血分离血清。
1.9 抗体效价测定
采用江苏无锡优联PCV2抗体检测试剂盒检测血清抗体:分别将第2周、第4周、第6周所收集分离的血清稀释到4 000倍,以100 μL/孔加入试剂盒抗原包被板中,在37 ℃反应1 h,PBST清洗3遍,加入100 μL 1∶1 000稀释的羊抗鼠二抗,37 ℃反应1 h,PBST清洗3遍,加入100 μL底物TMB,避光反应10 min后,加 50 μL 2 mol/L 硫酸终止反应,在酶标仪上读取OD450。
2 结果与分析
2.1 目的基因扩增
分别用2对引物(PCV-F 和PCV-R2、PCV-F 和PCV-R12)扩增目的基因,经2%琼脂糖凝胶电泳后结果如图1,在约750 bp处有对应的扩增条带出现,与预期产物大小(747,777 bp)相符合,阴性对照未在目的大小处出现条带。
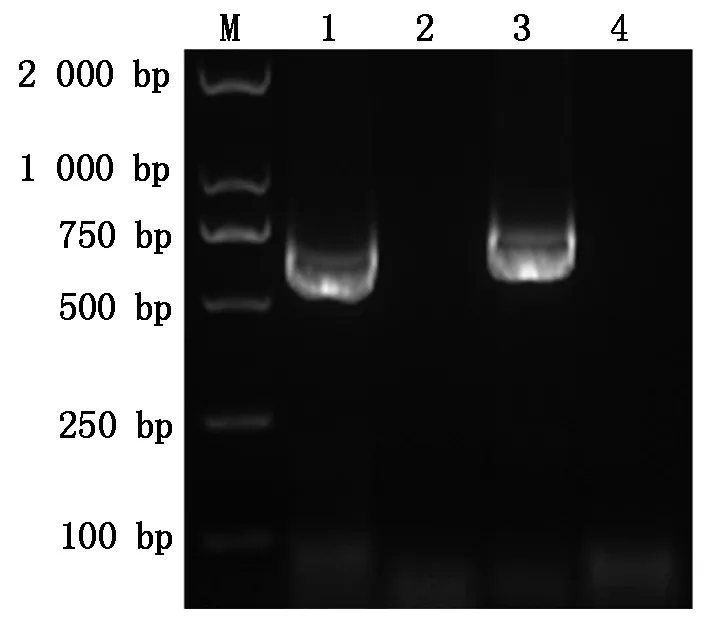
M. DNA 分子质量标准 DL2000;1.cap-e2的扩增;2.阴性对照;3.cap-e12的扩增;4.阴性对照。M.DL2000 DNA Marker;1.Amplification of cap-e2;2.Negative control;3.Amplification of cap-e12;4.Negative control.
2.2 重组表达载体构建
连接产物转化JM109后分别对挑出的5个单克隆进行菌液PCR鉴定(图2),再将菌液PCR为阳性的单克隆测序鉴定,结果显示,融合基因成功构建至pE-SUMO表达载体中。将连接表位195HVGL GTAF202的重组表达载体命名为pE-SUMO-cap-e2、连接2个表位的重组表达载体命名为pE-SUMO-cap-e12。将已有的重组载体pE-SUMO-cap-e1和新构建的2个重组载体分别转化至BL21(DE3)。
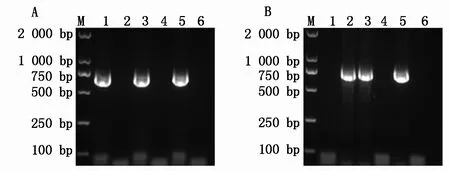
A、B.pE-SUMO-cap-e2、e12的菌液PCR鉴定: M.DNA 分子质量标准 DL2000;1-5.PCR产物;6.阴性对照。A,B.PCR identification of pE-SUMO-cap-e2,e12: M. DL2000 DNA Marker;1-5.PCR products;6.Negative control.
2.3 重组蛋白可溶性分析
SUMO在SDS-PAGE中分子质量显示为17 ku大小,Cap的分子质量大小约28 ku,重组蛋白分子质量大小在45 ku左右。3种重组表达载体诱导表达后经SDS-PAGE鉴定(图3),对比发现,在约48 ku大小处,IPTG诱导后的上清中(泳道2、5、8)均有较粗的条带出现,其大小和目的蛋白质大小吻合,未诱导的全菌(泳道1、4、7)在48 ku大小处只有1条较细的条带,沉淀(泳道3、6、9)中无明显对应条带的出现,初步证明这3种蛋白质可溶性表达(图3)。
2.4 重组蛋白的纯化与鉴定
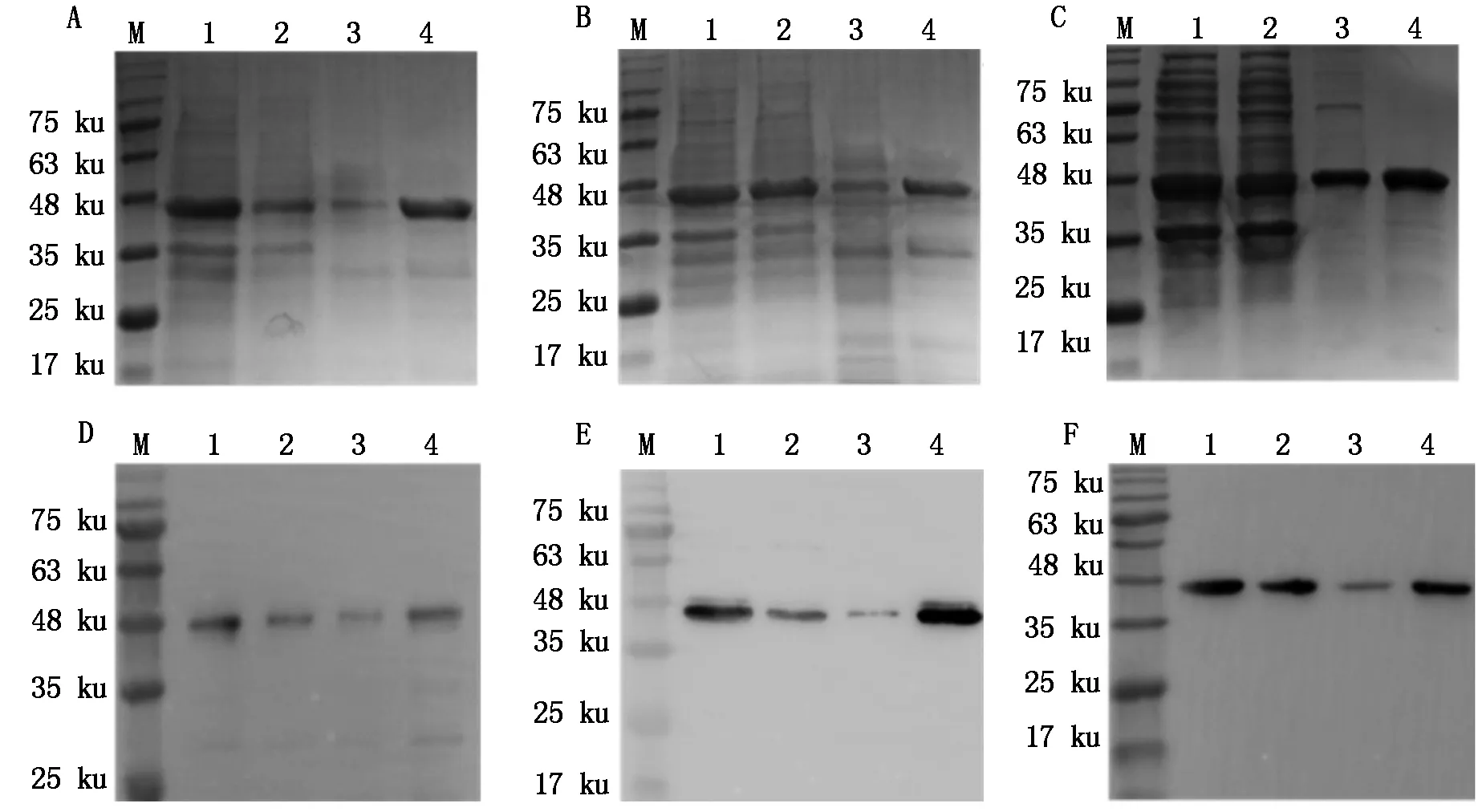
细胞超声破碎后离心取上清,对3种重组蛋白上清液分别进行Ni-NTA亲和层析纯化,经SDS-PAGE鉴定,在200 mmol/L咪唑洗脱条件下,均能在48 ku大小处得到较高纯度蛋白质(图4-A-C),与预期蛋白大小吻合。经Western Blotting鉴定(图4-D-F),3种重组蛋白均与鼠源6×His标签单抗有特异反应。初步证明,纯化获得的3种重组蛋白SUMO-Cap-e1、SUMO-Cap-e2、SUMO-Cap-e12均表达正确。
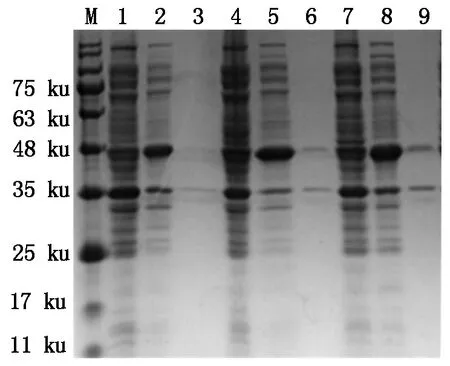
M. 蛋白质Marker;1,4,7. pE-SUMO-cap-e1、e2、e12未诱导全菌;2,5,8. pE-SUMO-cap-e1、e2、e12诱导后上清;3,6,9. pE-SUMO-cap-e1、e2、e12诱导后沉淀。
M. Protein Marker;1,4,7. Total protein of pE-SUMO-cap-e,e2,e12 before induction;2,5,8. Supernatant of pE-SUMO-cap-e1,e2,e12 after induction;3,6,9. Sediment of pE-SUMO-cap-e1,e2,e12 after induction.
图3 重组蛋白可溶性分析
Fig.3 Solubility analysis of recombinant proteins
纯化SUMO-Cap-e1、e2、e12的SDS-PAGE(A-C)和Western Blotting鉴定(D-F):M. 蛋白质Marker; 1. SUMO-Cap-e1、e2、e12蛋白上清;2. SUMO-Cap-e1、e2、e12蛋白流穿液;3. SUMO-Cap-e1、e2、e12蛋白洗杂液;4. SUMO-Cap-e1、e2、e12蛋白洗液。SDS-PAGE(A-C)and Western Blotting identification of purified SUMO-Cap-e1,e2,e12: M. Protein Marker;1.Supernatant of SUMO-Cap-e1,e2,e12; 2. Flow through of SUMO-Cap-e1,e2,e12;3. Wash fraction of SUMO-Cap-e1,e2,e12;4. Elution fraction of SUMO-Cap-e1,e2,e12.
2.5 重组蛋白的酶切与鉴定
按照SUMO蛋白酶说明书推荐的缓冲条件,3种重组蛋白均在4 ℃酶切过夜,Ni-NTA亲和层析纯化除标签,经SDS-PAGE(图5-A)鉴定表明,在目的条带大小处有对应条带出现,证明3种重组蛋白均被成功切开,获得Cap-e1、Cap-e2和Cap-e12目的蛋白。Western Blotting(图5-B)结果表明,3种重组蛋白均与PCV2的Cap单抗3H6发生特异免疫反应。
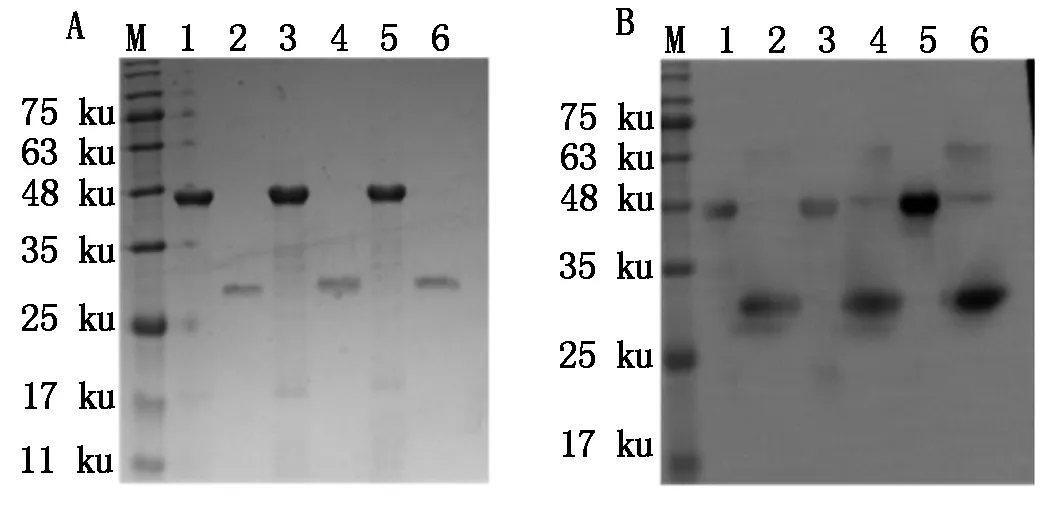
A、B.重组蛋白酶切:M.蛋白质Marker; 1.SUMO-Cap-e1;2.Cap-e1;3.SUMO-Cap-e2;4.Cap-e2;5.SUMO-Cap-e12;6.Cap-e12。
A,B.Enzyme digestion of recombinant proteins:M.Protein Marker;1.SUMO-Cap-e1;2.Cap-e1;3.SUMO-Cap-e2;4.Cap-e2;5.SUMO-Cap-e12;6.Cap-e12.
图5 重组蛋白的酶切与鉴定
Fig.5 Enzyme digestion and identification of recombinant proteins
2.6 抗体测定
用PCV2抗体检测试剂盒检测血清抗体,图6结果表明,在整个试验过程中,除PBS组外,其他试验组和疫苗组一样,均能刺激机体持续产生针对Cap的抗体,在第2周时(图6-A),Cap-e2组几乎没有与Cap特异反应的抗体,Cap-e1组和Cap-e12组产生的抗体水平很低,疫苗组产生的抗体略高于试验组。在第4周时(图6-B),除PBS组外,其他组与Cap特异反应的抗体均有大幅度提升,其中疫苗组显著高于其他组,Cap-e12组显著高于Cap-e1组和Cap-e2组,Cap-e2组也显著高于Cap-e1组。在第6周时(图6-C),抗体滴度持续上升,Cap-e12组同样显著高于Cap-e1组和Cap-e2组,Cap-e2组同样显著高于Cap-e1组,而疫苗组和Cap-e12无显著差异。
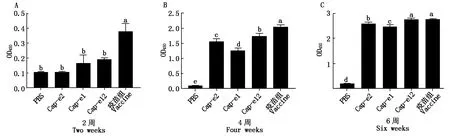
A-C. 2,4,6周时PCV2 Cap的抗体水平。A-C. PCV2 Cap-specific antibody level at 2, 4 and 6 weeks.
3 结论与讨论
PCV2主要引起断奶仔猪PMWS的发生,导致患病猪进行性消瘦、生长迟缓、呼吸困难和腹泻等临床症状,严重影响仔猪的生长发育[5],疫苗接种能有效预防PCV2的感染,现有上市PCV2疫苗以灭活和亚单位疫苗为主,灭活苗成本较高,而原核表达的亚单位疫苗较少[6],因此开发廉价高效的PCV2亚单位疫苗具有广阔前景。将鉴定出的多个PCV2 Cap优势表位串联表达,制备试验多表位疫苗,免疫小鼠结果表明,这种试验表位疫苗能刺激小鼠产生针对PCV2 Cap的抗体[11-12]。然而,这种多个表位的串联难以模拟连接的表位在Cap上的真实状态。通过把不同外源表位连接在Cap的C端研究其免疫原性,该连接方式能有效刺激机体产生针对Cap和所连接外源表位的抗体[8-9]。但目前对Cap的C末端连接PCV2自身表位对其免疫原性的影响还很少涉及,基于以上的考虑,利用SUMO融合标签能促进蛋白的可溶表达和正确折叠的特点,通过pE-SUMO融合表达载体,在完整表达出PCV2 Cap蛋白的基础上,把PCV2 Cap的不同表位连接在Cap的C端,研究连接的表位及连接的表位数量对Cap的免疫原性的影响。
本试验成功构建了2个pE-SUMO重组表达载体,与之前本实验室保存的重组载体诱导表达后经SDS-PAGE和Western Blotting验证,3种重组蛋白可溶且正确表达,纯化得到较高纯度的目的蛋白,去标签后分别与相应的弗氏佐剂乳化并免疫Balb/c小鼠,抗体检测发现,除第2周外,免疫组Cap-e2 (195HVGLGTAF202)的抗体水平均高于Cap-e1组(226LKDPPLNP233),说明表位195HVGLGTAF202比表位226LKDPPLNP233能更有效刺激体液免疫反应,Cap-12组的抗体水平均要高于只连接1个B细胞表位的试验组,虽然疫苗组在第2周和第4周的抗体水平均显著高于Cap-12组,但在第6周时Cap-12组与疫苗组无显著差异。在整个过程中,除PBS组外,各试验组和疫苗组均能持续刺激机体产生抗体。以上试验结果表明,正是抗原表位展示数量的差异造成蛋白免疫原性的不同,因此可以通过连接PCV2 Cap的多个优势表位,通过多个表位展示以达到产生与Cap特异反应的高水平抗体。而当前正在发生PCV2流行毒株的进化和转变[18-19],给PCV2疫苗研发提出了新的挑战,因此,以期通过此法制备更高效和交叉保护的亚单位疫苗,相关后续试验正在进行中。本研究首次比较了PCV2 Cap的C端连接自身不同数量表位对Cap的免疫原性的影响,为新型PCV2亚单位疫苗研发提供了一定的参考。

