食管鳞癌组织中lncRNA UCA1表达及其对癌细胞黏附和迁移影响
(1 河南科技大学临床医学院(河南科技大学第一附属医院)胸外科,河南 洛阳 471000; 2 安阳市人民医院胸外科)
食管癌发病是由多种因素共同作用的结果,随着基因高通量测序技术的发展,长链非编码RNA(lncRNA)被认为在多种癌症发展中扮演重要角色[1-2]。已有研究结果表明,lncRNA参与人体细胞增殖、分化、转移、凋亡等生物学活动,其在多种恶性肿瘤发展中也发挥作用[3-6]。尿路上皮癌相关基因1(UCA1)是癌症调节耐药基因,参与多种肿瘤的恶性发展[7-12],如胃癌、肺癌、直肠癌等。UCA1是一种来源于人类内源性逆转录病毒(HERV-H)家族的lncRNA分子,其基因定位于人类第19号染色体(19p13.12),全长为1.4 kb。lncRNAUCA1最初在膀胱癌被发现,并能够促进肿瘤细胞增殖和转移[13]。目前,lncRNAUCA1在食管癌中表达及其作用研究报道较少。本文对lncRNAUCA1在食管鳞癌中表达及其对癌细胞黏附和迁移的调控进行分析,探讨lncRNAUCA1用于食管鳞癌病人早期诊断及术后监测的临床价值。现将结果报告如下。
1 资料与方法
1.1 一般资料
2016年5月—2018年5月,收集在本院接受手术治疗的52例食管鳞癌病人作为研究对象,男性28例,女性24例,年龄48~72岁,平均(62.8±7.6)岁。纳入标准:所有病人均经术后组织病理检查证实为食管鳞癌,手术前均未给予化疗及放疗处理。排除标准:肝肾功能异常、免疫缺陷、其他恶性肿瘤,以及并发高血压、糖尿病等全身系统疾病者。该组病人均自愿接受手术,对本次研究均知情同意。本研究经过我院医学伦理委员会批准。
1.2 仪器和试剂
1.2.1主要仪器 全自动组织包埋机(日本樱花集团);光学显微镜(日本OLYMPUS公司);实时荧光定量PCR(qRCR)仪(CFX96型,美国Bio-Rad公司);Eppendorf Research移液器(德国Eppendorf公司);台式低温超速离心机(德国Eppendorf公司);-80 ℃冰箱(美国Thermo公司);CO2培养箱(美国Thermo公司)等。
1.2.2主要试剂 苏木精-伊红(HE)染色试剂盒(索莱宝(中国)公司),Trizol试剂盒(美国Invitrogen公司),All-in-OneTMmiRNA qRT-PCR Detection kit(美国Gene Copoeia公司),PCR扩增引物、DEPC水(生工生物工程(上海)技术有限公司),氯仿、异丙醇、无水乙醇(中国国药集团),胎牛血清(德国PAN公司),2.5 g/L的胰蛋白酶、青霉素/链霉素注射液(新赛美生物科技有限公司),人食管鳞癌细胞系Eca109、KYSE170、KYSE150、KYSE9706、KYSE30、TE1和TE13(上海弘顺生物科技有限公司),质粒si-uca1、si-nc和pc-dna-uca1(上海吉凯基因化学技术有限公司合成)。
1.3 实验方法
1.3.1标本获取及处理 取病人原发灶处部分癌组织及距离原发灶边缘3~5 cm正常组织。标本切除后立即分为两部分:一部分在新鲜状态下用RNA保存液保存以提取RNA;另一部分用40 g/L甲醛溶液固定,做成蜡块保存,用于HE染色。
1.3.2lncRNAUCA1表达的qPCR检测 Trizol法提取总RNA,采用qPCR两步法进行检测。设计lncRNAUCA1引物,然后使用反转录试剂盒进行反转录得到cDNA,配制qPCR反应体系,设置反应程序(95 ℃预变性 10 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸10 s)进行qPCR扩增。通过软件得到Ct值,单位为HU。
1.3.3食管癌细胞迁移和侵袭实验 采用划痕试验和Transwell侵袭实验分别检测UCA1基因对食管癌细胞迁移能力和侵袭能力的影响。构建表达载体并提取重组质粒,对重组质粒si-UCA1/pc-DNAUCA1进行鉴定,随后进行大量的提取和纯化,测定其浓度和纯度,保存备用。将重组质粒进行转染,转染后提取RNA进行荧光定量验证转染效率。以肿瘤细胞膜着色判断为阳性,根据阳性细胞数及阳性细胞染色强度判断基因表达结果,其中≥3+为过表达,<3+为低表达。按操作说明进行划痕试验,在倒置显微镜下观察划痕后0、12、24 h的划痕间距,计算细胞迁移率。根据操作说明进行Transwell侵袭实验,计数透过人工基底膜的细胞数。
1.4 统计学方法
2 结 果
2.1 癌组织和癌细胞UCA1表达
食管鳞癌组织和癌旁组织的HE染色见图1。qPCR结果表明,原发灶癌组织中UCA1的Ct值为(1.52±0.56) HU,癌旁组织为(0.95±0.36) HU,两者比较差异有显著意义(t=6.174,P<0.01)。UCA1在人食管癌细胞系中的相对表达量分别为:Eca109(0.61±0.08)、KYSE170(0.52±0.11)、KYSE150(0.31±0.05)、KYSE9706(0.29±0.19)、KYSE30(0.28±0.18)、TE1(0.21±0.11)和TE13(0.22±0.12),均明显高于正常食管上皮细胞NE1(0.07±0.03),差异具有统计学意义(F=107.26,P<0.01)。并且Eca109、KYSE170细胞中UCA1表达相对较高,而在TE1和TE13细胞中UCA1的表达较其他细胞系低。因此,选择代表性的食管癌细胞系Eca109、KYSE170、TE1和TE13进行后续相关的研究。
2.2 UCA1表达对食管癌细胞迁移影响
在12和24 h细胞的划痕间距百分比结果表明,与Eca109及KYSE170细胞比较,过表达UCA1基因明显抑制食管癌细胞系TE1和TE13迁移能力,差异有统计学意义(F=187.38~243.88,P<0.01);与TE1和TE13细胞比较,低表达UCA1基因能够明显促进食管癌细胞系Eca109和KYSE170的迁移能力,差异也有统计学意义(F=133.00~1 252.32,P<0.01)。见表1。
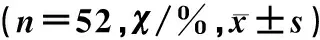

UCA1基因时间(t/h)Eca109KYSE170TE1TE13过表达1275.78±8.1877.42±5.2867.42±2.7850.23±8.342458.54±4.2153.42±6.2843.58±3.7835.21±4.52低表达1263.38±4.5661.32±4.4244.28±2.6844.32±10.062456.32±4.3642.05±3.2520.75±3.9315.98±3.72
注:UCA1基因过表达细胞12 h迁移能力比较,F=187.38,P<0.01;UCA1基因过表达细胞24 h迁移能力比较,F=243.88,P<0.01;UCA1基因低表达细胞12 h迁移能力比较,F=133.00,P<0.01;UCA1基因低表达细胞24 h迁移能力比较,F=1 252.32,P<0.01。
2.3 UCA1表达对食管癌细胞侵袭影响
UCA1过表达的TE1和TE13细胞能够透过人工基底膜的数量明显高于Eca109和KYSE170,差异有统计学意义(F=1 388.68,P<0.01)。提示UCA1基因的过度表达显著促进了TE1和TE13食管癌细胞系的侵袭性。UCA1低表达的Eca109和KYSE170细胞透过人工基底膜的数量明显低于TE1和TE13,差异有统计学意义(F=426.20,P<0.01)。提示UCA1基因的低表达显著抑制了食管癌细胞系Eca109和KYSE170的侵袭性。见表2。
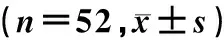

UCA1基因Eca109KYSE170TE1TE13过表达267.21±11.90291.24±19.13434.52±13.28393.65±16.74低表达224.72±17.06208.68±24.12301.18±11.63309.06±17.02
注:过表达组侵袭能力比较,F=1 388.68,P<0.01;低表达组侵袭能力比较,F=426.22,P<0.01。
3 讨 论
lncRNAs能够在表观遗传学、转录调控和转录后调控等不同水平上调控基因表达。国外的研究结果显示,lncRNAs的异常表达在各种恶性肿瘤的发生过程中起着重要作用[14-17]。肿瘤的发生是原癌基因激活、抑癌基因失活和细胞的永生化等过程所致,正常细胞有完善调控系统使有抑癌作用和致癌作用lncRNAs处于动态平衡,而在肿瘤细胞中这种平衡被打破。研究显示,UCA1在多种肿瘤的发生中发挥作用,如胃癌、胰腺癌和宫颈癌等[18-21]。
本文对UCA1在食管鳞癌中的表达水平及其对肿瘤细胞的迁移、黏附调控作用进行探讨。qPCR结果表明,原发灶癌组织中UCA1的Ct值明显高于癌旁非肿瘤组织,说明肿瘤组织中的UCA1表达水平明显升高,这与已有报道结果相符[22-24]。说明UCA1与食管癌的发生有一定关系,提示UCA1有可能作为食管癌的肿瘤标志物。
肿瘤细胞发生侵袭和转移涉及细胞外基质的降解和上皮细胞-间充质转化(EMT),细胞间黏附破坏对上皮可塑性的维持非常重要,该过程由钙黏蛋白介导,这已被证实是癌症的最初事件[25]。在肿瘤的发展过程中,细胞黏附破坏是一个重要的侵袭和转移事件。本文对UCA1表达在食管鳞癌细胞侵袭和迁移中的影响进行观察,研究结果显示,低表达UCA1可抑制Eca109和KYSE170细胞迁移能力,过表达UCA1促进了TE1和TE13细胞迁移能力;低表达UCA1抑制了Eca109和KYSE170细胞的侵袭能力,过表达UCA1促进了TE1和TE13细胞侵袭能力。这表明过表达的UCA1可以促进食管鳞癌细胞的迁移、侵袭能力,反之,干扰UCA1则起到相反的作用。国外通过流式细胞术分析显示,低表达UCA1基因可以上调EMT相关转录因子E-cadherin的表达,下调N-cadherin、Snail和Vimentin的表达,抑制食管癌细胞的迁移和侵袭能力;过表达UCA1基因可以下调EMT相关转录因子E-cadherin的表达,上调N-cadherin、Snail和Vimentin的表达,促进食管癌细胞的迁移和侵袭能力[26]。
综上所述,lncRNAUCA1在食管鳞癌呈高表达水平,促进食管癌细胞侵袭和迁移能力,抑制了食管癌细胞凋亡。本研究同时也证实,血清lncRNAUCA1可作为食管鳞癌病人诊断的新型潜在的循环肿瘤标志物,值得临床推广应用。

