HDAC9基因沉默对非小细胞肺癌细胞生物学特性和Wnt信号通路影响
侯欣,王志伟,贾梦英,杨芳,宋慧琴2,段永建
(河南大学第一附属医院,河南 开封 475001 1 肿瘤科; 2 病理科)
肺癌病死率极高[1],尤以非小细胞肺癌为著,预后极差[2-3]。组蛋白脱乙酰酶9(HDAC9)是一种转录抑制因子,可参与机体生长发育过程[4],在多种癌症中表达异常[5-7]。Wnt蛋白是生物发育过程所需的分泌型蛋白生长因子[8]。癌基因可通过激活或抑制经典的Wnt信号通路,参与肿瘤的进程[9-11]。目前,有关HDAC9基因与非小细胞肺癌关系的研究尚不多见。本研究探讨了HDAC9基因沉默对非小细胞肺癌细胞生物学特性和 Wnt 信号通路的影响,以期为非小细胞肺癌发病的分子机制和临床治疗机制研究奠定理论基础,从而为肺癌诊疗提供新的研究方向。
1 材料与方法
1.1 主要试剂与仪器
体积分数为0.10的胎牛血清(上海索宝生物科技有限公司);DMEM培养基、BPMI 1640培养基和2.5 g/L胰蛋白酶(Hyclon公司,美国);非小细胞肺癌细胞株A549(中国科学院上海生命科学研究院细胞资源中心);Lipofectamin 2000、RNA提取试剂盒(Invitrogen公司,美国);实时荧光定量PCR(qRT-PCR)仪(赛默飞世尔科技(中国)有限公司);免疫印迹(Western blot)抗体(武汉博士德公司);CCK8试剂(Sigma公司,美国);酶联免疫检测仪(上海精密仪器仪表有限公司);甲紫染色剂(碧云天生物技术有限公司);钙离子依赖性磷脂结合蛋白和碘化丙啶(上海联迈生物工程有限公司)。
1.2 非小细胞肺癌细胞培养
使用含体积分数0.10的胎牛血清的DMEM完全培养基,将A549培养在37 ℃、体积分数0.05 CO2培养箱中,待细胞达到80%融合时,用2.5 g/L胰蛋白酶消化,传代培养。
1.3 细胞的分组及转染
取A549采用含体积分数0.10胎牛血清并加入双抗的BPMI 1640培养,置于37 ℃、体积分数0.05 CO2、饱和湿度培养箱中孵育24 h。细胞随机分组为:Blank组(a组,不转染任何序列)、NC组(b组,转染HDAC9阴性对照序列)、pcDNA-HDAC9组(c组,转染HDAC9过表达载体)、si-HDAC9组(d组,转染si-HDAC9)、si-HDAC9+rWnt3a组(e组,转染沉默HDAC9同时加入Wnt信号通路激动剂rWnt3a刺激细胞)。将处于对数生长期的各组细胞接种于6孔板中,细胞生长至30%~50%融合时,按Lipofectamin 2000说明书转染细胞。培养24~48 h后,进行后续实验。
1.4 检测指标及实验方法
1.4.1基因表达的qRT-PCR检测 分别收集各组A549细胞培养48 h后,采用RNA提取试剂盒提取RNA。分别设计HDAC9、JNK、β-catenin、Wnt-5和GAPDH引物,交由Takara公司合成。使用Prime Script RT试剂盒将RNA逆转录成cDNA,逆转录体系10 μL,参照说明书进行。取反应液进行荧光定量PCR,参照SYBR®Premix Ex TaqTMⅡ试剂盒说明书进行。在ABI PRISM®7300系统进行荧光定量PCR检测。以GAPDH为内参,分别计算HDAC9、JNK、β-catenin和Wnt-5相对表达水平。每组实验重复3次,每次取3个样本。
1.4.2蛋白表达的Western blot检测 收集转染48 h后A549,加蛋白裂解液,离心取上清液分装备用。测定各样品蛋白浓度,去离子水调整,确保上样量一致。配制100 g/L SDS分离胶与浓缩胶。样品与加样缓冲液混合,100 ℃煮沸5 min,冰浴、离心后进行电泳分离,再将蛋白转移至硝酸纤维素膜上。50 g/L脱脂奶粉4 ℃封膜过夜。滴加一抗(兔抗鼠多克隆抗体HDAC9、JNK、β-catenin和Wnt-5)孵育过夜;PBS洗涤3次后滴加辣根过氧化物酶标记的羊抗兔IgG二抗,37 ℃振荡孵育1 h。TBST 洗膜,辣根过氧化物酶ECL显影,扫描记录。利用Image J软件对目的条带进行灰度值分析。每组实验重复3次,每次取3个样本。
1.4.3细胞增殖的CCK8检测 将各组细胞分别接种于96孔板。待各组转染24 h后,PBS液洗2次,2.5 g/L胰蛋白酶消化,制成单细胞悬液。调整细胞密度(3 000~ 6 000个细胞),接种于96孔板中,重复6孔,置于培养箱,分别于培养24、48、72 和96 h时取出培养板,每孔加入10 μL的CCK8继续培养2 h,于酶联免疫检测仪450 nm波长处读取各孔光密度(OD)值。以时间为横坐标,OD值为纵坐标绘制细胞活力曲线图。每组实验重复3次,每次取3个样本。
1.4.4划痕实验检测细胞迁移 取转染24 h 各组细胞,将细胞接种于6孔板中,细胞生长完全融合后,用 10 μL枪头在孔板中心轴处沿直线轻轻划痕。培养24 h后在光学显微镜下观察拍照,以细胞划痕愈合百分比表示细胞迁移能力。每组实验重复3次,每次取3个样本。
1.4.5Transwell实验检测细胞侵袭 转染后48 h消化收集各组细胞,使用含体积分数0.01胎牛血清的DEME重悬细胞。取各组细胞悬液200 μL加入Transwell小室,下室加750 μL含体积分数0.10胎牛血清的DEME,置37 ℃孵箱内继续培养,24 h后取出小室,用甲醇固定30 min,再以1 g/L甲紫染色20 min,棉签轻轻擦去上层未迁移细胞。在400倍光学显微镜下随机选取5个视野观察细胞并计数。每组实验重复3次,每次取3个样本。
1.4.6流式细胞术检测细胞凋亡 细胞转染后96 h,用不含EDTA的胰蛋白酶消化;使用4 ℃预冷PBS洗涤,弃上清液,结合缓冲液重悬细胞;移取100 μL细胞悬液于流式管内,加入钙离子依赖性磷脂结合蛋白和1 g/L碘化丙啶各5 μL;室温避光反应15 min;加入400 μL结合缓冲液,1 h内进行流式细胞术检测。每组实验重复3次,每次取3个样本。
1.5 统计学方法
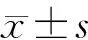
2 结 果
2.1 HDAC9基因沉默检测
qRT-PCR和Western blot检测结果显示,与NC组细胞相比较,si-HDAC9组细胞的HDAC9mRNA(0.99±0.05 vs. 0.43±0.04)和蛋白(1.01±0.06 vs. 0.59±0.04)表达水平明显下降,差异均有统计学意义(t=15.15、10.09,P<0.05)。
2.2 HDAC9基因沉默对Wnt信号通路影响
qRT-PCR和Western blot检测HDAC9、JNK、β-catenin、Wnt-5的mRNA和蛋白表达结果表明,各基因mRNA和蛋白表达组间差异有显著性(FmRNA=66.590~155.800,P均<0.05;F蛋白=83.110~159.400,P均<0.05)。Blank组和NC组间差异无统计学意义(P>0.05)。与NC组相比,pcDNA-HDAC9组各基因mRNA和蛋白表达水平均上升(tmRNA=5.125~15.990,P均<0.05;t蛋白=6.775~13.690,P均<0.05);si-HDAC9组均明显下降(tmRNA=3.966~13.930,P均<0.05;t蛋白=4.342~9.992,P均<0.05);且与si-HDAC9组相比,si-HDAC9+rWnt3a组各基因mRNA和蛋白表达水平水平逆转,呈上升趋势(tmRNA=15.390~16.800,P均<0.05;t蛋白=11.230~21.420,P均<0.05)。 见图1。
2.3 HDAC9基因沉默对细胞增殖影响
CCK8检测显示,各组细胞增殖能力在0 h时无明显差异(P>0.05);在24~96 h细胞增殖能力组间差异有显著性(F=9.070~66.850,P<0.05)。Blank组和NC组间差异无统计学意义(P>0.05)。与NC组相比,pcDNA-HDAC9组中细胞增殖速度在48~96 h均明显加快(t=3.571~10.590,P均<0.05);而si-HDAC9组在24~96 h显著减慢(t=4.045~12.860,P均<0.05);且与si-HDAC9组相比,si-HDAC9+rWnt3a组细胞增殖速度在24~96 h逆转,呈上升趋势(t=2.921~3.807,P均<0.05)。见图2A。
2.4 HDAC9基因沉默对细胞迁移和侵袭影响
划痕实验和Transwell侵袭的研究结果显示,细胞迁移和侵袭能力的组间差异有显著意义(F=13.000、19.690,P均<0.05)。Blank组与NC组比较无明显差异(P>0.05);与NC组相比,pcDNA-HDAC9组中细胞迁移和侵袭能力显著增强(t=2.933、3.728,P均<0.05);而si-HDAC9组显著减弱(t=3.437、5.116,P均<0.05);且与si-HDAC9组相比,si-HDAC9+rWnt3a组细胞迁移和侵袭能力逆转,呈上升趋势(t=3.984、4.032,P均<0.05)。见图2B、C。
2.5 HDAC9基因沉默对细胞凋亡影响
流式细胞术检测结果表明,Blank组、NC组、pcDNA-HDAC9组、si-HDAC9组和si-HDAC9+rWnt3a组的细胞凋亡率分别为(28.75±1.77)%、(30.24±1.68)%、(20.61±1.40)%、(41.20±2.32)%和(24.52±1.42)%,细胞凋亡组间比较差异有显著性(F=58.990,P<0.05)。Blank组与NC组细胞凋亡率差异无显著性(P>0.05);与NC组相比较,pcDNA-HDAC9组中细胞凋亡显著降低(t=7.627,P<0.05);而si-HDAC9组细胞凋亡显著升高(t=6.627,P<0.05);且与si-HDAC9组相比,si-HDAC9+rWnt3a组细胞凋亡逆转,呈下降趋势(t=10.620,P<0.05)。见图3。
3 讨 论
肺癌死亡率居世界第1位[12-13]。我国肺癌死亡率亦呈逐年上升趋势[14-15]。肺癌预后极差。究其原因在于肿瘤转移率和复发率高,肿瘤细胞具有免疫逃逸、自我更新及再生等干细胞特性[16-17]。
HDACs是一类转录抑制因子[18],可分为四大类,HDAC9隶属于Ⅱ型中的Ⅱa型,参与分化和发育过程[19]。其在多数肿瘤中呈高表达[20-21]。此外,经典Wnt信号通路主要通过3种途径调节细胞行为并介导细胞间相互作用,如Wnt/β-catenin通路、Wnt/PcR通路以及Wnt/Ca2+途径[22],在肿瘤的发生发展中发挥作用[23-25]。非小细胞肺癌中常伴随Wnt信号通路的激活[26]。本研究之初推测,通过小分子干扰RNA、抗Wnt信号通路相关因子表达或其他方法,可抑制Wnt信号通路激活,抑制下游相关蛋白表达,阻断非小细胞肺癌的发展。本文基于这一推论,验证HDAC9基因沉默介导Wnt信号通路对非小细胞肺癌细胞生物学特性的作用机制。
本文的研究结果显示,HDAC9沉默序列能明显降低HDAC9基因的mRNA和蛋白表达,从而沉默HDAC9基因。同时,pcDNA-HDAC9转染细胞后HDAC9、JNK、β-catenin、Wnt-5表达水平上升;而si-HDAC9转染导致各因子表达水平下降。因此,相较于HDAC9表达上调对癌细胞Wnt信号通路相关蛋白的表达的影响,HDAC9沉默表达可抑制Wnt信号通路的激活。另外,本文同时设立si-HDAC9+rWnt3a组,旨在支持沉默HDAC9表达对Wnt信号通路的激活的抑制作用。rWnt3a为Wnt信号通路的激动剂[27],通过转染si-HDAC9和rWnt3a,沉默HDAC9表达对JNK、β-catenin和Wnt-5表达的抑制作用逆转,证实本文推测的合理性。同时,si-HDAC9转染导致细胞生长受到抑制,细胞增殖、迁移和侵袭能力明显降低,凋亡增加;且si-HDAC9+rWnt3a转染可逆转si-HDAC9转染后的上述趋势。因此,HDAC9基因沉默可以抑制Wnt信号通路的激活,从而参与对非小细胞肺癌细胞生物学特性的调节。
A为qRT-PCR检测各组mRNA表达;B为Western blot检测各组蛋白表达;C为各蛋白电泳条带图。a:Blank组,b:NC组,c:pcDNA-HDAC9组,d:si-HDAC9组,e:si-HDAC9+rWnt3a组。与Blank组和NC组比较,*P<0.05;与si-HDAC9组比较,#P<0.05。
图1 各组细胞中HDAC9、JNK、β-catenin、Wnt-5的mRNA及蛋白表达检测
A为细胞增殖能力变化;B为细胞迁移数变化;C为细胞侵袭数变化。a:Blank组,b:NC组,c:pcDNA-HDAC9组,d:si-HDAC9组,e:si-HDAC9+rWnt3a组。与Blank组和NC组相比,*P<0.05;与si-HDAC9组相比,#P<0.05。
图2 各组细胞增殖、迁移和侵袭能力的检测
总之,本研究证实HDAC9沉默表达可通过抑制Wnt信号通路激活,抑制非小细胞肺癌细胞增殖、迁移与侵袭并促进细胞凋亡,为非小细胞肺癌的靶向治疗提供了潜在分子靶点。Wnt信号通路是一个复杂网络体系,且与其他信号转导途径关联密切[28-29]。非小细胞肺癌中是否还存在Wnt信号通路与其他途径的相互作用尚未明确;HDAC9沉默表达是否可作为特异性靶基因,并介导非小细胞肺癌细胞耐药,均有待于未来进一步探究。

